膜芯片法在结核杆菌耐药快速检测中的应用价值
韩晓静,林 牧,陶 雪,龚亚东,唐 竹,陈云华,马庆庆
(贵州航天医院中心实验室,贵州 遵义 563000)
结核病(tuberculosis,TB)是由结核分枝杆菌(mycobacterium tuberculoss,MTB)感染引起的慢性传染病[1],已成为全球单因致死率最高的传染病[2]。近年致死率极高的耐药结核患者不断增多,与早期诊断及防控的薄弱和不足等原因密切相关。目前罗氏培养+药敏试验是检测MTB耐药的金标准,但存在周期长、准确性较低、灵敏度差等缺点[3-4],远不能满足临床需要。随着MTB耐药分子机制研究的深入,目前已明确MTB的rpoB、inhA、katG、rpsL、embB等基因突变与结核耐药有关[5-8]。基因芯片技术具有快速、准确率高、重复性好、通量高等特点,可应用于MTB耐药基因的检测[7-8]。本研究应用PCR-反向点杂交技术(膜芯片技术)对MTB与利福平(rifampicin,RFP)、异烟肼(isoniazid,INH)、链霉素(streptomycin,SM)和乙胺丁醇(ethambutol,EMB)耐药相关的突变基因进行检测,与药敏培养比例法检测结果进行分析对比,探讨PCR-反向点杂交法(膜芯片法)在MTB耐药快速检测中的应用价值。
1 资料与方法
1.1一般材料:选取2017年11月~2018年11月间在我院就诊的441例菌阳性肺结核患者,其中男276例,女165例,年龄13~88岁,平均(41.25±5.56)岁。纳入病例均符合中华医学会结核病学会《肺结核诊断和治疗指南》、《临床诊疗手册(结核病分册)》、《结核病防治手册(菌阳肺结核诊断标准)》中的诊断标准,性别、年龄随机分布。排除标准:①合并肿瘤、高血压、糖尿病、自身免疫性疾病及服用免疫抑制药物的患者;②孕妇或哺乳期妇女;③HBV、HCV、HIV 感染者或(和)AIDS 患者。
1.2主要仪器设备:分枝杆菌核酸检测试剂盒(北京博奥,中国),结核分枝杆菌耐药突变基因检测试剂盒(PCR-反向点杂交法,深圳亚能),YN-H16型恒温杂交仪(深圳亚能),2720 Thermal Cycler PCR仪(ABI)等。
1.3方法
1.3.1标本采集:同时采集菌阳性肺结核患者深部晨痰5 ml以上,置于2个无菌50 ml离心管中(一份进行MTB-DNA提取,另一份进行MTB培养及药敏试验),密封,当日检测。
1.3.2MTB培养及比例法药物敏感试验:采用罗氏培养比例法进行药物敏感实验,试验方法严格按照《结核病诊断实验室检验规程》、《结核病诊断细菌学检验规程》操作。4种抗结核药物的低浓度、高度浓度标准:利福平浓度为50 μg/ml、250 μg/ml,异烟肼浓度为1 μg/mL、10 μg/ml,链霉素浓度为10 μg/ml、100 μg/ml,乙胺丁醇浓度为5 μg/ml、50 μg/ml,只要对一种浓度耐药即可认为该样本对此药物耐药。
1.3.3痰液MTB-DNA提取及PCR扩增:痰液加入NaOH溶液摇匀液化,液化后痰液按北京博奥生物有限公司分枝杆菌核酸检测试剂盒说明书进行MTB-DNA的提取。取4 μl上清液(MTB-DNA)于PCR管中进行PCR扩增,按深圳亚能生物技术有限公司结核分枝杆菌耐药突变基因检测试剂盒说明书的扩增条件进行扩增。
1.3.4反向点杂交及结果判读:取检测膜条置于15 ml离心管中,加PCR产物,杂交按深圳亚能结核分枝杆菌耐药突变基因检测试剂盒说明书进行,膜条避光显色,出现蓝色斑点即为含有相应的待检基因,尼龙膜条芯片上探针排列见表1。
1.3.5耐药类型定义:单耐药:对一种抗结核药物耐药;多耐药:对一种以上抗结核药物耐药(除同时耐利福平和异烟肼外);耐多药(MDR-TB):至少对利福平和异烟肼耐药[9]。
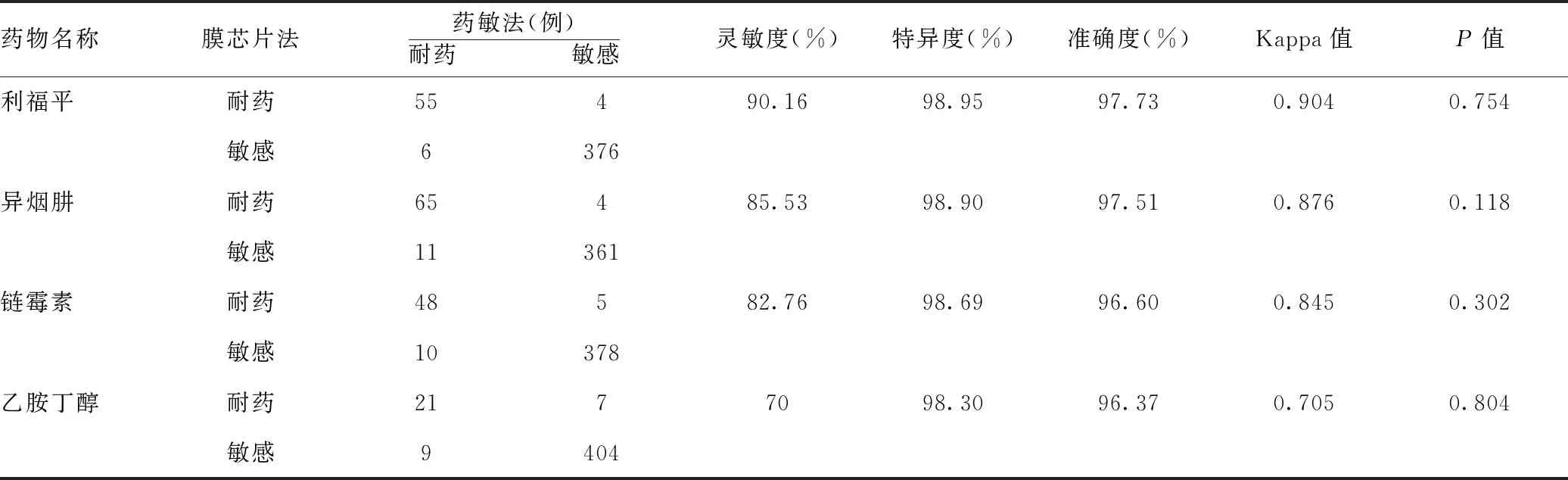
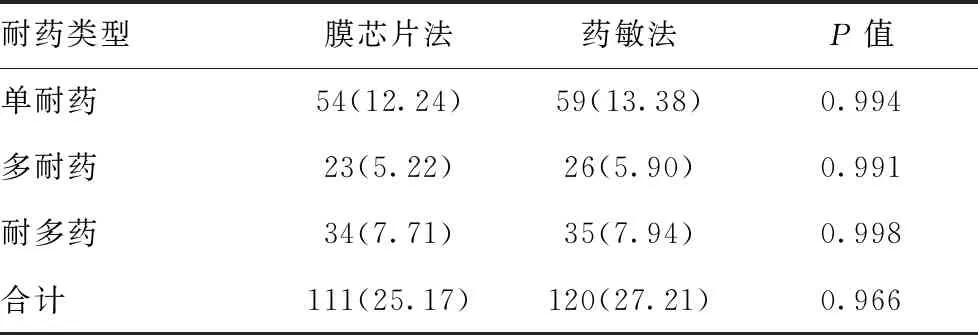
1.4统计数据:所有数据均采用SPSS 17.0统计软件进行处理,计数资料采用率(%)表示,以培养加药敏法结果为金标准,应用χ2检验比较各组耐药率、敏感度、特异度、准确度等指标,P< 0.05表示差异具有统计学意义。一致性检验用Kappa检验,Kappa >0.8为两者一致性非常好;0.6 表1 膜芯片上探针位点排布图 N1N2N3N4N5D516VD516GH526YH526DS531LS531W315N-15N43N88N306NCC315M-15M43M88M306M1306M2 注: N1~N5代表利福平rpoB基因507~533位密码子为野生型,315N、-15N代表异烟肼katG基因第315、inhA基因第15密码子位点为野生型,3N、88N代表链霉素rpsL基因第43、88密码子位点为野生型,306N代表乙胺丁醇embB基因第306密码子位点为野生型。D516V、D516G、H536Y、H536D、S531L、S531W代表利福平rpoB基因相应位点突变,315M、-15M代表异烟肼katG、inhA基因相应位点突变,443M、88M代表链霉素rpsL基因相应位点突变,306M1、306M2代表乙胺丁醇embB基因相应位点突变 2.1四种抗结核药物耐药检出情况:以培养+药敏法测定的耐药结果为金标准,膜芯片法对利福平、异烟肼、链霉素和乙胺丁醇耐药检出率、灵敏度、特异度、准确度分别见表2。441例样本中膜芯片法检出利福平耐药59例(13.38%)、异烟肼耐药69例(15.65%)、链霉素耐药53例(12.02%)、乙胺丁醇耐药28例(6.35%)。两种方法差异无统计学意义(P>0.05),一致性检验显示Kappa均>0.7,即膜芯片法与培养+药敏法对四种药物耐药的检出一致性较好。 表2 四种抗结核药物耐药检出情况(n=441) 药物名称膜芯片法药敏法(例)耐药 敏感灵敏度(%)特异度(%)准确度(%)Kappa值P值利福平耐药55490.1698.9597.730.9040.754敏感6376异烟肼耐药65485.5398.9097.510.8760.118敏感11361链霉素耐药48582.7698.6996.600.8450.302敏感10378乙胺丁醇耐药2177098.3096.370.7050.804敏感9404 2.2MTB耐药类型比较:膜芯片法和培养+药敏法检测441例样本,检出总耐药、单耐药、多耐药和耐多药例数及耐药率见表3,两种方法差异无统计学意义(P>0.05)。 表3 膜芯片法和药敏法检出MTB耐药类型[例(%),n=441] 耐药类型膜芯片法药敏法P值单耐药54(12.24)59(13.38)0.994多耐药23(5.22)26(5.90)0.991耐多药34(7.71)35(7.94)0.998合计111(25.17)120(27.21)0.966 目前MTB对利福平和异烟肼耐药的分子机制相对明确,利福平耐药相关突变主要集中在rpoB基因核心区一段长约81bp的片段上[10],该区域突变率达95%以上[11-12]。异烟肼耐药突变基因主要是katG和inhA基因(70%左右)[7,13-14]。链霉素的耐药与编码核糖体S12蛋白的rpsL基因和编码16SrRNA的rrs基因突变有关[15],耐乙胺丁醇与阿拉伯糖基转移酶编码基因embB基因突变有关,embB基因长约3246bp[16],其余尚未明确。本研究所用的膜芯片探针几乎已覆盖利福平、异烟肼、链霉素和乙胺丁醇耐药相关基因。 以培养+药敏法测定的MTB耐药结果为金标准,本研究用膜芯片法检测利福平、异烟肼、链霉素和乙胺丁醇耐药性的灵敏度良好、特异度极高、准确度较高,两种方法对4种抗结核药耐药的检出率差异无统计学意义(P>0.05),且一致性较好(Kappa>0.7),尤以利福平最高,因膜芯片覆盖的rpoB基因探针较全(95%以上)。而MTB乙胺丁醇耐药率、灵敏度及一致性较其他3种药物更低,与其耐药突变基因的相关研究并未明确有关,加之embB基因片段较长,现有膜芯片更是无法完全覆盖。 综上所述,与传统的培养+药敏试验相比,膜芯片法应用于结核分枝杆菌耐药基因的快速检测具有较高敏感度、高特异度和高准确度、操作简便、快速(仅需1 d)的优势,因此膜芯片技术检测结核杆菌耐药基因可作为实验室辅助检查手段,对指导临床进行有效、快速的抗结核治疗,具有重要应用价值。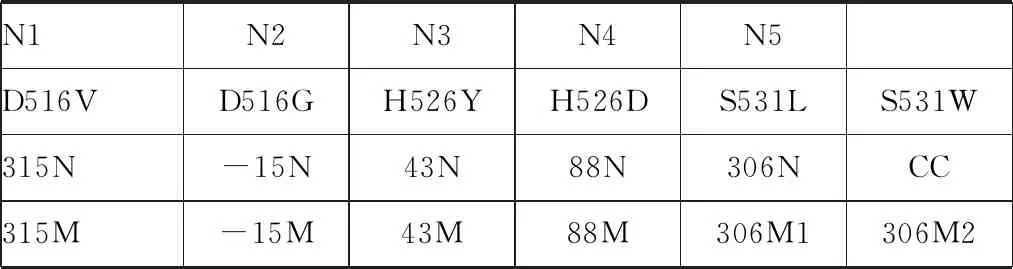
2 结果
3 讨论

