小黄鱼养殖群体与野生群体形态性状差异性分析
储天琪,王梦洁,刘 峰,詹 炜,谢庆平,楼 宝
(1.浙江海洋大学水产学院,浙江舟山 316022;2.浙江省农业科学院水生生物研究所,浙江杭州 310021)
小黄鱼Larimichthys polyactis,又名小鲜、黄花鱼等,隶属于石首鱼科Sciaendae、黄鱼属Larimichthys,是中国近海渔业的重要经济种类[1],与大黄鱼L.crocea、曼氏无针乌贼Sepiella maindron、带鱼Trichiurus japonicas 并称为我国传统“四大海产”。目前,由于人为过度捕捞、生态环境恶化等诸多因素,小黄鱼野生资源严重衰竭[2],捕获的小黄鱼呈年龄组成序列缩短、性成熟提前、个体小型化等特点[3]。而小黄鱼人工繁殖技术的突破[4],也为开展小黄鱼规模化人工繁殖和增殖放流奠定了重要基础,在实现保护小黄鱼野生资源的同时,还可以满足人们的消费需求。
在水产动物中,人工养殖群体的形态特征与野生群体往往存在不同程度的差异,如人工养殖的大黄鱼的外观与野生群体相比发生了较大变化,养殖群体有显著高的肥满度(P<0.05),而野生群体有较高的背部黄色值和腹部红色值、黄色值(P<0.05)[5];唐鱼Tanichtys albonubes 野生种群与养殖群体在体高/体长、头长/体长、尾柄长/体长以及尾柄高/尾柄长几方面差异极显著(P<0.01)[6];长江中华绒螯蟹Eriocheir sinensis 洄游群体与养殖群体在外额齿间距、第一侧齿间距、中央缺刻到颈沟中长、颈沟中到后缘中长、第二侧齿底到后缘界角长、第三步足掌节长、第三步足指节长和第四步足指节长的形态参数上也存在形态差异[7];日本囊对虾Marsupenaeus japonicus 野生群体和养殖群体在形态上也已产生一定程度的差异,且集中在体重、头胸甲的性状上[8];中华乌塘鳢Bostrychus sinensis 野生群体、红树林地埋管道生态养殖群体和池塘养殖群体在体高/体长、吻长/头长、眼径/头长、尾柄长/体长上存在显著差异明显差异(P<0.05)[9];中华鲟Acipenser sinensis Gray 幼鱼野生群体与养殖群体鼻孔、骨板棘长有显著差异[10],以上研究均表明了在人工养殖过程中,养殖环境、养殖方式等对养殖对象的生长发育起到了重要的影响作用,而且直观表现在外在形态上。
小黄鱼的人工繁殖和网箱养殖已经取得成功,但是养殖群体在形态特征上是否与野生群体存在差异还未可知,鉴于此,本次研究采用相关分析、多元回归分析、通径分析以及判别分析等多种方法对养殖群体和野生群体进行比较研究,旨在为阐明两者异同,直观区分养殖群体和野生群体提供理论依据。
1 材料与方法
1.1 实验材料
实验用鱼来源于2016 年4 月从象山港湾收集的野生群体驯化繁殖的后代作为亲本人工繁殖培育而成的F2 代小黄鱼养殖(YZ)群体,在网箱中隔离养殖至10 月时,随机选取无病无伤、肢体完整、反应灵敏的健壮个体养殖群体123 尾作为实验对象。同时,将2016 年10 月在象山港湾收集的当年活体野生(YS)小黄鱼群体89 尾作为研究对象。
1.2 数据采集
通过解剖观察性腺的形态判定每尾鱼的生理性别。用游标卡尺准确测量每一尾鱼的8 个形态性状,包括全长(X1,cm)、体长(X2,cm)、头长(X3,cm)、躯干长(X4,cm)、尾部长(X5,cm)、尾柄长(X6,cm)、尾柄高(X7,cm)、体高(X8,cm),精确至0.01 cm。各个形态性状测量方法如图1 所示[11]。用电子天平准确称量体质量(Y,g),精确至0.01 g。
图1 小黄鱼形态性状测量部位示意图[11]Fig.1 Sketch of mensuration part of morphometric traits for L.polyactis[11]
1.3 分析方法
运用SPSS 软件对两群体数据进行统计分析,计算YZ 群体和YS 群体各表型性状的均值、标准差和变异系数;采用Pearson 法对各性状进行相关性分析;运用逐步引入-剔除法建立形态性状与体质量的多元线性回归方程,进行形态性状对体质量影响作用的通径分析[12],剖析各形态性状对体质量的直接作用(通径系数)和间接作用(间接通径系数)[13];根据所有实验样本的形态性状进行判别分析[14]并计算两群体的判别准确率和综合判别率P[15]。
2 结果
2.1 群体间表型性状比较分析
经性别判定后得知,本次实验中,YZ 群体中雄性个体和雌性个体分别为59 和64 尾,YS 群体中雄性个体67 尾,雌性个体只有22 尾。2 个群体表型性状统计分析结果列于表1。由表1 可知,YZ 群体和YS 群体在除性状X3外均存在显著差异(P<0.05),并且2 个群体各性状的变异系数均较大,其中,YS 群体各性状均显著大于YZ 群体,出现这种较大差异可能的原因是取样个体生长时间有所差异。因此,为了更为准确的对2 个群体进行比较,对表型数据进行了标准化处理,以体长(X2)作为参照,获得各性状的比例性状,对其进行统计分析,结果列于表2。从表2 可看出,两群体在X5/X2上无显著差异,而YZ 群体中X4/X2、X7/X2均显著小于YS 群体(P<0.05)。表明YZ 群体较YS 群体躯干较短、尾柄更为细长。
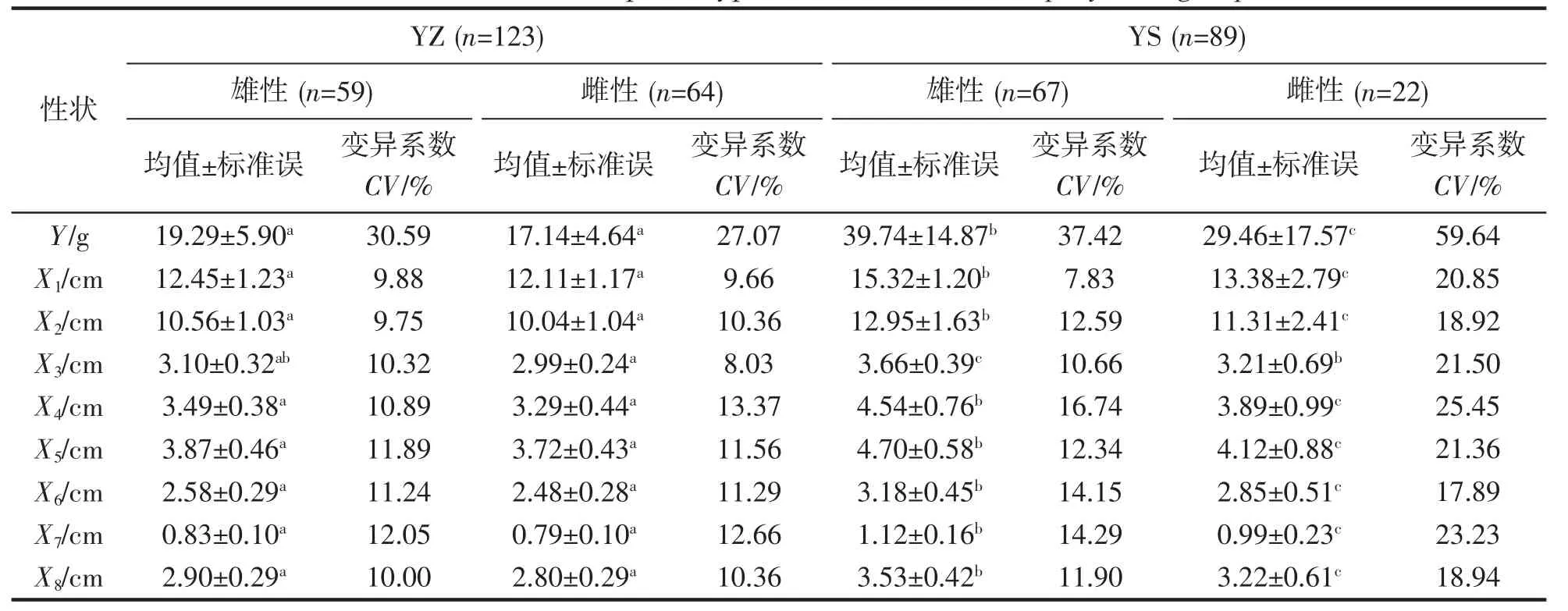
表1 小黄鱼表型性状的统计分析Tab.1 The statistics of phenotypic traits of the two L.polyactis groups
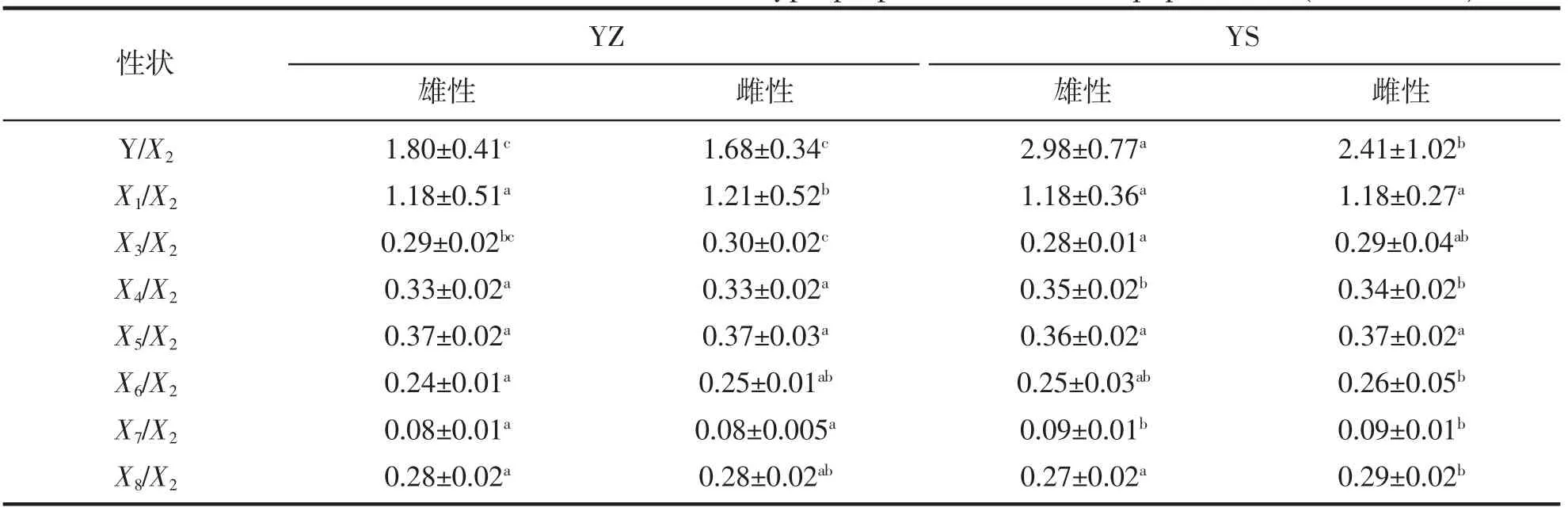
表2 小黄鱼两群体形态比例性状比较分析(均值±标准误)Tab.2 The statistics of characteristics of somatotype proportion of the two populations (Mean ± SE)
2.2 群体内性状间的相关性分析
表3 为YZ 群体(下三角)和YS 群体(上三角)表型性状的相关性分析结果。从表中可以看出:YZ 和YS群体内形态性状均呈极显著相关(P<0.01),但不同性状之间的相关系数差别较大,其中,X1与X2相关性在两群体中均为最高,相关系数分别为0.913(YZ)、0.986(YS);YZ 群体中X4和X8相关性最低,其相关系数为0.671,远小于YS(0.833);YS 群体中X3和X6的相关性最低,其相关系数为0.639,小于YZ(0.770)。形态性状与体质量的相关性分析结果显示,YZ 和YS 群体中与Y 的相关性最高的形态性状并不相同,前者为X1(0.914),而后者为X7(0.948);YZ 群体中X4与Y 之间的相关性最低,为0.763,远小于YS 群体(0.915),而YS群体中与Y 的相关性最低的形态性状是X6,相关系数为0.709,小于YZ 群体(0.835)。
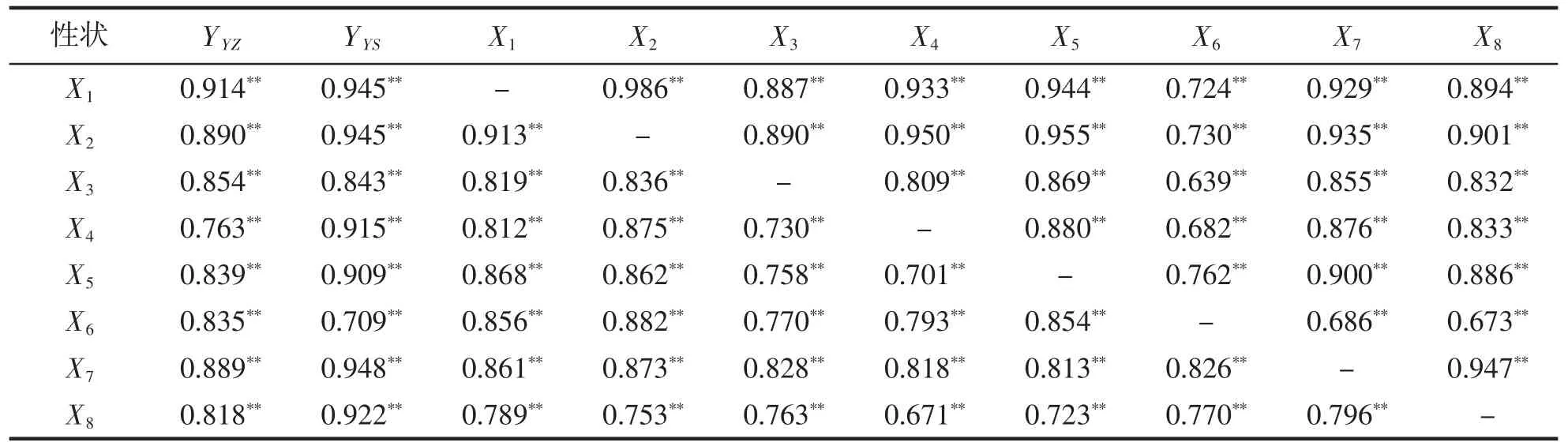
表3 小黄鱼各表型性状间的相关系数Tab.3 The correlation coefficient among the phenotypic traits of L.polyactis
2.3 形态性状与体质量的多元回归分析
采用多元回归的方法分析形态性状对体质量的作用之前,需要进行自变量(形态性状)的共线性诊断,避免自变量之间的严重共线性影响多元回归模型的可靠性。采用逐步引入-剔除自变量的方法得出了小黄鱼YZ 群体和YS 群体在回归分析过程中各种参数的变化情况(表4),可以发现,随着自变量数量的增加,两个回归模型中的相关系数R 值有明显增加,而标准估计误差也逐渐降低,说明回归模型估计的准确性在不断增加,进而表明进入方程模型的自变量在衡量体质量时均发挥了一定的作用。比较发现,YS 群体在相关系数R、决定系数R2和矫正决定系数均普遍高于YZ 群体,两群体构建的方程中自变量也存在一定差异,前者为X1,X7,X3和X8,后者为X7,X4,X1和X8。
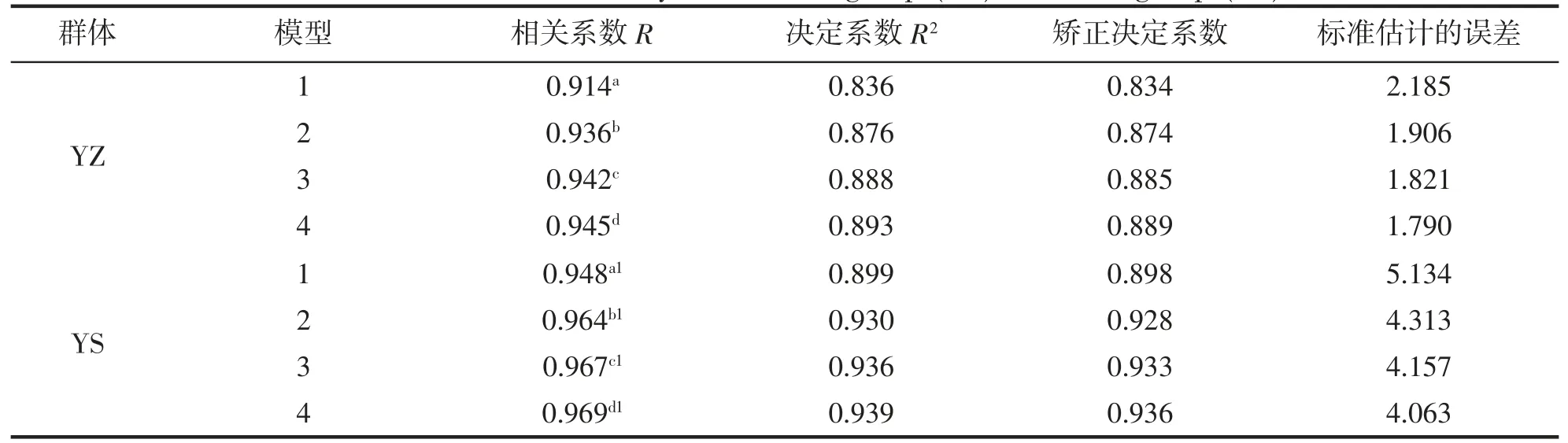
表4 养殖(YZ)和野生(YS)群体模型汇总Tab.4 The model summary of cultured group (YZ) and wild group (YS)
采用逐步法分别构建两群体的多元回归方程,获得了方程中每个自变量的偏回归系数(即非标准化回归系数),对各个自变量的偏回归系数进行显著性检验,检验结果列于表5。表中数据显示,在2 个群体中,各变量的偏回归系数的统计检验均达到显著水平(P<0.05),说明在两群体中,常量和自变量的偏回归系数与0 之间均存在显著性差异,可认为所求的YZ 群体和YS 群体的多元线性回归方程成立。多元回归方程可写为:
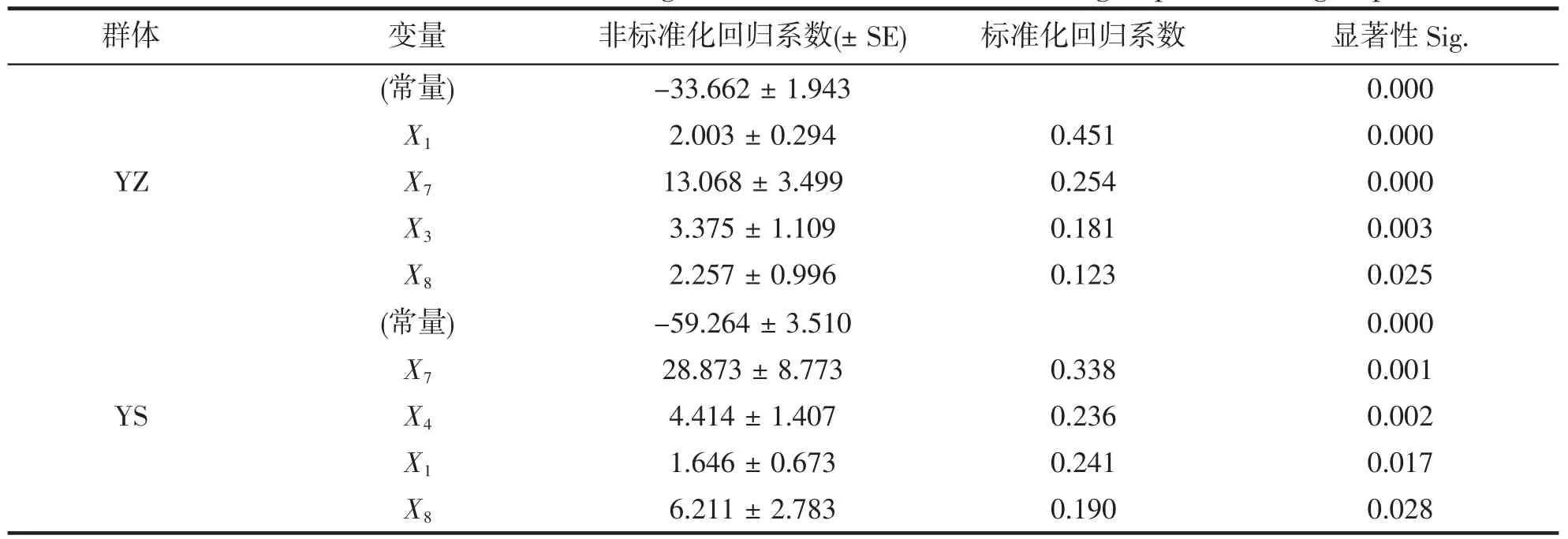
表5 养殖(YZ)和野生(YS)群体回归系数结果Tab.5 The calculation result of regression coefficient of cultured group and wild group
对2 个多元回归方程进行F 检验,结果显示,两者均达到极显著水平(FYZ=245.010,FYS=324.638,P<0.01)(表6),说明所构建的回归方程具有统计意义;由表4 所呈现的两方程决定系数(R2)分别为0.893 和0.939(表4),可以得知从模型中所得出的两组形态性状对Y 有较大的决定作用。
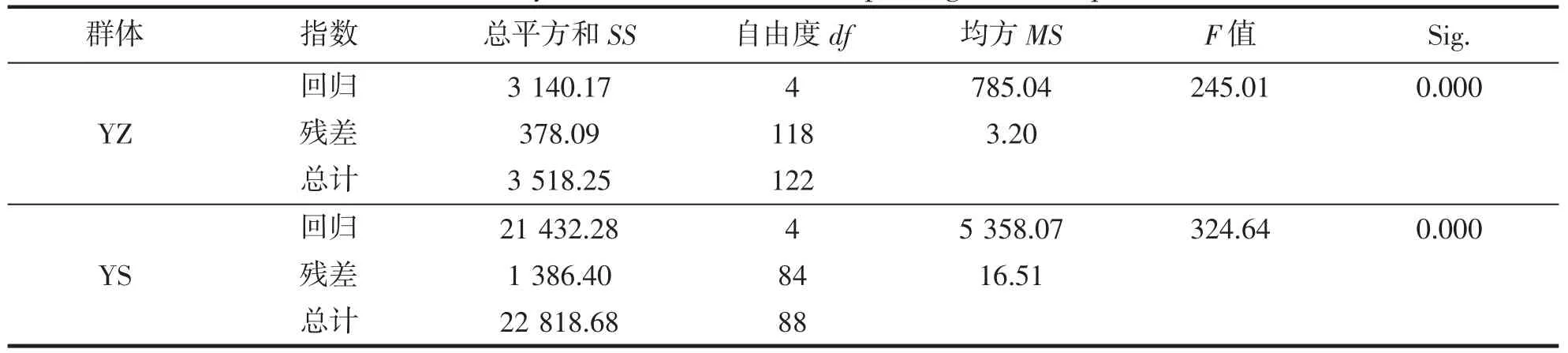
表6 多元回归方程的方差分析Tab.6 Analysis of variance of multiple regression equations
2.4 形态性状对体质量影响作用的通径分析
两群体的形态性状对体质量的影响效应的通径分析结果列于表7 和表8。通径系数反映了自变量对依变量的直接作用,在YZ 群体中,X1对Y 的通径系数最大,即其对Y 的直接作用最大(表7);而在YS 群体中,X7对Y 的直接作用最大(表8)。两个表中数据显示,所有性状通过其它性状对Y 的间接作用的总和均远远大于其自身对Y 的直接作用,表明各性状均通过其他性状对Y 产生一定的间接作用。
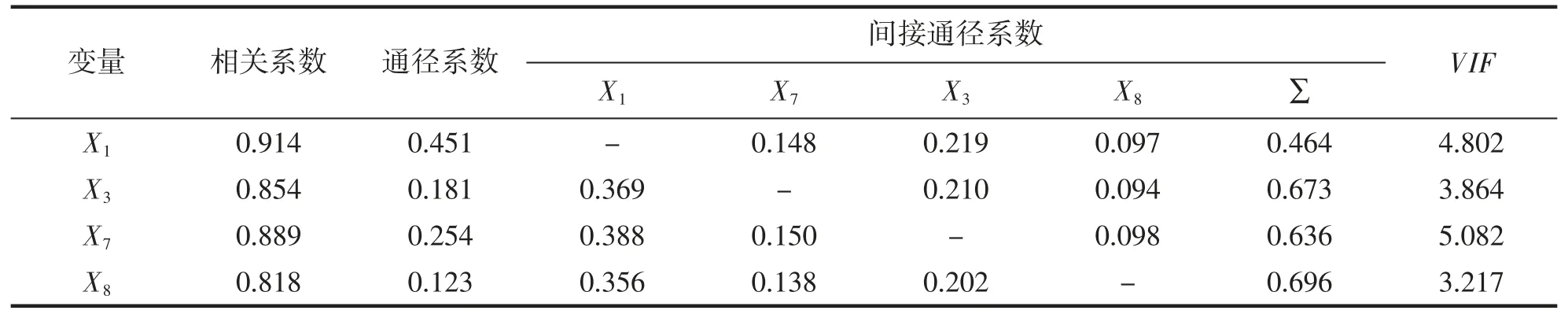
表7 养殖群体相关系数分解Tab.7 Decomposition of correlation coefficient of cultured group
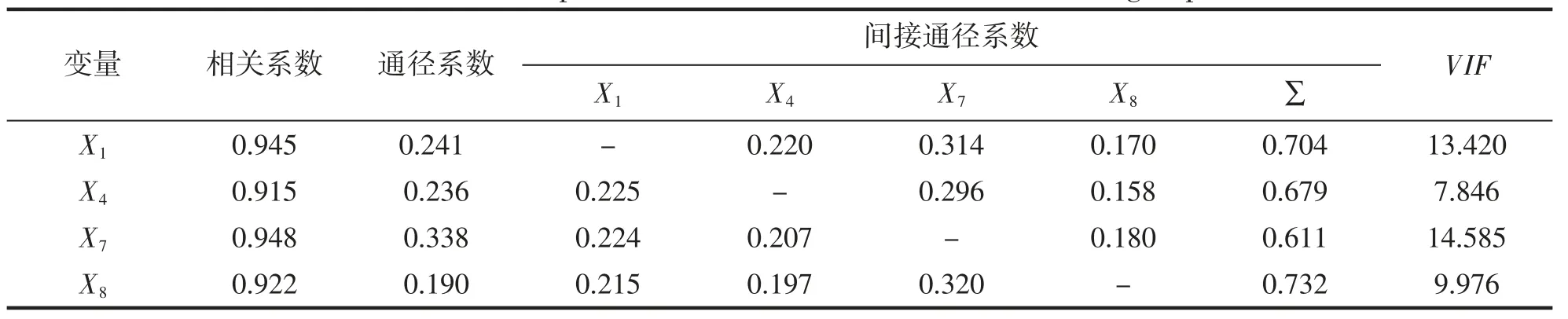
表8 野生群体相关系数分解Tab.8 Decomposition of correlation coefficient of wild group
2.5 形态性状对体质量的决定程度
小黄鱼YZ 和YS 群体各形态性状对体质量的决定系数分别列于表9 和表10。其中,对角线上为各形态性状对体质量的单独决定系数,对角线以上为2 个性状对体质量的共同决定系数。从表9 中可以得知,YZ 群体中,单独决定作用最大的性状为X1(0.203),共同决定作用最大的性状为X1和X7(0.197);与YZ 群体不同,在YS 群体中,X7的单独决定作用最大,为0.114,X1和X7的共同决定作用最大,为0.154(表10)。
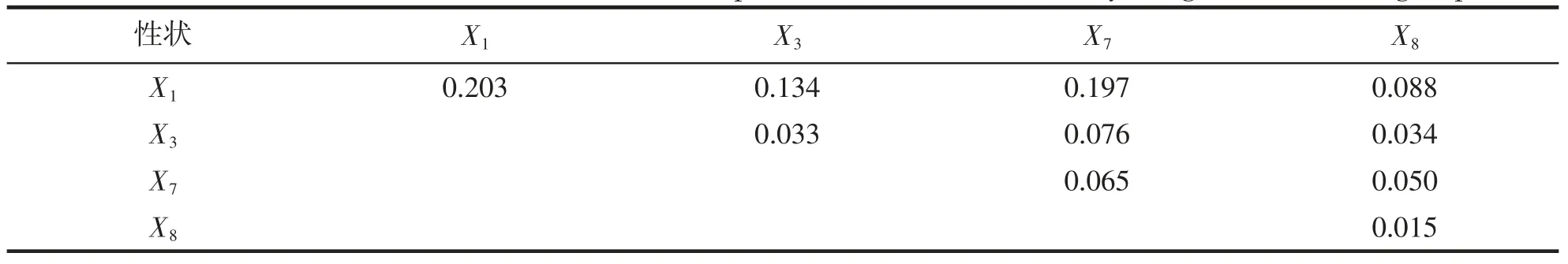
表9 养殖群体形态性状对体重的决定系数Tab.9 The determinant coefficient of the morphometric traits on the body weight of cultured group
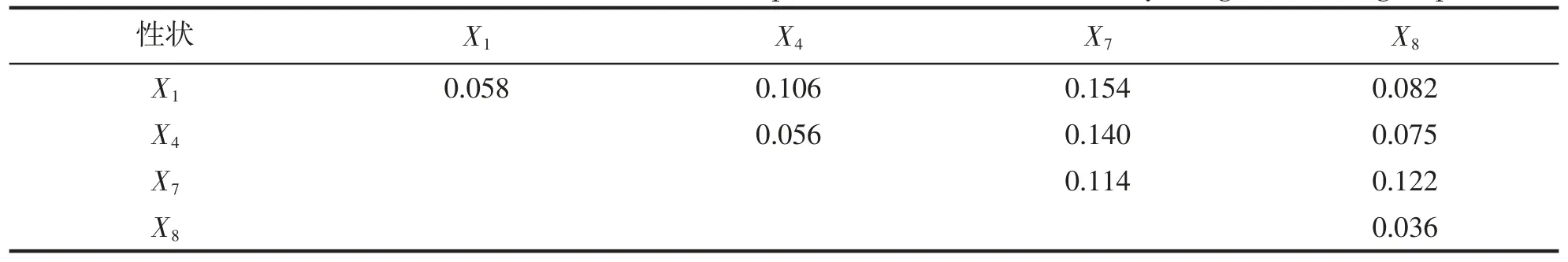
表10 野生群体形态性状对体重的决定系数Tab.10 The determinant coefficient of the morphometric traits on the body weight of wild group
2.6 小黄鱼养殖群体和野生群体形态性状的判别分析
对所有样本的形态性状进行逐步判别分析,筛选出对判别贡献较大的4 个性状,包括X1、X5、X6、X7,F检验表明这些变量均达到极显著水平(P<0.01),根据这4 个性状建立的Fisher 分类函数方程如下:
YYZ=-28.587+4.308 X1+2.468 X5+8.755 X6-34.966 X7
YYS=-39.475+3.617 X1+0.363 X5+11.198 X6-11.874 X7
据此方程对两群体个体进行判别分析,结果显示,YZ 群体的判别准确率为94.31%,高于YS 群体(90.28%),综合判别准确率为85.4%(表11)。
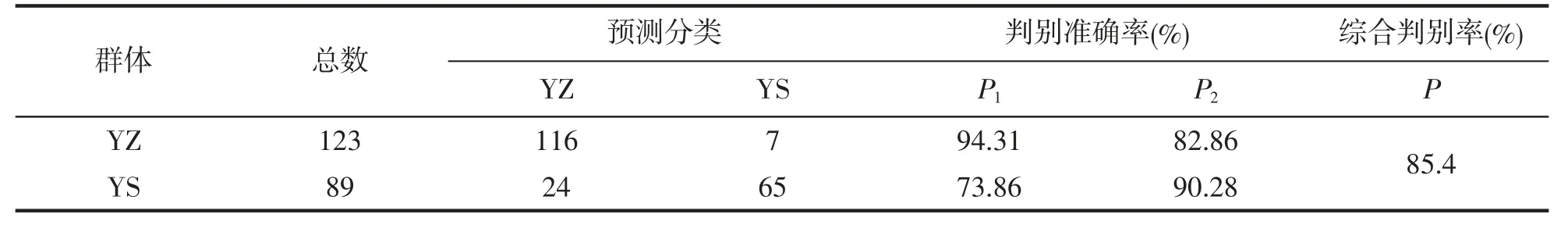
表11 判别分类结果Tab.11 The discrimination classification
3 讨论
3.1 形态学方法分析群体间差异
形态学方法易于掌握,数据便于获取,结果简单直观,是研究物种种质差异的方法之一[16]。同时,形态性状和体质量具有直观性和可度量性,是鱼类遗传育种中进行选择和定向培育的常用指标[17],其中,形态学特征是鱼类人工养殖群体和野生群体鉴别的重要参考依据[18]。形态学分析方法已经应用于许多鱼类不同群体的鉴别,并且效果明显,如张雅芝等[19]和陈慧等[20]研究发现养殖大黄鱼体高/体长比野生群体稍大。本次研究利用形态学方法,对小黄鱼养殖和野生群体进行差异性比较,发现11 个形态指标均存在显著差异,表明两群体在形态特征上具有较好的区分度。
通过对可量、可数性状的简单描述,可以对鱼类种以上进行有效鉴定,但对于种群内的鉴别,却很难做出准确地判定[21]。需要借助聚类分析、主成分分析、判别分析以及多元回归分析等多种方法才能较好地对种群内或者外形相似的种群的形态差异进行区分[22-23]。林艳红等[24]在对3 种裂腹鱼形态差异的研究中,利用多元分析法有效鉴别了群体亲缘关系;王伟等[22]运用上述方法研究了7 个不同翘嘴红鲌群体的形态差异,有效地将各群体区分开来。本次研究通过分析两群体各自的形态性状与体质量之间的关系,建立多元线性回归方程,发现2 个群体的回归方程中均含有全长(X1)、尾柄高(X7)和体高(X8)。此外,野生群体中头长(X3)也作为重要变量被纳入方程,而养殖群体中躯干长(X4)作为影响体质量的一个重要影响因素纳入到回归方程。因此,可以认定头长、躯干长为造成小黄鱼养殖群体和野生群体形态差异的关键变量,据此可以对2 个群体进行较好的区分。
在形态性状对体质量的通径分析及决定作用分析的结果中发现,养殖群体中,全长对小黄鱼体质量的决定作用最大,这与刘峰等[11]通过灰色关联分析得出全长与体质量的关联度最高结果一致。与养殖群体不同,小黄鱼的野生群体中,尾柄高对体质量的决定作用最大,全长的影响作用次之。全长作为影响体质量的重要因素在其他鱼类中已有较多报道,如鲤鱼Cyprinus carpio[25]、褐牙鲆Paralichthys olivaceus[26]、大菱鲆Scophthalmus maximus[27]、梭鱼Liza haematocheila[28]和黄姑鱼Nibea albiflora[29]等。当然也有一些鱼类体质量的关键影响因素并不包括全长性状,如何小燕等[30]发现大口黑鲈Micropterus salmoides 体宽、体长和眼间距与大口黑鲈体重呈极显著正相关,是直接或间接影响大口黑鲈体重的主要形态性状;李培伦等[31]通过对不同月龄大麻哈鱼Oncorhynchus keta 进行通径分析发现体高和体宽均为影响体质量的关键性状指标。以上研究均表明形态性状和体质量之间相互影响,通过分析养殖群体和野生群体各自形态性状对其体质量的影响特点可以更好地挖掘两群体之间的差异性。
3.2 群体间形态差异的原因分析
生物体的形态学特征受环境因子和遗传因子的共同影响[32],由于本研究中养殖群体祖代与野生群体均来源于同一海域,可基本排除由于地理种群的遗传因素而导致两群体在形态上出现差异。因此,可以认为野生和养殖群体的形态学差异主要是因为其不同的生长环境所致。而影响鱼类生长的环境因子包括温度、食物、光照、水流等诸多方面[33]。WAGNER,et al[34]也认为,同一物种的不同群体因长期适应不同的生存环境而形成了各自特有的包括生长、发育、繁殖以及对环境因子的适应力等的生物学特性。生存环境的不同会使鱼类的生长速度不一,进而造成其外形的变异。本次研究中发现小黄鱼YZ 群体的体高/体长值显著大于野生群体,头长和躯干长可作为区分两群体间差异性分析的关键变量,这些差异直观表现在野生群体较养殖群体在外型上显得更加细长,主要原因是养殖群体生活在人工可控条件下,环境条件稳定,完全人工投饵,营养充足,饱食程度高、水体小、无需长距离索饵和逃避敌害,运动能量消耗少,营养物质积累多。而野生群体生活在海洋中,环境变化大、食物来源不稳定,需要主动索饵,同时还需躲避敌害,从而造成了野生群体饱食程度低、运动能量消耗大,营养物质积累慢。因此,导致了养殖群体和野生群体在体型上出现了明显的分化。
3.3 群体差异鉴别的其他方法
单纯从外形性状的差异剖析养殖群体和野生群体的差异,方法单一也不能全面的解释差异性的原因,研究同一物种不同群体间的差异还应考虑品质、遗传和生化标记方面[35]。在品质差异方面,PERIAGO,et al[36]发现,野生舌齿鲈鱼Dicentrarchus labrax 在物性参数(硬度、弹性、咀嚼性、粘黏性)方面优于养殖舌齿鲈鱼。在遗传结构差异方面,DEVRIM MEMIS[37]利用微卫星标记分别对土耳其3 个不同湖泊的野生鲤鱼Cyprinus carpio 进行遗传多样性分析,发现野生遗传多样性水平高于养殖鲤鱼。在生理生化指标上,于娜等[38]发现野生鲻Mugil cephalus 在各消化器官中的淀粉酶活力都强与养殖群体。
因此,对于小黄鱼养殖群体和野生群体的差异性比较还需从各方面进行系统全面的分析和研讨。深入开展养殖驯化品种的差异性变化研究既是对生物学领域的一种扩充也是对野生物种资源的一种保护,具有一定的生物学意义及经济意义。本文从形态差异着手以窥探两者的差异,旨在为他人研究提供铺垫和借鉴经验。

