水稻未知功能结构域基因OsDUF6的抗体制备
姜身飞 谢云杰 李乐乐 王昱澎 蔡秋华 谢华安 张建福


摘要:[目的]制备特异性OsDUF6多克隆抗体,为深入研究OsDUF6在水稻中的生理生化功能提供强有力的工具,为在分子水平上揭示其作用机理奠定基础。[方法]通过对OsDUF6基因进行生物信息学分析,从中选取3段不同区域的氨基酸序列作为抗原,用于抗体制备。用Tetras多通道多肽合成仪合成短肽并用高效液相色谱法(HPLC)进行蛋白质纯度检测;免疫新西兰雄性大白兔,制备相应的多克隆抗体。通过间接酶联免疫吸附法(ELISA)检测多克隆抗体效价,通过构建OsDUF6的原核表达载体检测多克隆抗体的特异性,最后利用转基因植株进一步检测抗体。[结果]利用高效液相色谱法(HPLC)检測3条合成的短肽(蛋白纯度>85%)用于免疫新西兰雄性大白兔,得到效价为1:512000的3种多克隆抗体。构建原核表达载体pGEX6p-1-DUF6,在大肠杆菌中诱导表达重组蛋白GST-OsDUF6,并用GST单克隆抗体成功检测到重组蛋白。在此基础上,对制备的抗体进行特异性檢测,结果发现Anti-DUF6-1多克隆抗体结合重组蛋白GST-DUF6的特异性最高。选取该抗体作进一步验证,以非转基因植株作为对照,通过提取DUF6过表达水稻植物总蛋白进行抗体检测,结果表明,Anti-DUF6-1能识别OsDUF6蛋白特异条带,并且在过表达植株中显示较高的蛋白丰度。[结论]制备的Anti-DUF6-1多克隆抗体能特异性识别水稻未知功能域蛋白OsDUF6,可用于该蛋白的进一步功能研究。
关键词:OsDUF6;多克隆抗体;原核表达;转基因水稻
中图分类号:S511文献标志码:A 文章编号:1008-0384(2020)02-0117-07
0 引言
(研究意义)近年来,未知功能结构域蛋白家族(Domains of ullknown function protein families,DUFs)是科研工作者的研究热点,它是一大群未知功能和没有注释的蛋白家族,其蛋白数量占整个蛋白家族的25%左右。此外,它还和一些有命名但是还没有注释功能的蛋白家族,统称为DUFs.21世纪以来,越来越多的报道发现,DUFs在植物整个生命历程中发挥着重要作用,因此研究该类基因的生物学功能具有重要意义。随着分子生物学的不断发展,蛋白水平上的研究已经备受关注,研究基因的功能不再局限于转录水平。抗体制备是在蛋白水平上研究基因功能的重要环节,制备高效价的抗体是研究基因功能的前提。(前人研究进展)DUFs普遍存在于生物中,其中在真核生物中约占20%。近年来,已有研究表明,DUFs广泛存在于植物中,如DUF640、DUF579等。研究发现,DUFs参与植物体内一些重要的生物学过程,发挥一系列的生理功能。DUFs可以参与调控植物生长发育,其中水稻DUF266家族的糖基转移酶基因BC10与糖基转移酶标记基因GTs,共同参与植物细胞壁形成发育的生理机制。DUFs也调控植物对病害的防御反应,例如Kim等对稻瘟病菌(Magnaporthe grisea)进行蛋白质组差异分析发现,5个DUF26稻瘟病响应蛋白参与水稻对稻瘟病的防御反应;李娟等通过构建水稻DUF500家族基因OsDUF500的沉默株系,发现其与野生型相比表现出较高的水稻白叶枯病抗性,说明该基因可能对水稻白叶枯病抗性起负调控作用。DUFs还参与调控植物对非生物胁迫的响应,已报道水稻DUF966家族基因OsDSR2和OsDSR4基因参与水稻对干旱和盐胁迫的响应。因此,DUFs家族在植物生长发育各个阶段中充当多种角色,研究DUFs基因功能有助于了解植物体内复杂的分子机制。伴随着分子生物学的理论不断发展以及相关生物技术的日趋成熟,研究基因在蛋白水平上的功能,通常利用纯化重组蛋白制备多克隆抗体。该技术不仅在动物中广泛应用而且在植物研究中也成为一种重要手段。例如,为研究水稻PDK2基因在能量代谢的生物学功能及其作用机制,谭才邓等通过构建PDK2的原核表达载体并在大肠杆菌中高效表达获得重组蛋白,进一步纯化免疫家兔制备得到PDK2多克隆抗体,为研究PDK2的表达模式及其互作蛋白奠定基础;有研究表明CSN5可以调控植物的生长发育,但是目前对其功能的研究较少,因此何龙等在克隆该基因的基础上,利用原核表达系统诱导该蛋白并纯化,制备该蛋白的特异性抗体,有利于该基因的深入分析研究。抗体已经广泛应用于生物研究中,如进行内源蛋白的表达分析、蛋白的体外互作验证等,抗体制备也成为研究基因必不可少的环节。(本研究切入点)水稻为重要的模式植物,但是有关其DUFs家族基因的报道中仅有少数基因被揭示了生物学功能,而大部分家族基因尚未进行功能研究。水稻DUFs家族基因OsDUF6目前尚未有报道研究其生物学功能。(拟解决的关键问题)本研究通过对OsDUF6生物信息学分析,从中选取3段不同的氨基酸序列,合成短肽后免疫新西兰大白兔制备相应的多克隆抗体,并构建OsDU6的原核表达载体来检测多克隆抗体的特异性,旨在研究OsDUF6在水稻生长发育过程中的生理生化功能,并在蛋白水平上研究OsDUF6基因功能,为揭示其作用机理奠定基础。
1 材料与方法
1.1 试验材料
1.1.1材料
pGEX6p=1原核表达载体由福建省农业科学院水稻国家工程实验室保存,大肠杆菌Transl-Tl购自北京全式金公司,大肠杆菌Rosetta购自北京博迈德生物技术有限公司。转基因植株由福建省农业科学院水稻国家工程实验室提供。所用的动物材料为雄性新西兰大白兔、籼稻品种75-1-127、转基因过表达水稻植株。
1.1.2试剂与设备 试剂:十二烷基磺酸钠(Sodiumdodecyl sulonate,SDS)、异丙基-β-D-硫代吡喃半乳糖苷(Isopropyl-β-D-thiogalactoside,IPTG)、氨苄青霉素、考马斯亮蓝R-250、低分子量蛋白预染Maker购自赛默飞世尔科技有限公司;辣根过氧化物酶(HRP)偶联的羊抗兔IgG、GST单克隆抗体、DNA扩增的高保真酶Primer Star购自TAKARA公司。DNA回收试剂盒以及质粒小提试剂盒购自北京天根生物技术有限公司。PCR引物由白鲸生物有限公司合成。测序由福州铂尚生物技术有限公司进行。
仪器设备:台式冷冻离心机、PCR仪、电泳仪与电泳槽、转膜仪、Amersham Imager 600凝胶成像系统、Tetras多通道多肽合成仪。
1.2 试验方法
1.2.1抗原表位分析及短肽合成 应用DNAStarProtean软件提供的抗原指数分析模块Jameson-Wolf的方法对OsDUF6蛋白的抗原表位进行预测分析,采用DNAStar Protean软件Kyke-Doolittle的方法对OsDUF6蛋白的亲水性进行预测分析。综合分析OsDUF6蛋白抗原表位及亲水性的预测结果,从中选取3段不同区域的氨基酸序列,用Tetras多通道多肽合成仪合成氨基酸序列,并用高效液相色谱法(HPLC)对3条短肽进行蛋白质纯度的检测。
1.2.2多克隆抗体制备及抗体效价检测 采购的新西兰大白兔先静养36d,免疫前静脉取血3mL,室温静止2-3h,4℃放置3-4h,6000r·min-1离心15min,离心后取上清,作为阴性对照。取2mL的蛋白(0.5mg·mL-1)与等量的弗式不完全佐剂充分乳化后免疫新西兰大白兔,以后每隔l周进行免疫,免疫3-4次。最后1次免疫前少量采血,通过间接酶联免疫吸附法(ELISA)进行血清效价检测,检测达到预期后采取新西兰大白兔的全部血液,取血清分装,保存备用。
1.2.3原核表达载体pGEX6p-1-DUF6检测抗体的特异性
(1)原核表达载体pGEX6p-1-DUF6的构建
以OsDUF6-6P-1-F(5'-CCCCTGGGATCCCCG旦AATTCATGGCCGCCTCCGGCTCCGCC-3.,酶切位点EcoR I)、OsDUF6-6P-1-R(5-GTCACGATGCGGCCGCTCGAGTCATTTTGCCTTCCTTGGCC-3.,酶切位点Xho I)为引物,以水稻品种75-1-127的cDNA作为模板,PCR扩增并纯化回收得到目的基因片段,用EcoRI和Xho I酶切目的片段和pGEX6p-1载体,同源重组到原核表达载体pGEX6p-1中,同时转化大肠杆菌Transl-T1.挑取单菌落,测序正确后,提取质粒并转化大肠杆菌Rosetta进行蛋白表达。
(2)OsDUF6蛋白的原核表达、纯化
挑一个单克隆接种于3mL LB(含Amp+)培养基中活化摇菌至OD600mm=0.6,然后以1:100的比例将活化的培养物转入新的含Amp+的液体LB培养基中以扩繁菌体,待菌液OD600mm=0.6-0.8时,加入IPTG后继续诱导,对照组不加IPTG作为阴性对照。诱导结束后,离心收集菌体细胞并超声破碎,取50uL蛋白样品与等体积2×SDS上样缓冲液混匀,100℃煮沸10min,冷却后上样进行10%SDS-PAGE电泳并利用考马斯亮蓝染色液染色进行观察。
扩大体积,用上述的方法诱导重组蛋白,超声破碎后收集上清。将Glutathione SepharoseTM 4B加入到结合柱中,加入PBS缓冲液漂洗树脂3次;将诱导破碎后的上清加入到结合柱中。4℃,70r·min-1摇动结合23h,用预冷的PBS缓冲液漂洗树脂3次,洗脱非特异结合的杂蛋白,然后用还原性谷胱甘肽缓冲液洗脱目的蛋白。取50uL洗脱后的蛋白样品与等体积2×SDS上样缓冲液混匀,100℃煮沸10min,冷卻后上样进行10%SDS-PAGE电泳,并利用考马斯亮蓝染色液染色进行观察。
各取50uL诱导破碎后和纯化后的蛋白样品与等体积2×SDS上样缓冲液混匀,100℃煮沸10min,冷却后上样进行10%SDS-PAGE电泳。电泳结束后,将蛋白电转移到PVDF膜上。PVDF膜在封闭液(5%脱脂奶粉的PBS缓冲液)中室温封闭2h.加入以封闭液稀释的抗体(GST抗体稀释度为1:5000,自制多克隆抗体稀释度为1:500),室温孵育1h,再用PBST洗涤3次,每次5min.然后用PBS稀释(稀释度1:10000)过的HPR羊抗兔二抗,室温孵育1h,PBST洗涤3次,每次5min.用ELC试剂进行化学显色并在Amersham Imager 600凝胶成像系统中拍照检测。
1.2.4植物总蛋白的提取及Western blotting检測将0.6g样品(根)置于预冷的研钵中,用液氮研磨成粉末,加入1.5mL蛋白抽提液磨成匀浆,4℃,12000g离心20min,取上清转移到1.5mL离心管中,放液氮中速冻随后放-20℃,10min,取出放冰上至溶液融化开。4℃,12000g离心20min,取上清转移到1.5mL离心管中-80℃冷冻保存。取50uL蛋白样品与等体积2XSDS上样缓冲液混匀,100℃煮沸10min,冷却后上样进行10%SDS-PAGE电泳。电泳结束后,将蛋白电转移到PVDF膜上进行Westemblotting分析,具体步骤参考上述方法。
2 结果与分析
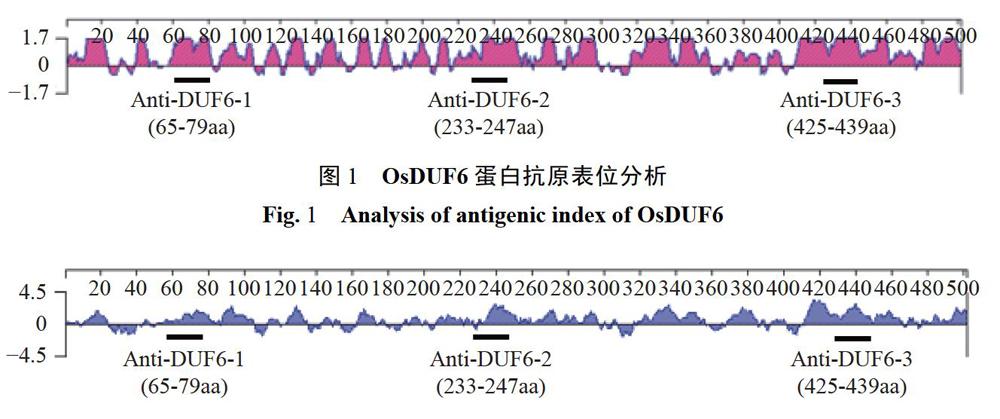
2.1 OsDUF6抗原表位分析及合成短肽
利用DNAStar软件对该蛋白序列进行蛋白抗原表位以及亲水性预测。通过DNAStar Protean软件的Jameson-Wolf方法对OsDUF6蛋白的抗原表位进行预测。结果显示,OsDUF6蛋白存在多个潜在的抗原表位,可能的蛋白质抗原表位区域(图1):1-24aa、39-48aa、58-106aa、112-135aa、140-157aa、164-184aa、193-204aa、218-299aa、313-302aa、373-389aa、409--500aa.根据Kyke-Doolittle的方法对OsDUF6蛋白的亲水性进行预测,发现OsDUF6蛋白具有较高的亲水性,如:11-25aa、55-109aa、124-135aa、200-256aa、263-299aa、319-361aa、371-388aa、413-500aa(图2)。综合分析OsDUF6蛋白抗原表位及亲水性的预测结果,从中选取3段不同区域的氨基酸序列:65-79aa(Anti-DUF6-1)、233-247aa(Anti-DUF6-2)、425-439aa(Anti-DUF6-3)分别作为抗原进行抗体制备。利用Tetras多通道多肽合成仪合成氨基酸序列,然后用高效液相色谱(HPLC)对3条短肽进行蛋白质纯度的检测。结果发现,Anti-DUF6-1、Anti-DUF6-2、Anti-DUF6-3的蛋白纯度分别为85.493%、88.281%、87.152%,3条短肽的蛋白质纯度都在85%以上,可以用来免疫新西兰大白兔。
2.2 多克隆抗体制备及抗体效价检测
用蛋白质纯度在85%以上的3条短肽分别免疫新西兰雄性大白兔,获得3份多克隆抗体血清。采用间接酶联免疫吸附法(ELISA)对制备的多克隆抗体进行血清效价检测。结果表明,稀释度为1:512000时,3份制备的抗体血清仍高于免疫前血清的2,1倍以上(表1)。
2.3 原核表达载体pGEX6p-1-DUF6的构建、诱导和纯化
以籼稻品种75-1-127的cDNA为模板,设计正反向引物OsDUF6-6P-1-F、OsDUF6-6P-1-R,进行PCR扩增OsDUF6编码区的1449bp序列(图3A),将目的片段导人原核表达载体pGEX6p-1中获得重组质粒,并将重组质粒转化到大肠杆菌Rosetta中。
挑取阳性克隆于含Amp+的LB液体培养基中扩繁菌体,经IPTG诱导表达后进行10%SDS-PAGE电泳和考马斯亮蓝染色检测(图3B)。结果表明,在加入IPTG的重组质粒的宿主菌样品中存在1条高丰度的蛋白质条带,相对分子质量约80kD,与预期大小一致(原核表达载体pGEX6p-1中GST标签的大小约26kD,而OsDUF6相对分子质量约57kD,两者融合蛋白的总分子量大小与SDS-PAGE结果基本一致)。而诱导的蛋白主要在上清表达,说明OsDUF6蛋白具有较强的可溶性。
大量诱导重组蛋白,超声破碎后收集上清。经亲和层析柱纯化后得到的重组蛋白进行SDS-PAGE检测。结果发现,有一条单一且大小与预期相符的条带(图3C),说明获得纯化的OsDUF6蛋白。
为了进一步验证所诱导重组蛋白的准确性,用GST标签抗体进行Western blotting检测,发现GST抗体能特异性的识别pGEX6p-1-OsDUF6载体所表达的蛋白(图4A),该结果表明成功诱导出GST-OsDUF6重组蛋白。
2.4 GST-OsDUF6重组蛋白验证抗体特异性
为了初步验证多克隆抗体是否制备成功,以GST-OsDUF6作为对照,验证抗体结合GST-OsDUF6的特异性。取适量体积诱导的蛋白进行SDS-PAGE电泳后转膜,一抗按照1-500稀释比例进行Westernblotting分析。结果显示以上所制备的3个抗体均能与重组蛋白GST-OsDUF6结合(图4-B、C、D),其中Anti-DUF6-1结合特异性最高,而Anti-DUf6-2及Anti-DUF6-3结合非特异蛋白能力较强。因此针对Anti-DUF6-1多克隆抗体进行下一步验证。
2.5 转基因水稻植株验证抗体特异性
为了进一步验证,提取阳性OsDUF6的过表达转基因植株以及非转基因植株的总蛋白,并利用制备的抗体进行Western blotting分析。结果显示,在非转基因植株和过表达植株中都能检测到与OsDUF6蛋白大小一致的目的条带,并且过表达植株中目的蛋白丰度明显高于非转基因植株,符合转基因水稻植株过表达特性(图5),说明Anti-DUF6-1多克隆抗体能够特异性识别水稻内源的OsDUF6蛋白。根据上述结果综合分析,通过人工合成短肽成功制备出水稻未知功能结构域蛋白OsDUF6的特异性抗体,可正常运用于后续OsDUF6的蛋白功能研究。
3 讨论与结论
DUFs家族基因具有的生物学功能是各不相同的。近年来的研究发现,植物中有相当数量并且特有的DUFs能够参与植物中的一些生理生化反应,如调控植物生长发育、非生物胁迫反应以及病虫害的防御反应。
本研究通过对OsDUF6基因的生物信息学分析,从中选取了3段不同的氨基酸区域作为抗原进行抗体制备,并利用Tetras多通道多肽合成仪进行人工合成氨基酸序列。通过高效液相色谱法(HPLC)对3条短肽的蛋白纯度进行自检并免疫新西兰雄性大白兔,进而得到效价为1:512000的3种抗体。目前抗体制备中普遍采用原核表达系统获取目的蛋白的方法。虽然操作性强、成本低,但有一定的局限性,首先在进行重组蛋白的诱导时,需对蛋白诱导的条件(如温度、转速、诱导剂浓度等)进行探索,耗费大量的时间,不利于进行下一步研究;其次,表达可溶性蛋白的效率较低,尤其对于分子量偏大的蛋白,如基因片段大于3kb的蜘蛛丝蛋白表达效率受限;此外,宿主菌(大肠杆菌)自身含有有毒蛋白,可能存在产物中影响重组蛋白的纯度等。本研究利用仪器人工合成多肽进行抗体制备,该方法方便快捷,合成的蛋白纯度高、抗体的特异性好,时间短,并且随着分子生物学技术的发展,人工合成多肽的技术已经日益成熟,因此该方法逐渐被科研工作者所推广。
在验证抗体特异性上,本研究利用原核诱导表达系统首先对制备的抗体进行初步验证,结果发现Anti-DUF6-1多克隆抗体能特异性结合重组蛋白GST-DUF6并且非特异结合少。但Anti-DUF6-1结合诱导重组蛋白不能直接说明抗体的实用性,需具有植物内源蛋白特异性结合能力才能最终运用于后续研究中。以经鉴定成功的转基因过表达水稻植株作为衡量抗体实用性的标准,在验证结果中表明Anti-DUF6-1能特异性识别植物内源OsDUF6蛋白,且过表达水稻植株OsDUF6蛋白含量明顯高于非转基因植株。由此推断该制备的抗体可以用于水稻OsDUF6蛋白的功能分析。
总体来说,本研究成功制备出未知功能域蛋白OsDUF6的抗体,能特异性识别水稻内源OsDUF6蛋白,对下一步用转基因植物进行功能分析具有重要意义。后续可对OsDUF6转基因水稻进行表型鉴定,研究转基因水稻在人工处理前后蛋白水平的变化,进而研究OsDUF6在水稻中的生物学功能;OsDUF6抗体还能运用于研究该基因在水稻中的表达模式,分析该基因在水稻根、茎、叶及其他器官的表达水平。因此,OsDUF6多克隆抗体的制备,有利于进一步研究OsDUF6在水稻中的生物学功能。

