文心兰NPRl基因的克隆与诱导抗性过程中的表达分析
郑世仲 王培育 张春柳 江胜滔 江金兰 颜沛沛 叶炜 赖钟雄

摘要:[目的]探明文心兰NPRl基因在诱导抗性过程中的生理作用。[方法]利用RACE技术克隆文心兰NPRl基因全长,并进行相关生物信息学分析和遗传进化树的构建;以印度梨形孢共培养、水杨酸(SA)和茉莉酸甲酯(MeJA)处理文心兰,分析菊欧文氏杆菌导致的软腐病抗性影响及NPRl基因的表达特性变化。[结果]克隆得到的2条基因序列长度分别为l 804bp和l 902bp,编码555、556个氨基酸,均为NPRl类型,分别命名为OgNPRl-1和OgNPRl-2;文心蘭两个NPRl基因在未接菌的情况下均呈现低表达量,在接种共生菌印度梨形孢后轻微上调表达,在接种菊欧文氏杆菌后显著上调表达,而在印度梨形孢共生菌的存在下,接种菊欧文氏杆菌使两个NPRl基因表达更为活跃;同时,相比印度梨形孢共生菌处理,两个NPRl基因均在外源SA、MeJA处理下接种菊欧文氏杆菌表现为更显著上调表达;此外,共生印度梨形孢可显著提高文心兰对菊欧文氏杆菌导致软腐病的抗性,限制软腐病病症在非接病叶片的扩展。[结论]在共生印度梨形孢的文心兰植株中,印度梨形孢显著提高了文心兰NPRl基因响应菊欧文氏杆菌的表达水平,虽然上调水平不及SA和MeJA激素处理的水平,却使文心兰植株表现出更强的对抗软腐病的能力。
关键词:文心兰;NPRl;诱导性抗性;印度梨形孢;菊欧文氏杆菌
中图分类号:S 682.31文献标志码:A 文章编号:1008-0384(2020)02-0140-10
0 引言
(研究意义)在植物中,系统性抗病机理存在两种产生类型,一种是由致病菌及其特征物诱导的系统获得性抗性(Systemic acquiredresistance,SAR),另一种为系统诱导性抗性(Induced systemic resistance,ISR),主要由非致病性根际微生物所诱导。早期认为,ISR的产生可能依赖于谷胱甘肽一抗坏血酸循环的抗氧化能力的激活,茉莉酸(Jasmonic acid,JA)途径相关基因的表达可能在ISR产生中起重要作用,并且在ISR形成过程中,防御基因(Defensegene)及水杨酸(Salicylic acid,SA)信号途径相关基因被大量抑制。近年来,相关研究已经表明ISR形成及作用过程可能存在更为复杂的机制,SA信号途径相关基因在ISR病原菌入侵初期大量表达,并在其后的系统性抗性诱导中扮演重要角色。(前人研究进展)非表达病程相关蛋白(Non-expresserofpathogenesis related genes l,NPRl)充当植物防御信号的主要调节因子,广泛参与植物的防御反应。NPRl是一种SAR的正调控因子,植物倾向于连续地诱导NPRl及SA信号途径相关基因的表达进而启动防御基因表达,当诱导SAR后,NPRl易位至细胞核,接着与基本结构域/Leu拉链(bZIP)转录因子的TGA/OBF亚类成员相互作用,参与SA依赖性病程蛋白相关基因(Pathogenesis related genes,PR)的激活。NPRl同样在ISR中起重要作用,与SAR相反,虽然ISR不依赖于SA的积累,但JA不能在拟南芥(Arabidosis thaliana)NPRl突变株中诱导ISR,表明JA诱导的ISR的启动同样依赖于NPRl的作用。NPRl参与植株体内SA与JA的平衡,在SA的存在下,NPRl参与抑制包括LOX2、VSP和PDFl.2mRNA水平的积累,是JA信号途径的负调控因子;同时,NPRl又能抑制SA的从头合成,提高JA信号途径防御基因的表达。
文心兰是我国特别是台湾地区最主要的出口切花品种,极易受到软腐病侵害,其病原物主要为欧文氏杆菌(Erwinia carotovora subsp.carotovora)与菊欧文氏杆菌(e.chrysanthemi,Pectobacteriumchrysanthemisyn,Dickya dadantii syn.nov.)。菊欧文氏杆菌寄主范围广泛,还未见具有其抗性的兰花种质被报道。印度梨形孢(Piriformospora indica)可为多种物种带来系统性抗性,提高植株对抗病害的能力。在此前的试验中发现印度梨形孢可以提高文心兰系统性对抗软腐病的能力,并且植株体内SA、JA水平也在接种印度梨形孢后显著提高,利用此前完成的转录组(PRJNA428913)分析发现文心兰根部有两个注释为NPRl的基因片段。(本研究切人点)目前,兰科植物中仅见关于蝴蝶兰(Phalaenopsisaphrodite subsp.formosana)NPRl基因克隆分析的相关报道,而不同物种NPRl基因的功能存在差异。(拟解决的关键问题)为了解文心兰NPRl基因在ISR过程中的生理作用,本试验通过克隆文心兰NPRl基因全长,分析其所属类型及在印度梨形孢诱导的ISR过程中的表达情况,以期为揭示文心兰抗软腐病分子机理及抗性育种提供参考。
1材料与方法
1.1 试验材料
文心兰南茜组培苗、菊欧文氏杆菌由三明市农业科学研究院建立并保存,其培养及继代参照江金兰等的方法及杨学等的方法。印度梨形孢由台北大学叶开温馈赠并保存于三明市农业科学研究院,其培养及接种文心兰植株参照叶炜等的方法。利用Trizol法(Invitrogen)抽提文心兰RNA并于-80℃保存备用,RLM-RACE试剂盒获得cDNA全长于-20℃保存备用。PrimeScript RT reagent Kit withgDNA Eraser(Perfect Real Time)(Takara,RR047A)获得cDNA用于实时定量PCR(Real-time QuantitativePCR,qPCR)。
1.2NPRl基因全长克隆及分析
利用pfam(pfam.xfam.org)下载NPRl/NIMl liksdefenceprotein C terminal种子文件(PFl2313),于转录组数据(PRJNA428913)进行隐马克夫模型(Hidden Markov models,HMMs)搜索,并利用所得到片段进行RACE扩增全长,设计开放阅读框(Open reading frame,ORF)的引物进行全长验证,所用引物见表1.RACE及ORF扩增使用2×TaqPCRMastermix(天根,KT201),参照说明书及引物温度进行PCR反应,阳性条带回收TA克隆后转化大肠杆菌,送博尚基因测序。利用DNAMAN 6.0进行蛋白序列预测,NCBI BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行核酸及蛋白序列比对。利用NCBICD-search(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)进行保守结构域分析。利用SignalP(http://www.cbs.dtu.dk/services/SignalP/)进行信号肽分析。利用PSORT(https://psort.hgc.jp/)进行亚细胞定位预测。
1.3NPRl进化树分析
所获得OgNPRl-1、OgNPRl-2蛋白序列与拟南芥及其他物种NPRl及近似蛋白序列构建Neghbo~Joining进化树,构建进化树软件为MEGA10.1,设置bootstrap=1000.拟南芥AtNPRl(A了1G64280)、AtNPR2(AT4G26120)AtNPR3(AT5G45110)AtNPR4(AT4G19660)、AtBOPl(AT3G57130)、AtBOP2(AT2G41370)下載自TAIR,其他物种NPRl及其近似序列包括葡萄(Vitis vinifera)VvNPRl.2(XP002274045入甜菜(Jetavulgaris)BvNIMl(AAT57640人大豆(Glycine max)GmNPRl-1(NP 001238658)、GmNPRl-2(NP 001238674)、烟草(Nicofianatabacum)NtNPRl(ABH04326)、可可(Rheobromacacao)TcNPRl(ADl24348)、白毛果杨(Populustrichocarpa)PtNPRl(XP 002308281)、PtNPR2(XP 002322351)、PtNPR4(XP 002307566)、PtBOPl(XP 002323261)、PtBOP2(XP 002308905)、籼稻(Oryzae sativa Indica Group)OsNPRl/NHl(AAXl8700)、粳稻(OryzasativaeJaponicaGroup)OsNPRl(AAP92751)、OsBOP2(ABEl 1621)、小果野蕉(Musa acuminata AAA Group)MaNPRl-B(ABl93182)、MaNPRl-A(ABL63913)、高粱(Sorghumbicolor)SbNPRl(XP 002455011)、SbNPR2(XP0024641lo)、SbNPR3(XP 002456404)、SbBOPl(XP002442682)、SbBOP2(XP 002450246)、湖北海棠(Malus hupehensis)MhNPRl(ADP95762)下载自NCBI GenBank.
1.4NPRl基因表达分析
利用与印度梨形孢共培养10d后的文心兰组培苗(P),取每个植株第二片叶进行菊欧文氏杆菌接种试验,以接种水的文心兰为对照(CK),接菌24h后,收集接种部位叶片(PEL)和邻近接种叶片(PED),对照文心兰也收集相应的部位叶片(EL)和邻近接种叶片(ED)提取RNa.为了解NPRl在SA和JA信号下表达情况,利用1.0mmol·L-1SA溶液,0.1mmol·L-1茉莉酸甲酯(Methyl jasmonate,MeJA)溶液喷洒文心兰叶片,24h后收集提取RNa.利用PrimeScript RT reagent Kit with gDNA Eraser(PerfectRealTime)试剂盒(Takara,RR047A)合成cDNa.以Act&为内参进行ABI QuantStudio 3荧光定量PCR仪进行定量分析。利用Premix Ex Taq Ⅱ试剂(TAKARA,RR820A)参照说明书及引物温度进行扩增反应。每个试验以5株为一个处理,试验3个独立重复,利用DPS7.05进行邓肯氏新复极差检验分析。
2 结果与分析
2.1 文心兰NPRl基因的克隆与生物信息学分析
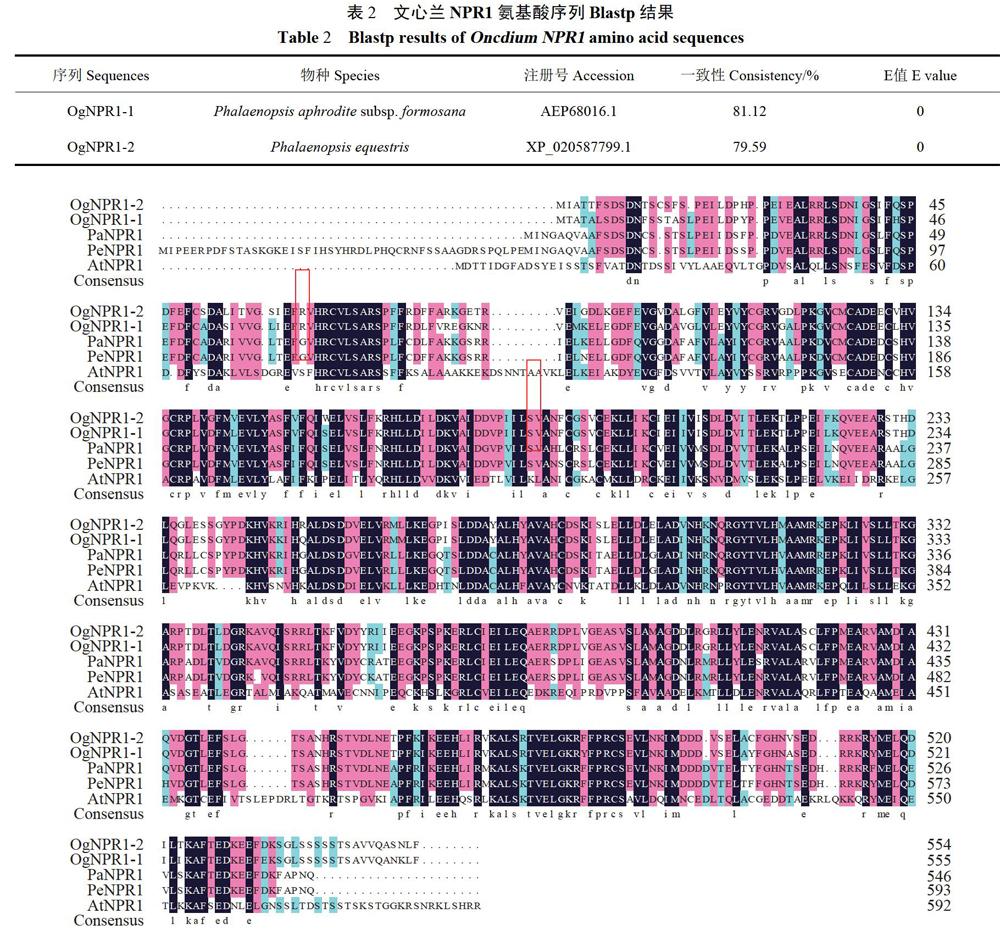
利用HMMER从转录组数据库获得l条编号为Pl comig 4467序列,序列长度为1238bp.NCBIBlast比对显示该蛋白序列与蝴蝶兰NPRl蛋白序列(AEP68016.1、XP 020587799.1)有83.53%、83.28%的一致性,具有NPRl likeC(pfaml2313)结构域,表明该序列为NPRl基因。根据Pl contig 4467序列设计RACE引物(表1),经序列拼接,分别获得两条长度为1804、1902bp核酸序列,ORF分别为1668、1665bp,编码556、555个氨基酸,与ORF引物扩增验证一致。SignalP分析显示,两条序列均不含有信号肽。PSORT亚细胞定位预测为OgNPRl-1:质膜60%,高尔基体40%,线粒体内膜34.6%,内质网膜30%;OgNPRl-2:质膜65%,线粒体内膜34.6%,内质网膜20%,叶绿体片层膜17.3%。
通过NCBI保守结构域分析两条推断蛋白序列表明,2条推断蛋白序列均含有BTB POZ NPRplant(pfam00651)、DUF3420(pfaml 1900)、Ank 2(pfam12796)、NPRl like C结构域。NBCIBlast结果显示2条推断蛋白序列与来自蝴蝶兰的NPRl蛋白序列有较高一致性(表2)。利用DNAMAN 6.0将其与蝴蝶兰、拟南芥的NPRl蛋白序列进行多重序列比对,呈现较高的保守性,并且与拟南芥NPRl蛋白序列Cvs82和Cys216位点一致(图1)。2条序列分别命名为NPRl isoform Xl(OgNPRl-1)、NPRl isoform Xl(OgNPRl-2),序列登录号分别为MN402677、MN402678.
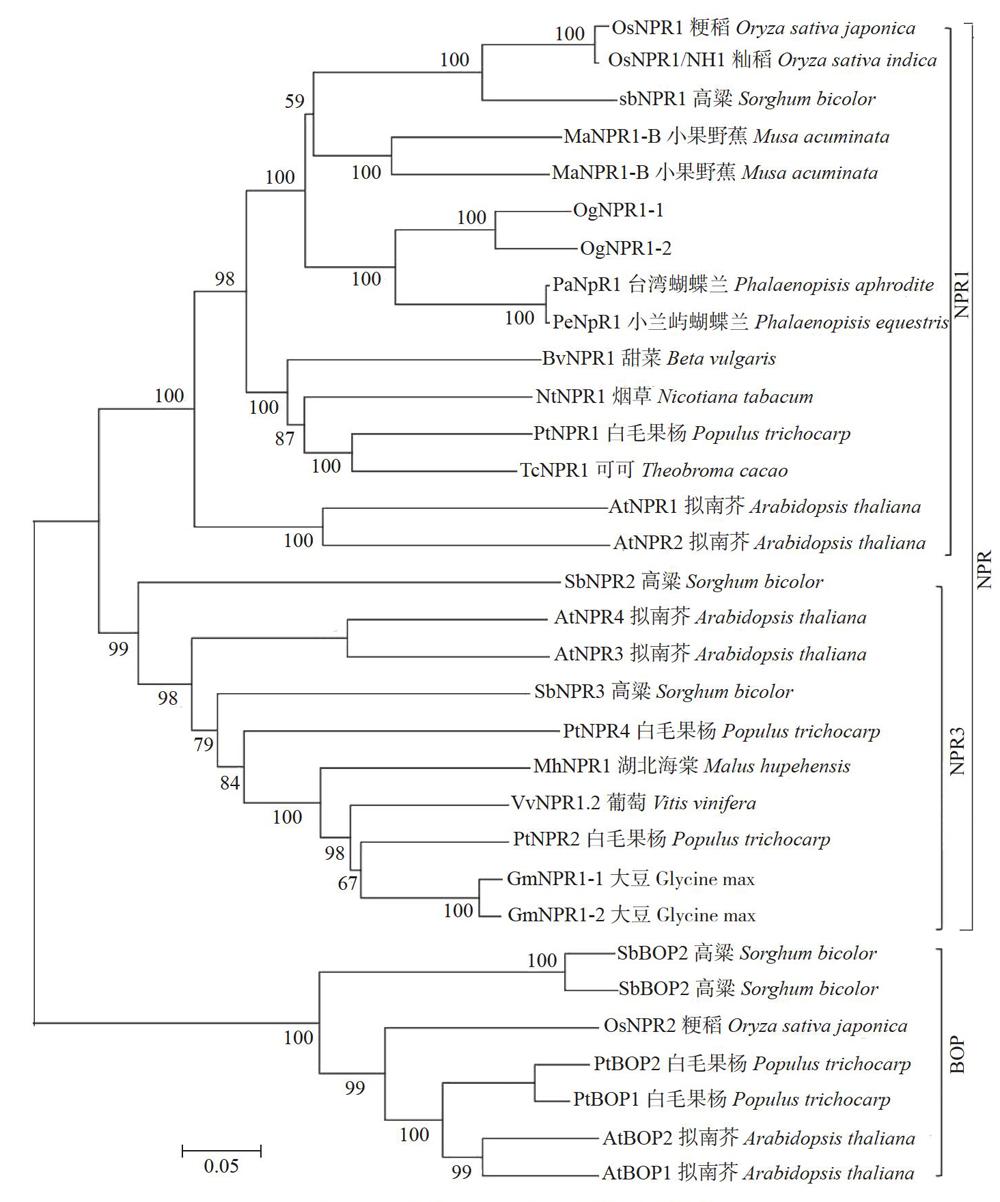
2.2 文心兰NPRl进化树分析
由于NPRl及近似基因具有不同的生理功能,利用其他物种已知的NPRl、近似蛋白序列与OgNPRl-l、OgNPRl-2构建进化树,结果表明进化树分析与BLAST结果一致(图2)。文心兰2个NPRl蛋白与蝴蝶兰、小果野蕉、水稻最为接近,与拟南芥NPRl、NPR2一起被聚类在NPRl类型。NPR3类群与BOP类群序列与预期一致,再次表明所分离的文心兰OgNPRl基因为NPRl类型。

