HT22细胞系铁死亡敏感性研究
杨田丽 杨勇飞 袁增强
(1.首都医科大学脑重大疾病研究中心,北京 100069; 2.北京脑重大疾病研究院,北京 100069; 3. 北京理工大学生命学院,北京 100081; 4.军事医学研究院军事认知与脑科学研究所,北京 100850)
铁死亡是一种Fe2+依赖的氧化性非凋亡性程序性死亡[1],首次发现于RAS(small G-protein)突变的癌细胞中[2-3],其后在神经元、肾小管细胞、T细胞、成纤维细胞中均观察到铁死亡现象[4-7]。
细胞内脂质活性氧(reactive oxygen species,ROS)由稳定的含Fe2+酶催化生成[1],由抗氧化系统清除,从而在生理状态下保持稳态[8]。铁死亡诱导剂Erastin抑制细胞膜上的谷氨酸/胱氨酸转运体,进入细胞的胱氨酸减少,胞内还原型谷胱甘肽合成减少[1],谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)的功能降低[6],脂质ROS清除减少,细胞内脂质ROS蓄积,诱导铁死亡,铁死亡诱导剂RSL3直接抑制GPX4,胞内脂质ROS水平增加,导致铁死亡[9]。细胞发生铁死亡时,关键因子SLC7A11或PTGS2 mRNA表达增加,可作为铁死亡的标志物[1,3]。铁离子螯合剂如去铁胺(deferoxamine)或抗氧化剂(ferrostatin-1,Fer-1)可以抑制铁死亡的发生[1]。
HT22是小鼠海马神经元细胞系[10-12],广泛应用于多种神经系统疾病的研究。本研究选用Erastin或RSL3处理HT22细胞系,探究HT22细胞系是否对这两种铁死亡诱导剂敏感,为使用HT22细胞系研究神经退行性疾病等中枢神经系统疾病发生、发展过程中神经元铁死亡的作用和机制提供理论依据。
1 材料与方法
1.1 试剂
Erastin、RSL3、Ferrostatin-1购自美国Selleckchem公司,DMSO购自美国Sigma公司;DMEM培养基购自美国Gibco公司,胎牛血清购自浙江杭州四季青生物工程材料有限公司;链霉素-盘尼西林试剂购自上海碧云天公司;CCK-8试剂盒和RNA反转录试剂盒购自北京全式金公司;Tris粉末、NaCl粉末、EDTA粉末、Triton X-100、浓盐酸、硫脲、三氯甲烷、异丙醇、无水乙醇购自国药集团;三氯乙酸(trichloroacetic acid,TCA)、硫代巴比士酸(thiobarbituric acid,TBA)、菲罗嗪购自美国Sigma公司;Trizol购自美国Ambion公司,RT-qPCR试剂盒购自北京康为公司。
1.2 Erastin或RSL3处理细胞
将铁死亡诱导剂Erastin或RSL3粉末溶于DMSO,分别配置成10 mmol/L、2 mmol/L的储备液,使用时终浓度为10 μmol/L、2 μmol/L,以DMSO作为溶质对照。Ferrostatin-1配置成2 mmol/L的储备液,使用时终浓度为2 μmol/L。将细胞分为3组,分别使用DMSO、Erastin或RSL3、Erastin+Ferrostatin-1或RSL3+Ferrostatin-1处理细胞,药物处理6 h后检测细胞内的脂质过氧化和Fe2+浓度及相关基因mRNA表达,24 h后显微镜下观察细胞形态并检测细胞活力。
1.3 CCK-8法检测细胞活力
收集处理后细胞离心,用1 mL细胞培养基来重悬细胞,加入100 μL/孔细胞悬液,加入10 μL的CCK-8溶液,于细胞培养箱孵育1~4 h,利用酶标仪于412 nm处检测各孔吸收光。
1.4 丙二醛法检测脂质过氧化水平
收集处理后细胞离心,PBS洗两次,加入300 μL裂解液,4 ℃裂解1 h后,4 ℃、13 000 r/min离心10 min。在200 μL上清中加入600 μL的0.67%(体积分数)TBA溶液[TBA溶于20%(体积分数)TCA溶液中],95 ℃水浴锅孵育60 min。恢复至室温后,4 000g离心10 min,532 nm处检测吸收光,测定脂质过氧化物的含量。
裂解液:20 mmol/L Tris-HCl pH值为7.5; 150 mmol/L NaCl; 2%(体积分数)Triton X-100; 1 mmol/L EDTA。
1.5 菲罗嗪法检测Fe2+浓度
收集处理后细胞离心,PBS洗两次,加入300 μL裂解液,4 ℃裂解1 h后,4 ℃、13 000 r/min离心10 min。转移200 μL上清到96孔板,50 μL/孔。加入50 μL/孔的0.1 mol/L盐酸,混匀,25 ℃孵育30 min。每孔加入100 μL 铁探针,混匀,25 ℃避光孵育60 min。562 nm检测吸光度值,测定Fe2+的含量。
裂解液:20 mmol/L Tris-HCl pH值为7.5; 150 mmol/L NaCl; 2%(体积分数)Triton X-100; 1 mmol/L EDTA;铁探针:525 mg菲罗嗪和15 g硫脲溶于1 L的4 mol/L醋酸钠溶液。
1.6 定量RT-PCR检测基因mRNA表达
加入500 μL/孔 Trizol提取细胞总RNA,微量紫外分光光度计检测RNA的浓度及纯度。用RNA反转录试剂盒按照说明书方法反转录成cDNA,用定量RT-PCR试剂盒按照说明书检测细胞SLC7A11、PTGS2的mRNA表达。所用PCR引物如下:mSLC7A11-realtime-F:5′-GGCACCGTCATCGGATCAG-3;R:5′-CTCCACAGGCAGACCAGAAAA-3。mβ-actin-realtime-F:5′- GGCTGTATTCCCCTCCATCG-3;R:5′-CCAGTTGGTAACAATGCCATGT-3;mPTGS2- realtime-F:5′-TGAGCAACTATTCCAAACCAGC-3;R:5-GCACGTAGTCTTCGATCA-CTATC-3。
1.7 统计学方法

2 结果
2.1 Erastin或RSL3 诱导HT22铁死亡
Erastin或RSL3处理 HT22细胞24 h后,显微镜下观察细胞的存活情况,并检测不同处理后的细胞活力。Erastin或RSL3处理HT22后,显微镜下发现细胞发生明显死亡,加入铁死亡抑制剂Ferrostatin-1后,细胞死亡显著减少(图1A,C)。细胞活力CCK-8法检测结果显示Erastin或RSL3处理组相较于对照组细胞活力降低,加入Ferrostatin-1后得到恢复,组间差异有统计学意义(P<0.05)(图1B,D)。

图1 Erastin或RSL3诱导HT22铁死亡Fig.1 Erastin or RSL3 induces ferroptosis in HT22A: morphology of HT22 treated with Erastin; B: relative cell viability of HT22 treated with Erastin decrease, Fer-1 partly rescue the cell death,***P<0.01; C: morphology of HT22 treated with RSL3;D: relative cell viability of HT22 treated with RSL3 decrease, Fer-1 partly rescue the cell death,***P<0.01.
2.2 Erastin或RSL3处理HT22后胞内脂质过氧化物水平增加
处理HT22细胞6 h后,使用丙二醛法检测细胞内的脂质过氧化物水平,Erastin或RSL3处理HT22后,细胞内的脂质过氧化物水平增加,与对照组比较,差异有统计学意义(P<0.05),详见图2。

图2 Erastin或RSL3处理后脂质过氧化物水平Fig.2 Lipid peroxidation in HT22 after treated by Erastin or RSL3 A: RSL3;B: Erastin;***P<0.001
2.3 Erastin或RSL3处理HT22后胞内Fe2+浓度变化
处理HT22细胞6 h后,使用菲罗嗪法检测胞内Fe2+浓度。细胞内的Fe2+浓度与对照组比较,差异无统计学意义(P>0.05,图3)。

图3 Erastin或RSL3处理后Fe2+浓度Fig.3 Fe2+ concentration in HT22 cells after treated by RSL3 or Erastin A: RSL3;B: Erastin.
2.4 Erastin或RSL3处理HT22后SLC7A11、PTGS2mRNA表达
处理HT22细胞6 h后,使用定量RT-PCR法检测SLC7A11、PTGS2 mRNA表达。细胞SLC7A11、PTGS2mRNA表达增加,与对照组比较,差异有统计学意义(P<0.05)(图4)。
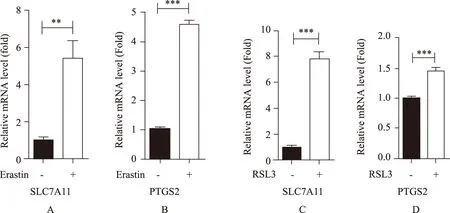
图4 Erastin或RSL3处理后细胞SLC7A11、PTGS2 mRNA表达Fig.4 Expression of SLC7A11, PTGS2 mRNA after treated by Erastin or RSL3A: SLC7A11 mRNA after treated by Erastin; B: PTGS2 mRNA after treated by Erastin; C: SLC7A11 mRNA after treated by RSL3;D: PTGS2 mRNA after treated by RSL3. **P<0.01, ***P<0.001.
3 讨论
铁死亡作为一种新的程序性细胞死亡方式,在生物化学、形态学和遗传学等方面与其他细胞死亡方式(凋亡、坏死、自噬)有明显差别。铁死亡主要表现为线粒体变小,线粒体膜密度增加,线粒体内膜上嵴减少甚至消失,线粒体外膜破裂,细胞核无改变,没有染色体浓缩,细胞膜也没有出泡、破裂,铁离子螯合剂、抗氧化剂等可以抑制铁死亡[1]。
研究[6]显示铁死亡与多种疾病有关,例如肾细胞癌、淋巴瘤等癌症、急性肾衰竭、急性肝损伤等。而且在多种中枢神经系统疾病过程中发现铁死亡现象,如卒中、阿尔兹海默病、帕金森病、亨廷顿病[13],加入铁死亡抑制剂可以改善疾病的症状及预后[14-16]。研究不同神经系统疾病过程中铁死亡的发生及机制可能为疾病治疗提供新思路。
为阐明神经疾病过程中神经元铁死亡的机制,研究需要细胞模型作支持。原代神经元因获得数量少、培养时间长等原因在分子机制研究中应用受限,而神经元细胞系是良好选择。本课题主要使用CCK-8法、丙二醛法、菲罗嗪法和RT-PCR法来检测HT22小鼠海马神经元细胞系是否适合研究铁死亡。铁死亡诱导剂Erastin或RSL3处理HT22后,Fe2+浓度无明显变化;细胞内的脂质过氧化物水平增加;显微镜下观察到明显的细胞死亡,细胞活力减弱,HT22发生铁死亡。以上结果提示Erastin或RSL3主要抑制脂质过氧化物的清除,而不影响脂质过氧化物的生成,导致其在细胞内的蓄积,进而诱导HT22铁死亡。Erastin或RSL3处理HT22后,细胞SLC7A11、PTGS2mRNA水平增加,从分子水平上提示了铁死亡的发生。本研究证明HT22是铁死亡敏感的细胞系,可作为细胞模型来探究相关神经系统疾病中铁死亡的发生机制,为筛选疾病治疗的新靶点提供理论依据。

