E2F-1过表达对结直肠癌细胞预后的影响
徐君毅,以 敏,宋学民
(广西医科大学第四附属医院,广西 柳州 545005)
E2F-1参与构成转录因子复合物,调控多种靶基因参与转录进程,在细胞周期进展中具有重要作用。E2F-1与胃癌、结肠癌等多种消化道肿瘤的发生也存在密切相关性[1-2],稳定的E2F-1过表达可抑制MGC-803胃癌细胞的增殖过程[3]。为研究E2F-1与结直肠癌的关系,我们检测了结肠癌标本中E2F-1的表达情况,并构建E2F-1真核载体,转染结肠癌LoVo细胞株,初步探讨E2F-1过表达对结肠癌细胞的影响。
1 材料与方法
1.1 标本采集
收取广西医科大学第四附属医院胃肠外科原发性结直肠癌手术切除标本,同时收取肿瘤组织和距肿瘤边缘5 cm以上正常组织,分别作为肿瘤组和对照组,每组各35例。肿瘤组标本均需经病理明确诊断,对照组标本病理证实无肿瘤细胞浸润。所有采集标本离体30分钟内投入液氮中速冻10 min,然后送入-70℃冰箱保存。
1.2 主要材料
结肠癌LoVo细胞株(中科院上海细胞所),鼠抗人E2F-1单克隆抗体(美国Santa Cruz公司),免疫组化试剂和Western blot实验试剂(武汉博士德公司),pCMV-HA真核载体(美国Clontech公司),引物由上海生工合成。
1.3 Western blot
取出肿瘤组和对照组组织标本,病理冰冻切片机上切成40~50 μm薄片,组织裂解法抽提组织标本核蛋白,采用Bradford调整各组蛋白浓度一致。经SDS-PAGE凝胶电泳分离,电转至甲醛预处理过的PVDF膜,封闭液密封2 h,加入鼠抗人E2F-1一抗(1:200)4℃孵育过夜,TBST漂洗60 min。加入HRP标记的山羊抗鼠二抗(1:1000),25℃孵育1 h,TBST漂洗60 min。使用DAB显色试剂盒进行显色后,暗室曝光到X线片上,采用Imaging System软件分析各组条带灰度值,依据相对灰度值进行统计学分析。内参蛋白为β-actin,以E2F-1与β-actin比值代表E2F-1表达水平。
1.4 E2F-1真核表达质粒的构建和细胞转染
1.4.1 引物设计与合成。依据GeneBank中E2F-1 DNA序列(登录号:NM_005225.1),Primer Premier 5.0 软件设计引物。第二对引物两端包含EcoRⅠ酶切位点。

上游引物 下游引物 产物长度第一对 5’GGACTTTGCAGGCAGCGGCG3’ 5’CTGGAAACCCTGGTCCCT CCAAGC3’ 1462bp第二对 5’GAATTCATGGCCTTGGCCGGGGC3’ 5’GAATTCTCAGAAATCCAGGGGGGTG 3’ 1326bp
1.4.2 采用二次PCR的方法扩增E2F-1完整序列。第一次PCR以人肝脏细胞E2F-1 mRNA作为模板,扩增产物长度1462 bp。第二次PCR以第一次PCR产物为模板,产物长度为1326 bp。二次PCR后,产物经琼脂糖凝胶电泳鉴定。
1.4.3 真核表达载体的构建。扩增产物经琼脂糖凝胶电泳回收并纯化后,EcoRⅠ内切酶进行酶切,获得E2F-1全序列片段,然后连接至pCMV-HA质粒,筛选阳性表达质粒酶切后电泳鉴定,并送上海生工测序验证。
1.4.4 结肠癌LoVo细胞株的培养和质粒转染。细胞培养条件:37℃,5%CO2的温箱,含10%小牛血清的RPMI-1640培养基。将构建成功的真核表达质粒和脂质体均匀混合,室温静置20 min后加入细胞培养基中进行转染。24 h、48 h后收集细胞,提取总蛋白,Western Blot分析验证,确认能稳定表达E2F-1蛋白。
1.4.5 细胞克隆形成实验:取E2F-1真核表达质粒转染的LoVo细胞和空转的LoVo细胞,制成细胞悬液后按梯度倍数稀释,接种于6孔板,培养14天。固定细胞后,适量GIMSA染色液染色,显微镜下计数大于50个细胞的克隆数,计算克隆形成率。
1.4.6 细胞生长曲线(MTS法):取稳定表达E2F-1基因的LoVo细胞和空载体转染的LoVo细胞,用含10%小牛血清的培养液配成单个细胞悬液,接种到96孔板,每孔体积100ul,持续培养7天。呈色时每孔加MTS溶液20 ul,继续孵育2 h,测定490 nm波长吸收值。所记录结果以培养时间为横坐标,吸光值为纵坐标,绘制细胞生长曲线。
1.5 统计方法
采用SPSS 19.0进行数据分析,Western blot结果行成对样本t检验,P<0.05代表差异有统计学意义;细胞克隆形成实验和细胞生长曲线结果采用独立样本t检验,P<0.05代表差异有统计学意义。
2 结 果
2.1 Western blot结果
采用Imaging System软件分析各组条带灰度值,依据相对灰度值进行统计学分析。以E2F-1与β-actin条带比值代表E2F-1表达水平。肿瘤组与对照组平均表达水平分别为1.043±0.212和0.590±0.177,属于服从正态分布的连续型实验数据,采用配对t检验,差异具有统计学意义(P<0.05)。
2.2 E2F-1稳定过表达对结肠癌LoVo细胞株的影响
2.2.1 细胞克隆形成实验:转染并过表达E2F-1蛋白的结肠癌LoVo细胞形成的克隆数量明显少于转染空载质粒的LoVo细胞,两组间差异具有统计学意义(P<0.05)。(见图1)。
2.2.2 细胞生长曲线(MTS法):活细胞的数量与490nm吸光度成正比,统计结果显示过表达E2F-1的LoVo细胞繁殖速度受到抑制,明显慢于对照组LoVo细胞,两组间差异具有统计学意义(P<0.05)。(见图2)。
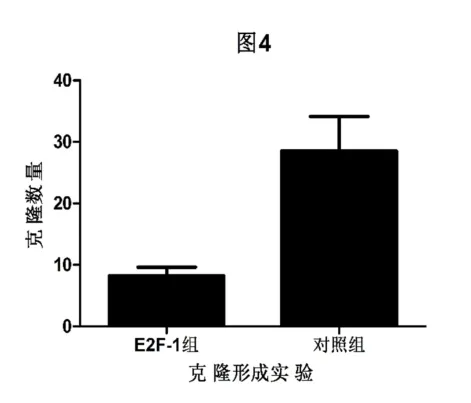
图1 克隆形成实验结果
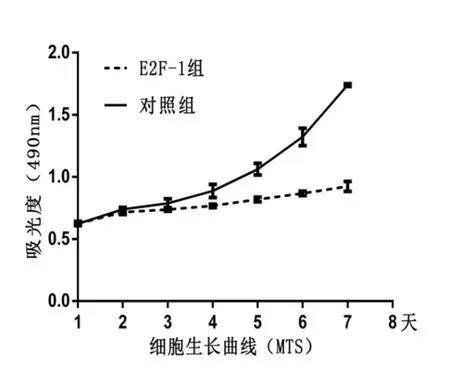
图2 MTS法绘制的细胞生长曲线
3 讨 论
E2F-1是调节细胞周期进展的重要转录因子之一,通过调控下游多种靶基因的表达发挥作用,而其自身的活性变化则受到pRb的直接调节[4]。G1早期,精氨酸甲基化在细胞周期控制过程中负性地调节pRb的抑癌功能,部分是通过为Cdk复合磷酸化创造更好的底物和干扰pRb与E2F-1的相互作用,从而抑制细胞进入S期所需基因的转录。
E2F-1表达失调与多种肿瘤的发生具有相关性[5],包括肺癌[6]、肝癌[7]、乳腺癌[8]、膀胱癌[9]和胰腺癌[10]。E2F-1在胃癌中也同样具有表达异常的现象,并且慢病毒介导的E2F-1调控可抑制MGC-803胃癌细胞的增殖[11]。E2F-1在结肠癌中的也有较多的相关研究。E2F-1通过激活包括染色体DNA复制及其自身启动子在内的多个基因来调节细胞周期的G1/S期转变[12]。活性氧/磷酸肌醇3-激酶/AKT途径激活,E2F-1表达上调,并介导结肠癌细胞增殖[13]。此外,在p53缺陷的人结肠癌细胞中,Mdm2抑制可通过激活Siva-1和PUMA的E2F-1和p73介导的蛋白表达而触发细胞凋亡[14]。
尽管E2F-1在某些癌症的发生和预后中已被证实发挥了作用,但是进一步生物信息学分析仍有待进一步研究。在前期研究中,我们发现E2F-1在结肠癌中的蛋白表达显著增高,但是E2F-1表达水平与肿瘤的分期不存在关联[2]。转染E2F-1质粒后,E2F-1稳定过表达的LoVo结肠癌细胞繁殖收到抑制。从实验结果的表面意义看,E2F-1在体外试验中可能对结肠癌有抑癌作用。但是结合E2F-1在其他肿瘤中的矛盾表现,我们认为直接认定E2F-1为抑癌基因是有争议的。因为E2F-1在细胞转录周期中是以细胞内“基因表达阀门”的身份存在的,其在肿瘤中的作用是透过其下游基因表达产物来实现的,没有证据表面E2F-1表达产物直接参与细胞周期进展调节。例如:在肿瘤细胞中改变E2F-1的表达平衡,受E2F-1调控的多种促凋亡基因[15]活化,促使肿瘤细胞进入凋亡程序[16-17]。
因此,确定E2F-1介导的细胞周期进展、细胞凋亡和许多其他关键生理过程的主要机制,揭示E2F-1及其靶基因体系或网络与不同类型的人类肿瘤的关系,可能揭示新的肿瘤治疗策略。此外,许多研究证实了E2F-1和E2F家族其他成员与癌症患者的临床病理特征和生存结局之间的存在显著相关性[18-19],表明E2F-1有可能成为特定肿瘤的预测性肿瘤标记物[20]。

