姜黄素类似物通过抑制17β-HSD3活性诱导前列腺癌LNCaP细胞凋亡*
韩杨,孙文慧,仲崇琦,王猛,包海花,张羽飞,吴丹,袁晓环
(牡丹江医学院医药研究中心,牡丹江 157011)
前列腺癌(prostate cancer,PCa)是男性最常见的泌尿生殖系统恶性肿瘤,多发于中老年人群。近年来,随着我国日益提高的人民生活水平,人口老龄化加剧,导致我国前列腺癌的发病率和病死率呈明显持续增长趋势[1]。雄激素依赖性前列腺癌属于前列腺癌的早期,其发病机制与雄激素存在重要关系,雄激素的主要成分是睾酮。有学者发现,存在于睾丸微粒体中的17β-羟基类固醇脱氢酶3(17β-hydroxysteroid dehydrogenase type 3,17β-HSD3)参与睾酮合成的最后一步[2],在雄激素依赖性前列腺癌中17β-HSD3表达显著上调。姜黄素(curcumin,Cur)在前列腺癌治疗中发挥重要作用[3]。但是姜黄素的生物利用度较差,限制其进一步的临床应用[4]。笔者所在课题组设计合成一系列稳定性高的姜黄素类似物,筛选出17β-HSD3抑制剂H7,并考察H7通过抑制17β-HSD3活性诱导LNCaP细胞凋亡,为早期前列腺癌的临床治疗提供新思路。
1 材料与方法
1.1主要试剂 胎牛血清 (德国PAN公司,批号:P130913);噻唑蓝(MTT)粉末 (北京索莱宝科技有限公司,批号:303H05-10);IP细胞裂解液及蛋白酶抑制剂(哈尔滨新海基因检测有限公司,批号:100956);RPMI1640 (美国 Hyclone公司,批号:AE27856292);实验用抗体Anti-Bax、Anti-Bcl-2、Anti-p53、Anti-Caspase-9 (美国Abcam公司,批号:GR80570-16、GR3250598-3、GR89716-52、GR3261735-1);Goat Anti-Rabbit IgG、Goat Anti-Mouse IgG (美国Abcam公司,批号:GR288027-12、GR298142-9);β-actin (美国Cell signaling公司,批号:15);SYBR Green (美国Roche公司,批号:39088900);RNA逆转录试剂盒 (美国Roche公司,批号:32460620);酶联免疫吸附测定(ELISA)检测睾酮试剂盒(武汉华美生物工程有限公司,批号:C0315090301)。
1.2主要仪器 高效液相色谱仪(美国Agilent公司),高分辨质谱仪(美国 Bruker公司),磁共振仪(美国Varian公司),CO2细胞培养箱(美国Thermo公司),超净工作台(美国ESCO公司),酶标仪(美国Molecular Devices公司),电泳槽(美国Bio Rad公司),凝胶成像系统(美国 UVP公司),实时荧光定量聚合酶链反应(PCR,美国 Bio Rad公司),放射性TLC(美国 BioScan 2000)。
1.3细胞 人雄激素依赖性前列腺癌细胞株LNCaP(中国科学院上海细胞库)。
1.4薄层色谱(TLC)法筛选17β-HSD3选择性抑制剂 采用TLC法检测姜黄素类似物(H1-H9)对17β-HSD3酶活性的抑制作用[5]。分别取大鼠胎盘微粒体20 μg和人胎盘微粒体90 μg到5 mL反应管中,每管中加0.2 μmol·L-1雄烯二酮及[3H]雄烯二酮40 000 cpm,并加0.2 mmol·L-1NADPH和含0.5%聚山梨酯-20的磷酸盐缓冲溶液(PBS)250 μL,每管加不同浓度的姜黄素类似物 (H1-H9,0.002,0.02,0.2,2,5,10 μmol·L-1),同时采用姜黄素做对照,置34 ℃培育1 h。加入预冷乙醚2 mL终止反应。混悬1 min,收集上清液到5 mL玻璃管中,用氮气吹干。加乙醚75 μL重溶样本,混悬1 min后,点样在TLC板上,用放射性TLC (Bioscan AR2000)检测放射峰值,计算睾酮转化率,确定半数抑制浓度(IC50),筛选17β-HSD3选择性抑制剂。
1.5细胞培养及分组 人雄激素依赖性前列腺癌细胞株LNCaP,采用含10%胎牛血清(FBS)的RMPI培养基,置于37 ℃、5% 二氧化碳(CO2)的恒温培养箱中培养。选取对数生长期状态良好的细胞,采用MTT法检测H1-H9抑制LNCaP的IC50值,确定合适的实验条件。取长势状态良好的对数生长期LNCaP细胞,以每孔1×105个密度接种到6孔板中,在37 ℃、5% CO2培养箱中培养12 h,分别加H1-H9,检测不同化合物对LNCaP的抑制作用。然后用筛选出来的17β-HSD3选择性抑制剂H7做后续实验。分成4组:空白对照组(Con)、姜黄素组(Cur,150 μmol·L-1),雄激素受体(AR)抑制剂组(5 μmol·L-1)、H7组(150 μmol·L-1)。取各组细胞,做基因和蛋白检测实验。
1.6MTT法检测H7对LNCaP细胞活性的影响 取对数生长期LNCaP细胞,细胞用蛋白胰酶消化后接种于96孔板中培养(每孔5000个细胞)。待12 h细胞贴壁后,将96孔板中液体吸弃,分别加入终浓度为25,50,80,100,150,200,250 μmol·L-1的H7,设置不加药物的对照组,每组设置6个复孔。然后放于37 ℃、含5% CO2恒温培养箱中分别培养12,24,48 h后,避光条件下每孔加入0.5 mg·mL-1MTT试剂。细胞继续培养4 h后,将孔中上清液吸弃,每孔避光快速加入DMSO 150 μL。摇床振荡10 min充分溶解后,用酶标仪检测板中各孔在490 nm处的吸光度(A值),采用公示计算细胞抑制率。实验重复3次。利用GraphPad Prism 5.0版软件计算出IC50值,确定最佳实验浓度梯度和作用时间。细胞抑制率(%)=(对照组A值-实验组A值)/(对照组A值-空白组A值)× 100%。
1.7实时荧光定量PCR检测LNCaP细胞中相关基因mRNA表达情况 取长势状态良好的对数生长期LNCaP细胞,按“1.5”项方法细胞培养和分组。加药24 h,将6孔板中培养液吸出弃掉,消化并收集细胞,使用mRNA提取试剂盒提取各组细胞的总RNA,超微量核酸测定仪检测mRNA浓度。取总RNA 1 μg,依照逆转录试剂盒步骤逆转录合成cDNA。分别用p53,Caspase-9,Bax,Bcl-2,rps16基因的引物在Q-PCR上进行扩增(引物序列见表1)。反应条件为95 ℃预变性30 s,95 ℃变性15 s,60 ℃退火1 min,72 ℃延伸45 s,进行40个循环,实验重复3次。rps16为内参基因,根据标准曲线法分析实验结果,计算出相关目的基因的表达量。
1.8Western blotting检测LNCaP细胞中相关蛋白表达情况 取长势状态良好的对数生长期LNCaP细胞,按“1.5”项方法细胞培养和分组。加药24 h,将6孔板中培养液吸出弃掉,用预冷PBS洗1次,加入含1% PMSF的RIPA裂解液,冰上放置5 min,用刮刀刮下细胞,收集液体,充分振荡使细胞裂解,4 ℃,12 000×g,离心15 min。收集上清液,得到细胞总蛋白,采用BCA法测定蛋白浓度,用上样缓冲液稀释蛋白,置于100 ℃沸水中煮10 min,4 ℃保存备用。取蛋白40 μg上样,进行SDS-PAGE电泳,将蛋白转至聚偏氟乙烯(PVDF)膜上,加入含5%脱脂奶粉的封闭液室温封闭1 h。分别加入Anti-p53,Anti-Caspase-9,Anti-Bax,Anti-Bcl-2,Anti-β-actin抗体(1:1000),4 ℃孵育过夜。用TBST缓冲液洗膜3次,每次10 min,Goat Anti-Rabbit IgG或Goat Anti-Mouse IgG(1:10 000)室温孵育1 h,用TBST洗膜3次,每次10 min。滴加显色液,置于成像系统显影并进行分析,目的蛋白与内参的条带灰度值之比代表各蛋白的相对表达量。
1.9ELISA 检测LNCaP细胞中睾酮含量 用ELISA试剂盒采用竞争酶联检测睾酮含量。取长势状态良好的对数生长期LNCaP细胞,按“1.5”项方法细胞培养和分组。加药24 h,收集6孔板中培养液,在2 ℃,1000×g离心15 min,上清液立即用于实验。按试剂盒说明书分别加酶结合物50 μL,按同样顺序加入抗体50 μL,充分混匀,贴上不干胶封片,置37 ℃孵育1 h,洗板,静置甩干,加显色液A液和B液各50 μL。37 ℃显色15 min,每孔加终止液50 μL。用酶标仪在波长450 nm处检测各孔A值。
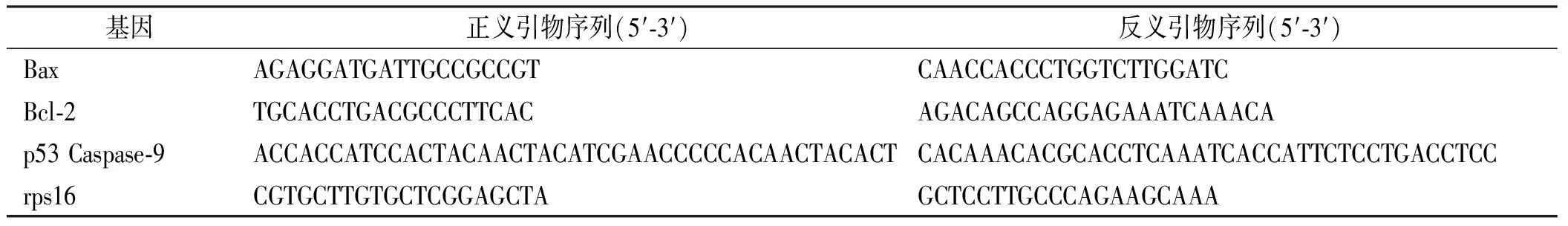
表1 LNCaP细胞中凋亡相关基因引物序列
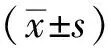
2 结果
2.1筛选17β-HSD3选择性抑制剂 采用放射性TLC法检测H7对大鼠及人胎盘微粒体中17β-HSD3活性的抑制作用,结果见表2。H1-H9对大鼠17β-HSD3活性抑制的IC50值为(20.9±0.02)~(1120.4±124.6)μmol·L-1,对人17β-HSD3活性抑制的IC50值为(4.9±0.02)~(3140.7±165.7)μmol·L-1,其中H7的IC50值最小。说明H7对大鼠及人胎盘微粒体中17β-HSD3活性有明显的抑制作用,而且与姜黄素组比较,H7的 IC50明显低于姜黄素(P<0.01)。提示姜黄素类似物可有效抑制17β-HSD3的活性,并且H7效果更明显。
表2 姜黄素类似物H1-H9对17β-HSD3活性的抑制作用(IC50)
Tab.2 Inhibition of H1-H9 on 17β-HSD3 activity(IC50)
①与Cur组比较,P<0.05;②与Cur组比较,P<0.01。
①compared with Cur group,P<0.05;②compared with Cur group,P<0.01.
2.2化合物抑制LNCaP细胞的增殖 用不同化合物(H1~H9)分别处理LNCaP细胞24 h后,MTT法考察H1~H9对LNCaP细胞活性的抑制作用,结果抑制率分别为(23.4±3.5)%,(59.5±3.4)%,(37.6±1.5)%,(39.3±3.3 )%,(29.7±2.6)%,(49.9±2.2 )%,(71.1±1.1)%,(52.4±2.5)%,(66.6±2.1)%,H7对LNCaP细胞抑制作用最明显。
用不同浓度梯度H7分别处理LNCaP细胞12,24,48 h后,MTT法考察H7对各组LNCaP细胞活性的抑制作用,结果见图1,随着作用浓度的升高,抑制细胞增殖的能力增强,H7明显抑了LNCaP细胞的活性,有显著的浓度依赖性。另外,随着H7对LNCaP细胞作用时间的延长,细胞活性降低,呈显著的时间依懒性。LNCaP细胞经H7处理12,24,48 h后IC50值分别为268,150,63 μmol·L-1,见表3。根据实验结果,后续实验采用H7浓度为150 μmol·L-1,作用时间是24 h。
按MTT法检测H7对LNCaP细胞活性的影响,结果见图2。与空白对照组比较,姜黄素组,AR抑制剂组和H7组细胞存活率明显降低(P<0.05或P<0.01),H7组比姜黄素对照组细胞中细胞存活率降低更显著(F=22.9,P<0.05)。
2.3H7对LNCaP细胞中凋亡相关基因mRNA表达的影响 应用Q-PCR对各组LNCaP细胞内p53,Caspase-9,Bax,Bcl-2 mRNA表达情况进行检测,结果见图3,F值分别为3.8,5.9,9.4。与空白对照组比较,姜黄素组、AR抑制剂组和H7组细胞中p53,Caspase-9 RNA表达量明显增加(P<0.05或P<0.01),H7组比姜黄素组中p53 mRNA表达量增加更显著(P<0.01),而且H7组比姜黄素组和AR抑制剂组中Caspase-9 mRNA表达量增加趋势更明显;同时,与空白对照组比较,姜黄素对照组、AR抑制剂组和H7组细胞中Bax/Bcl-2 mRNA表达量显著升高(P<0.05或P<0.01),H7组比姜黄素组细胞中Bax/Bcl-2 mRNA表达量显著升高(P<0.01)。说明姜黄素、AR抑制剂和H7均能不同程度增加LNCaP细胞内p53、Caspase-9、Bax/Bcl-2 mRNA的表达水平,并且H7作用效果更明显。
2.4H7对LNCaP细胞中凋亡相关蛋白表达的影响 采用Western blotting检测H7对各组细胞p53,Caspase-9,Bax,Bcl-2蛋白表达情况,结果见图4,F值分别为6.1,7.3,10.2。与空白对照组比较,姜黄素组、AR抑制剂组和H7组细胞中 p53、Caspase-9蛋白表达量明显增加(P<0.05或P<0.01),H7组比姜黄素组细胞中P53、Caspase-9蛋白表达量增加显著(P<0.01),并且H7组比AR抑制剂组细胞中Caspase-9蛋白表达量增加显著(P<0.01)。
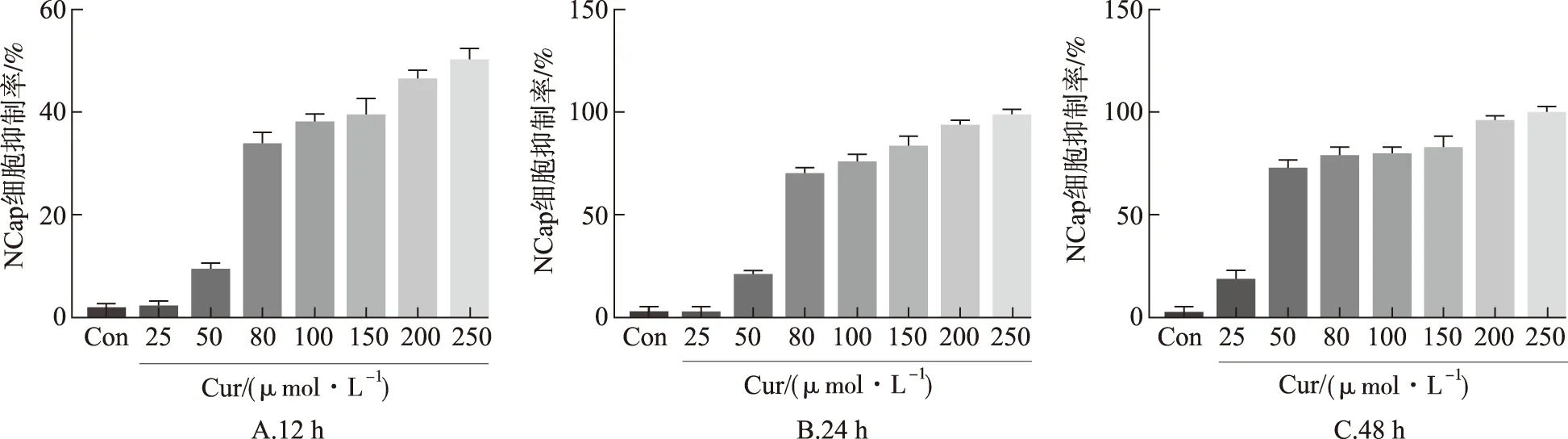
图1 H7抑制LNCaP细胞增殖的实验结果
表3 H7对17β-HSD3活性的抑制作用(IC50)
Tab.3 Inhibition of H7 on 17β-HSD3 activity(IC50)

化合物12 h24 h48 hH7268.4±12.1150.0±9.663.0±6.9Cur61 307.3±107.432 789.0±124.111 692.0±98.3F18.737.18.4P<0.01<0.01<0.01
同时,与空白对照组比较,姜黄素对照组、AR抑制剂组和H7组细胞中Bax/Bcl-2蛋白表达量显著升高(P<0.05或P<0.01),H7组比姜黄素组细胞中Bax/Bcl-2蛋白表达量增加显著(P<0.01)。说明姜黄素、AR抑制剂和H7均能不同程度增加LNCaP细胞内p53、Caspase-9、Bax/Bcl-2的蛋白表达水平,诱导LNCaP细胞凋亡,并且H7作用效果更明显。
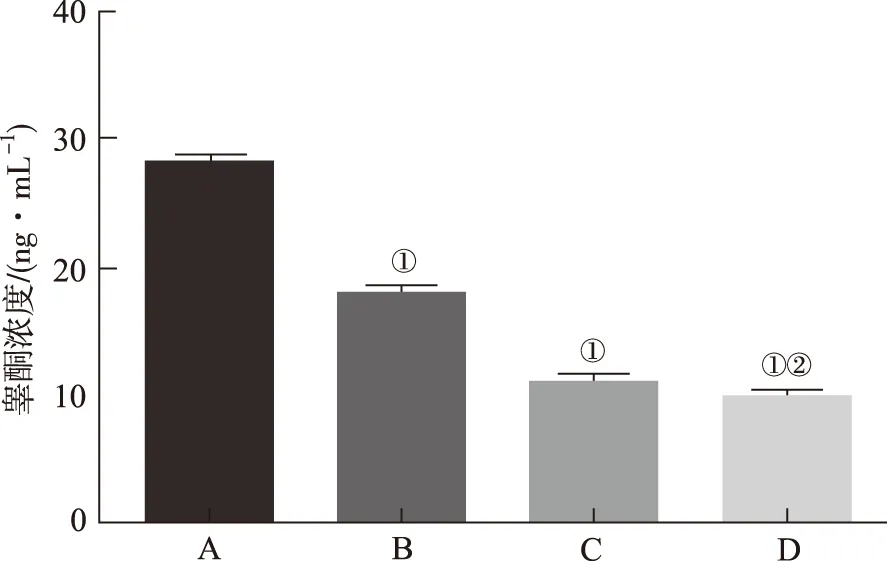
2.5H7对LNCaP细胞中睾酮含量的影响 采用ELISA法检测H7对各组细胞睾酮的含量,结果见图5,F=17.8。与空白对照组比较,姜黄素组,AR抑制剂组和H7组细胞中睾酮含量明显减少(P<0.01),H7组比姜黄素对照组细胞中睾酮含量减少更显著(P<0.01)。
A.空白对照组;B.姜黄素组;C.AR抑制剂组;D.H7组;①与空白对照组比较,P<0.05;②与空白对照组比较,P<0.01;③与姜黄素组比较,P<0.05。
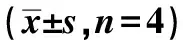
A.blank control group;B.curcumin group;C.AR inhibitor group;D.H7 group;①compared with blank control group,P<0.05;②compared with blank control group,P<0.01;③compared with curcumin group,P<0.05.
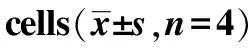
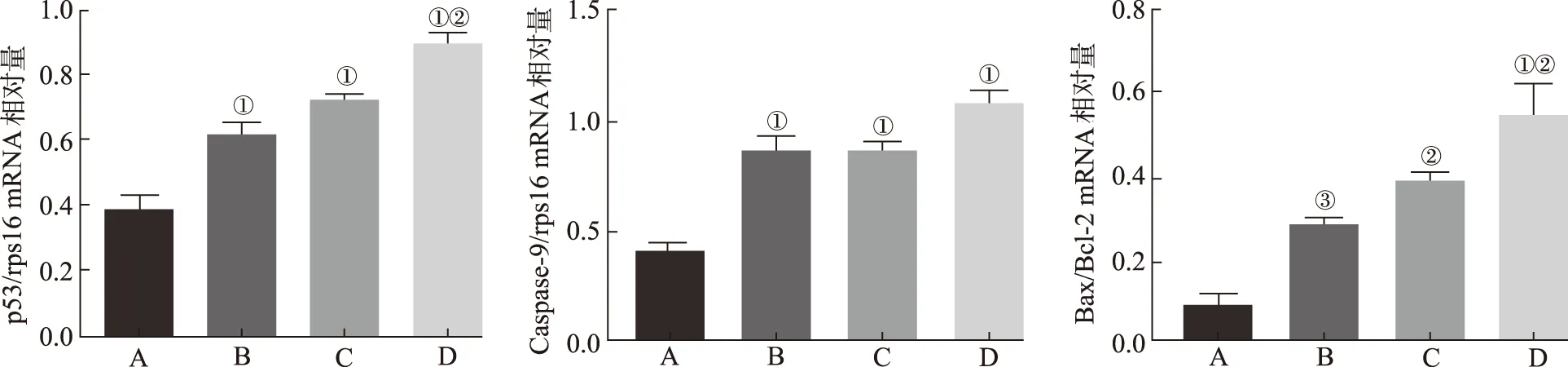
A.空白对照组;B.姜黄素组;C.AR抑制剂组;D.H7组 ;①与空白对照组比较,P<0.01;②与姜黄素组比较,P<0.01;③与空白对照组比较,P<0.05。
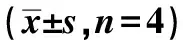
A.blank control group;B.curcumin group;C.AR inhibitor group;D.H7 group;①compared with blank control group,P<0.01;②compared with curcumin group,P<0.01;③compared with blank control group,P<0.05.
A.空白对照组;B.姜黄素组;C.AR抑制剂组;D.H7组 ;①与空白对照组比较,P<0.05;②与空白对照组比较,P<0.01;③与姜黄素组比较,P<0.01;④与AR抑制剂组比较,P<0.01。
A.blank control group;B.curcumin group;C.AR inhibitor group;D.H7 group;①compared with blank control group,P<0.05;②compared with blank control group,P<0.01;③compared with curcumin group,P<0.01;④compared with AR inhibitor group,P<0.01.
A.空白对照组;B.姜黄素组;C.AR抑制剂组;DH7组 ;①与空白对照组比较,P<0.01;②与姜黄素组比较,P<0.01。
A.blank control group;B.curcumin group;C.AR inhibitor group;D.H7 group;①compared with blank control group,P<0.01;②compared with curcumin group,P<0.01.
3 讨论
姜黄素是传统中药姜黄中的主要成分[7],具有消炎[8]、抗氧化[9]、降血脂[10]和抗癌[11]等诸多药理作用。由于姜黄素结构中含有双酮,导致其水溶性低,临床应用受限[4]。本课题组以姜黄素为母体,去掉姜黄素中的双酮结构,设计合成一系列含有哌啶酮结构的姜黄素类似物[6],前期实验发现姜黄素类似物比姜黄素有更高的稳定性,并且筛选出治疗糖尿病的姜黄素类似物H8[12],对于治疗前列腺癌的化合物没有进行深入研究。本研究显示,H7对LNCaP细胞的体外增殖有明显的抑制作用,且随着H7浓度的升高,抑制LNCaP细胞增殖的能力逐渐加强,呈显著的浓度依懒性。
早期前列腺癌几乎都表现为雄激素依赖性,雄性激素能够刺激前列腺癌细胞生长。早期前列腺癌主要有手术、放射治疗以及雄激素阻断疗法。雄激素阻断疗法也称为去势疗法(androgen deprivation therapy,ADT),接受ADT 治疗的患者最终都会对ADT 产生抗性,从而患去势抵抗性前列腺癌(Castration-resistant prostate cancer,CRPC),进而增加治疗难度,增大死亡风险[13],因此早期前列腺癌防治至关重要。
前列腺癌的发生与体内雄激素分泌异常增多有关,雄烯二酮是人体内主要的雄激素前体,通过催化还原能被转化为睾酮[14]。17β-HSD在哺乳动物中有10种亚型,其中17β-HSD3为雄激素的限速酶,在睾酮合成过程中起主导作用。17β-HSD3位于睾丸间质细胞内质网内,将雄烯二酮(经胆固醇转化而成)氧化为睾酮,该反应是睾丸间质细胞合成睾酮酶促反应的最后一步,17β-HSD3发挥重要作用[2]。一般情况下,体内17β-HSD3发挥正常生理功能,如果17β-HSD3活性过高,会大大提高前列腺癌的发生率,因此17β-HSD3抑制剂有望成为治疗前列腺癌的新靶点药物。有学者研究,用17β-HSD3抑制剂处理被移植进LNCaP细胞的去势雄性小鼠中,发现其对前列腺癌肿瘤生长的抑制率高达81%[15]。研究报道,17β-HSD3抑制剂STX2171和STX1383显著降低血浆睾酮水平和抑制雄激素依赖性体内肿瘤生长,表明17β-HSD3抑制剂可用于激素依赖性前列腺癌的治疗[16]。本实验结果显示,姜黄素,AR抑制剂及H7能显著抑制LNCaP细胞内17β-HSD3的活性,且H7的抑制率效果优于姜黄素,提示H7可能作为17β-HSD3抑制剂对前列腺癌发挥治疗作用。
文献报道,增加凋亡基因Bax/Bcl-2,p53,Caspase-9的基因和蛋白表达水平能够治疗前列腺癌[17]。本研究结果显示,姜黄素、AR抑制剂和H7均不同程度增加LNCaP细胞中Bax/Bcl-2、p53,Caspase-9基因和蛋白的表达,诱导LNCaP细胞凋亡,且H7诱导LNCaP细胞凋亡的能力更明显。综上所述,姜黄素类似物H7可通过抑制雄激素依赖性前列腺癌细胞系LNCaP中17β-HSD3的活性,降低睾酮含量从而促进LNCaP细胞凋亡,可能与其抑制AR信号通路相关,但详细机制尚需深入研究。

