GJB2基因检测联合听力筛查在新生儿听力损失筛查中的应用
赵雪卉,刘宗印,张娟,唐凯,蒋晓颖
宝鸡市妇幼保健院产科1、医教科2、院遗传室3,陕西 宝鸡 721000
先天性听力损失是新生儿先天性缺陷性疾病之一,临床发病率0.1%~0.3%[1],先天性听力损失影响患儿语言发育和身心发育,给家庭和社会带来沉重的负担。新生儿听力筛查有助于早期发现先天性听力障碍患儿及其高危因素。但是新生儿先天性听力损失临床表现复杂,发病时间不确定,部分患儿可为进行性、迟发性听力损失,采用常规物理听力筛查存在较高漏诊率[2]。缝隙连接蛋白β2(GJB2)基因参与内耳钾离子循环,GJB2基因突变可影响钾离子通道转运蛋白改变,进而导致钾离子循环和转运异常,出现听力损失[3-4]。因此建立听力筛查和听力损失易感基因检查对临床积极采取干预措施,改善患者预后有重要意义。本研究探讨新生儿听力筛查联合GJB2 基因多态性检测在新生儿先天性听力损失诊断中的应用价值。
1 资料与方法
1.1 一般资料 选择2017 年6 月至2018 年6 月于宝鸡市妇幼保健院产科分娩的1 220例足月新生儿为研究对象,所有新生儿家属均知情并同意进行听力筛查和GJB2 基因多态性检测。其中男性650 例,女性570 例;胎龄36~42 周,平均(39.42±3.45)周;母亲年龄24~38 岁,平均(30.75±5.61)岁;出生体质量2 500~4 102 g,平均(3 412.52±146.75)g;阴道分娩760 例,剖宫产460 例;出生阿氏评分9.5~10 分,平均(9.80±8.16)分。听力损失高危因素:听力损失家族史35 例,宫内感染16 例,高胆红素血症19 例,新生儿窒息21 例,妊娠期母亲服用至听力损失药物13 例。本研究经医院医学伦理委员会批准,患者及其家属均知情并签署同意书。
1.2 方法
1.2.1 听力筛查方法 对无听力高危的新生儿生后48~72 h 在产科病房进行初筛,筛查仪器(丹麦尔听美)为耳声发射仪,环境噪声<40 dB。具体操作:患儿自然睡眠,用消毒棉签清洁外耳道,选用大小合适的耳塞,顺着外耳道的方向,轻轻放入耳道内,测试声强为35 dB,瞬态短纯音,测试结果仪器自动判断,以Pass (通过)或Refer (未通过)显示结果。初筛结果为Refer的婴儿,42 d复查。复查流程:脑干听觉诱发电位+瞬态耳声发射+宽频声导抗三联检查,脑干听觉诱发电位采用德国专科公司生产MB11,环境噪声要求<45 dB,刺激信号为CE-Chirp 声,刺激水平35 dB,仍为仪器自动分析,结果为通过或转诊(未通过);耳声发射检查同初筛;宽频声导抗采用丹麦Titan 专用仪器,环境噪声<45 dB,行耳镜检查排除耳道耵聍及外耳道湿疹及中耳炎后,患儿自然睡眠,选用合适耳塞,使外耳道与耳塞密闭,做出声导抗图由耳鼻喉医生判读。脑干+耳声均通过,声导抗无问题,进行随访观察,对于脑干+耳声均未通过者,转西安交大二附院听力诊断中心进一步诊治,听觉诱发电位通过,耳声发射有问题多数伴声导抗不正常,给予门诊治疗。
1.2.2 GJB2基因检测 新生儿出生后3 d采足底血3 mL置于2%EDTA抗凝试管中,取100 μL样本,加入红细胞裂解液混匀,冰浴15 min,4℃离心3 min,弃上清,加入5%Chelez 100 200 μL 充分混匀,56℃孵育20 min,震荡10 s,离心2 min,取上清储存于-20℃低温冰箱保存备用。取DNA液60 μL,应用AU1001核酸提取仪及配套试剂(北京百泰克公司)提取DNA,以Tris-HC1做空白对照,UV7500双光束紫外可见分光光度计(上海棱光技术有限公司)鉴定DNA纯度和完整性,取吸光度(A260/280nm)值在1.6~1.8,浓度>50 ng/μL的DNA样品待检。采用晶芯遗传性耳聋基因检测试剂盒(上海Invitrogen生物技术有限公司提供)对耳聋基因进行筛查,检测方法为微阵列芯片法,将血样送至我院完成常见4 个耳聋基因15 个热点突变位点(454 例新生儿),即GJB2 基因的35 del G、176 del 16、235 del C 和299 del AT 4 个位点,SLC26A4 基因的2168 A>G、IVS7-2 A>G,GJB3 基因的538C>T 位点,线粒体12s rRNA 基因的1555A>G 和1494 C>T,SLC26A4基因的1174 A>T、1226 G>A、1229 C>T、1975 G>C、2027 T>A、IVS15+5 G>A,4 个基因出现任一位点的杂合突变即为耳聋基因筛查“未通过”标准。
1.3 统计学方法 应用SPSS 25.0软件进行数据分析,计量资料以均数±标准差表示,以率(%)表示计数资料,采用四格表计算听力筛查和GJB2基因检测技术诊断新生儿听力损失的灵敏度、特异度、阳性预测值和阴性预测值。
2 结果
2.1 新生儿听力筛查结果 1 220例新生儿听力筛查阳性35例;听力学诊断15例听力损失,其中轻度3例,中度5例,重度4例,极重度3例。
2.2 GJB2 基因检测结果 1 220 例新生儿GJB2基因突变55 例,见表1,其中IVS7-2 A >G 比例最高,为30.91%,其次为235 del C,比例为25.45%。

表1 GJB2基因检测结果
2.3 听力筛查、GJB2 基因检测结果比较 听力筛查阳性、GJB2 基因检测结果见表2,其中16 例听力筛查阳性、GJB2基因检测阳性者最终经听力学诊断13例听力损失;19 例听力筛查阳性、GJB2基因检测阴性者最终经听力学诊断1 例听力损失;39 例听力筛查阴性、GJB2基因检测阳性者最终经听力学诊断1例听力损失。

表2 听力筛查与GJB2基因检测结果比较(例)
2.4 听力筛查、GJB2 基因检测联合诊断新生儿听力损失 以听力学诊断为准,听力初筛诊断新生儿听力损失灵敏度为26.67%,特异度为91.70%,阳性预测值为3.85%,阴性预测值为99.01%。听力复筛诊断新生儿听力损失灵敏度为53.33%,特异度为97.76%,阳性预测值为22.86%,阴性预测值为99.41%。GJB2基因检测诊断新生儿听力损失灵敏度为80.00%,特异度为96.43%,阳性预测值为21.82%,阴性预测值为99.74%。以听力筛查和GJB2基因检测结果均阳性为阳性判断标准,联合听力筛查和GJB2基因检测对新生听力损失的诊断灵敏度率为86.67%,特异度为99.75%,阳性预测值为81.25%,阴性预测值为99.83%,见表3。
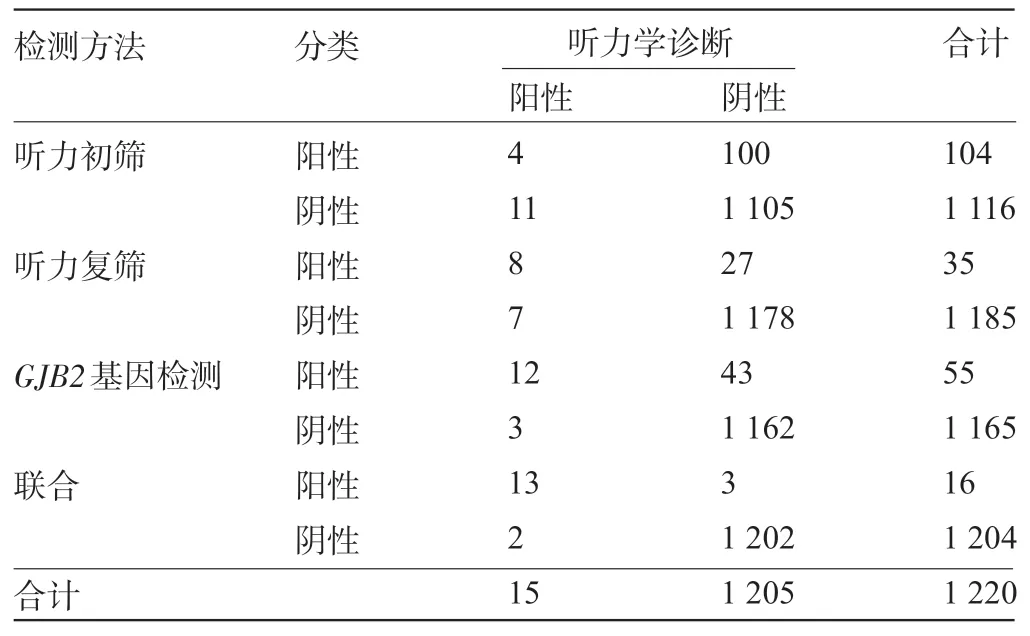
表3 听力筛查、GJB2基因检测联合诊断新生儿听力损失效能(例)
3 讨论
新生儿听力筛查是临床上已经较为普及的听力筛查方法,是预防耳聋的基本措施,有助于早期发现和诊断新生儿听力损失,减少因听力障碍导致的语言、神经、精神发育异常,保证儿童健康成长[5]。耳声发射法和快速脑干听觉诱发电位是新生儿听力筛查的有效方法,耳声发射法反映耳蜗外、传音结构功能,操作方法简单易掌握,检查时间短,但是容易受到外耳、中耳状态的影响,需要在新生儿自然睡眠和安静环境中进行,易漏诊耳蜗后病变,假阴性率高[6]。本研究初筛阳性新生儿中4 例经听力学诊断为听力损失,听力初筛诊断新生儿听力损失灵敏度仅为26.67%。快速脑干听觉诱发电位反映耳祸、听神经、脑干听觉通路功能,几乎不受中耳道碎屑影响,是听神经疾病检查的首选,适合新生儿听力复筛检查[7]。本研究采用耳声发射法初筛、快速脑干听觉诱发电位复筛联合应用将新生儿听力损失诊断灵敏度提高至53.33%,有效降低假阳性率及假阴性率。
GJB2 基因编码连接蛋白是电解质、代谢产物、第二信使在细胞之间转换的重要通道,其中CX26 蛋白在耳蜗中高度表达,GJB2基因突变可导致耳蜗听力传导异常,导致听力损失的发生。现代研究认为GJB2是非综合性、遗传性耳聋常见耳聋隐性遗传基因,也是突变频率最高的致聋基因,GJB2突变引起的听力损失占整体的12.88%[8-9]。GJB2基因突变可导致不同程度听力损失,多数为重度或极重度感音神经性耳聋,因此本研究选择GJB2 基因作为新生儿听力损失筛查的检测指标。相关报道显示听力筛查阳性新生儿GJB2基因突变检出率更高,GJB2基因突变患儿迟发性听力损失发生率高[10-11]。本研究GJB2基因检测突变55例,检出率为4.51%,说明GJB2 突变基因有较高携带率,其中在GJB2 基因突变中,IVS7-2 A>G 比例最高,为30.91%,其次为235 del C,比例为25.45%,与其他研究结果一致[12-13]。本研究中1 例GJB2 235delC 纯和突变经听力学诊断为重度听力损失,说明35delC纯和突变携带者具有更高的听力损失风险和更重的听力损失程度。GJB2 基因检测阳性中共12 例诊断为听力损失,GJB2 基因检测诊断新生儿听力损失灵敏度为80.00%,明显高于听力筛查,说明GJB2基因检测有较高听力损失检出效果。GJB2 基因杂合携带者少见发病,但与GJB2基因杂合携带者婚配可导致后代发病,产前进行GJB2 基因检测有助于防止子代听力损失的发生,而听力筛查在新生儿娩出诊断具有滞后性,这也是GJB2基因独特的优势。
但是目前认为大量听力损失相关基因尚未被探知,因此单纯依靠听力损失相关基因检测存在一定局限性,听力筛查与听力损失相关基因联合检测是新型的新生儿听力筛查方法,有助于提高语前听力损失检出率,本研究联合听力筛查和GJB2基因检测对新生听力损失的诊断灵敏度率达86.67%,阳性预测值也提高至81.25%,说明听力筛查联合GJB2 基因检测可最大程度为新生儿听力障碍提供确切诊断。
综上所述,新生儿听力筛查、GJB2 基因检测是新生儿听力损失的有效筛查手段,联合两种方法检测则有助于提高新生儿听力损失检出率,降低漏诊率,是新生儿听力障碍筛查的有效手段。

