保加利亚乳杆菌微胶囊的制备及特性研究
周 莉,王晓瑞,平 洋,谭 静,张立攀,朱海华,关炳峰,刘红伟,徐 钟
(河南省商业科学研究所有限责任公司,河南郑州 450002)
保加利亚乳杆菌是益生菌中被广泛应用的乳酸杆菌[1],分布较广,不仅在传统发酵制品(酸奶、奶酪、冷冻乳制品[2]等)中常见,同时也存在于人体和动物的肠道中[3],有着非常重要的生理功能。乳杆菌具有调整肠道菌群平衡[4],抑制肠道中的致病菌和腐败菌的繁殖[5],促进营养物质的吸收[6],免疫调节[7],抗癌[8]等多种功能。随着保加利亚乳杆菌的生理功能不断被深入研究,保加利亚乳杆菌也得到了越来越多的关注。然而,保加利亚乳杆菌不宜储存,而且抗逆性较差,对高酸性环境敏感,活菌数易降低或丧失[9]。保加利亚乳杆菌进入人体后,通过食管抵达胃部,但是人类胃液的pH较低,会导致此菌无法忍受胃液的高酸环境,最后无法发挥益生菌的作用[10]。
微胶囊化包埋技术可以降低肠胃对益生菌的杀伤,提高益生菌的存活率[11]。微胶囊包埋技术是一种新型的保护技术,可增强益生菌对外界不良环境的抵抗能力,有效提高益生菌的存活率,使益生菌顺利到达肠道内定殖并真正发挥功效;同时避免不良反应的发生,改善食品在储藏和运输下的损失,延长货架期[12]。因此,为了益生菌能够达到益生作用,有必要开发新型包埋技术保护益生菌的活性,为其应用提供技术和参考价值[13]。壁材的选用是微胶囊包埋技术的关键。海藻酸钠由于具有廉价、适用性高、安全无毒、生物相容性高的优点,是目前最广泛用于包埋益生菌的壁材。肖雨等[14]利用海藻酸钠和氯化钙对保加利亚乳杆菌进行包埋,产酸量能达到59.4和55.8 g/L,产酸效果较好且保持了菌种的高活性。王伟洁等[15]以海藻酸钠和果胶复合包埋制备保加利亚乳杆菌微胶囊,包埋率达到91.8%,提高了其在产品中的存活率。Krasaekoopt等[16]将双歧乳杆菌与海藻酸盐的混合液注入CaCl2固化液制得双歧杆菌微胶囊,发现微胶囊化效果较好。壳聚糖由于成本低、无毒、具有生物可降解性已经被广泛地应用于医学和食品行业,它具有抗菌和抗氧化的特性[17]。有文献报道,海藻酸盐壳聚糖微胶囊有助于对细胞的保护[18],并且壳聚糖可以增强包埋的有效性[19]。
国内外有关益生菌微胶囊的研究大多停留在方法和壁材上,关于益生菌微胶囊在胃肠道的释放情况研究甚少。本研究利用海藻酸钠和壳聚糖复合包埋保加利亚乳杆菌,分别进行单因素实验和正交试验,以包埋率为指标,确定最佳包埋条件。研究在模拟胃肠道中活力变化及释放特性,并观察微胶囊在储存期间活菌数的变化。本研究不仅有助于解决乳酸杆菌不耐人体胃肠道恶劣环境(如胃液低pH)的问题,同时为研究具有肠道缓释功能的益生菌微胶囊壁材开辟了新思路,并通过益生菌来调节胃肠道微生态平衡,从而为益生菌保健功效的发挥奠定基础。
1 材料与方法
1.1 材料与仪器
MRS肉汤、MRS培养基、莫匹罗星锂盐改良MRS琼脂 郑州亚世生物技术有限公司;保加利亚乳杆菌 广东环凯生物科技有限公司;纯牛奶(250 mL/盒) 内蒙古伊利实业集团股份有限公司;胃蛋白酶(1∶3000)、胰蛋白酶(1∶250) biofroxx公司;海藻酸钠(98%)、壳聚糖(脱乙酰度≥90%) 上海源叶生物科技有限公司;磷酸氢二钠、磷酸二氢钠、氯化钙、氯化钠、盐酸 国药集团化学试剂有限公司。
YQX-Ⅱ厌氧培养箱、DPX-9162B-2电热恒温培养箱 上海福玛实验设备有限公司;TM 3030 plus 扫描电子显微镜 日本日立高新技术公司;85-2恒温磁力搅拌器 海司乐仪器有限公司;YXQ-LS-50型立式压力蒸汽灭菌锅 上海博迅实业有限公司;UNIVERSAL 320R型高速离心机 德国Hettich公司;QL-866型旋涡振荡器 江苏海门其林贝尔仪器制造有限公司;BSC-1500ⅡB2-X型生物安全柜 鑫贝西Biobase公司;SHZ-82型恒温振荡器 常州国华电器有限公司;HH-S恒温水浴锅 金坛市医疗器械厂;700 Series型-80 ℃冰箱 中科美菱公司;PL202-L电子分析天平 梅特勒-托利多仪器(上海)有限公司;milli-Q超纯水仪 美国Milipore公司。
1.2 实验方法
1.2.1 菌种活化 将实验室保存的保加利亚乳杆菌菌种按1%的量接种于9 mL MRS液体肉汤培养基中,37 ℃恒温(厌氧)培养18 h,活化2~3次后,再按1%的量接种于250 mL MRS液体肉汤培养基中,37 ℃恒温(厌氧)培养15 h,4500 r/min离心10 min收集菌体,0.9%生理盐水洗涤,离心后再洗涤两次,即得原始浓缩菌液。
1.2.2 微胶囊的制备 海藻酸钠溶于灭菌水中[20],70 ℃下水浴加热过夜至粉末充分溶解,制得海藻酸钠溶液,并经过0.22 μm滤膜过滤除菌,冷却备用。称取一定质量的壳聚糖,溶于含有1%(w/w)盐酸的无菌水中,在磁力搅拌器上搅拌直至溶解完全。使用磁力搅拌器在800 r/min速度下,固化备用。
称取一定质量的氯化钙颗粒溶于双蒸水,121 ℃高压灭菌15 min,制得氯化钙溶液,将菌液、壳聚糖和海藻酸钠按一定的比例混合,注射器将10 mL混合液滴入100 mL 氯化钙固化剂中,形成微囊,磁力搅拌器搅拌30 min,使微囊充分凝固,用蒸馏水冲洗3次,除去多余的钙离子和未被包埋的益生菌,即得湿胶囊。
1.2.3 微胶囊包埋率计算 称取1 g微胶囊,加到9 mL磷酸盐缓冲溶液中(pH7.4),均质分散30~60 s,缓慢摇晃此均质液5 min后,取适量匀浆液,稀释一定倍数,涂布于MRS琼脂培养基上,36 ℃厌氧培养48 h后计数平板上的所有菌落数。微胶囊的包埋率计算公式:
包埋率(%)=微胶囊中包埋的活菌数/制备微胶囊时添加的活菌数×100
1.2.4 微胶囊形态观察 采用扫描电显镜(SEM)观察微胶囊的表面形态时,在样品台上贴上一层双面胶,将微胶囊轻轻粘在上面吹去多余的粉末,然后在样品上喷金,进行SEM观察,并对胶囊内部结构进行观察。
1.2.5 微胶囊制备单因素实验
1.2.5.1 海藻酸钠浓度对微胶囊包埋率的影响 在壳聚糖浓度为1.5%,氯化钙浓度为2%,固化时间为120 min,海藻酸钠浓度为1%、2%、3%、5%、8%的条件下,参照微胶囊的制备工艺制得微胶囊后,以微胶囊的包埋率为测定指标,探究海藻酸钠浓度对微胶囊包埋率的影响。
1.2.5.2 壳聚糖浓度对微胶囊包埋率的影响 在海藻酸钠浓度为3%,固化时间为120 min,氯化钙浓度为2%,取壳聚糖浓度分别为0.5%、1%、1.5%、2%、2.5%的条件下,参照微胶囊的制备工艺制得微胶囊后,以微胶囊的包埋率为测定指标,探究壳聚糖的浓度对微胶囊包埋率的影响。
1.2.5.3 氯化钙浓度对微胶囊包埋率的影响 在海藻酸钠浓度为3%,壳聚糖浓度为1.5%,固化时间为120 min,氯化钙浓度为1%、2%、3%、5%、8%的条件下,参照微胶囊的制备工艺制得微胶囊后,以微胶囊的包埋率为测定指标,探究氯化钙的添加量对微胶囊包埋率的影响。
1.2.5.4 固化时间对微胶囊包埋率的影响 在海藻酸钠浓度为3%,壳聚糖浓度为1.5%,氯化钙浓度为2%的条件下,参照微胶囊的制备工艺形成微囊后,然后用磁力搅拌器搅拌,分别固化30、60、90、120、150 min,过滤,并用蒸馏水将胶囊冲洗3次,即得湿胶囊。以微胶囊的包埋率为测定指标,确定最佳的固化时间。
1.2.6 正交试验优化包埋条件 根据单因素实验结果,筛选出效果较优的工艺条件。采用4因素3水平L9(34)正交试验设计,以包埋率为检测指标,通过试验最终确定微胶囊工艺条件。正交试验设计如表1所示。
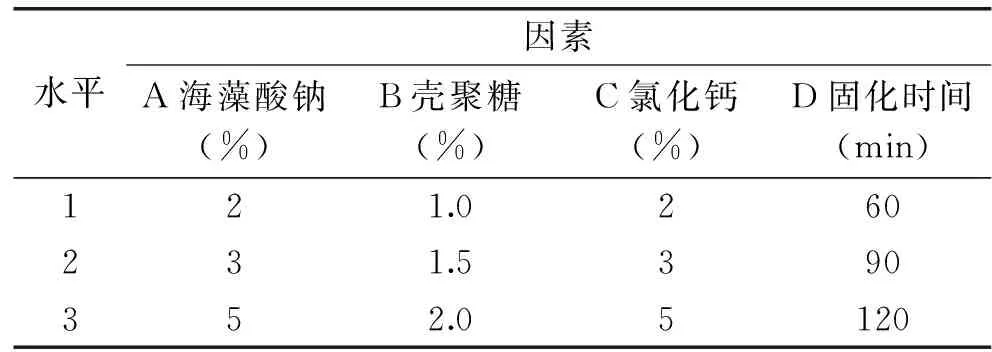
表1 正交试验设计因素水平表Table 1 Factors and levels of orthogonal experiment
1.2.7 微胶囊在模拟胃液中的耐受性 模拟人工胃液[21]:取稀盐酸16.4 mL,加水约800 mL,调pH到2.0,胃蛋白酶10 g,搅匀后加水定容至1000 mL即可。
取0.5 g微胶囊加入到模拟胃液(4.5 mL)中,充分混匀15 s,在37 ℃条件下,以200 r/min在摇床中振荡处理30、60、90、120 min,分别离心并取样,计算活菌数。并取保加利亚乳杆菌菌液做对照试验。
1.2.8 微胶囊在模拟肠液中的释放性 模拟人工肠液[22]:磷酸二氢钾6.8 g,加500 mL蒸馏水溶解,用0.4%的氢氧化钠调节pH至6.8;120 ℃灭菌20 min;胰蛋白酶10 g,加无菌水适量使溶解,将两液混合后,加水定容至1000 mL。
取0.5 g微胶囊加入到模拟肠液(4.5 mL)中,充分混匀15 s,在37 ℃条件下,以200 r/min在摇床中振荡处理30、60、90、120、150 min,分别离心并取样,计算活菌数。并取保加利亚乳杆菌菌液做对照试验。
1.2.9 微胶囊在食品中的储藏稳定性 将制备好的经过包埋的保加利亚乳杆菌加入到纯奶中,在4 ℃条件下进行保藏。每隔3~7 d对活菌数进行测定,检测产品的储藏稳定性。
1.3 数据处理
所有数据均为3次独立重复试验的结果,均采用平均数±标准差表示,利用Excel和SPSS对试验数据进行分析,以P<0.05有显著统计学意义。
2 结果与分析
2.1 保加利亚乳杆菌微胶囊外观形态特征
微胶囊形态为肉眼可见的白色圆形小球,大小较为均匀,差异不大,基本达到预期效果。当菌体和海藻酸钠的复合物滴入到氯化钙溶液后,再用壳聚糖溶液洗涤,形成一个个分散的小球,氯化钙中的钙离子和海藻酸钠中的钠离子不断相互取代,形成海藻酸钙凝胶,再与壳聚糖形成聚电解质膜,从而将菌液包埋起来,形成保加利亚乳杆菌微胶囊。
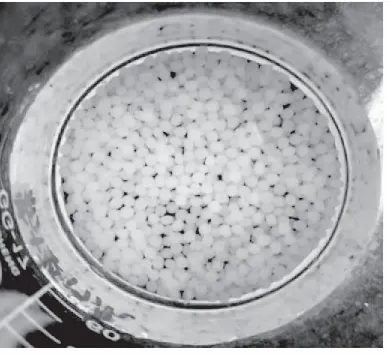
图1 保加利亚乳杆菌微胶囊外观图Fig.1 The appearance of Lactobacillus bulgaricus microcapsule

图2 微胶囊扫描电镜图Fig.2 SEM images of microcapsules
2.2 单因素实验
2.2.1 海藻酸钠浓度对保加利亚乳杆菌微胶囊的影响 如图3所示,海藻酸钠浓度在1%~3%浓度范围内,包埋率随海藻酸钠浓度的加大而增大,包埋率显著提高(P<0.05)。当海藻酸钠浓度达到3%时,包埋率达到最大,与其它试验组有明显差异性。当海藻酸钠继续增大时,包埋率降低。这是由于海藻酸钠浓度高时,溶液粘度增大,益生菌不易分散[23];当海藻酸钠浓度低时,形成的凝胶颗粒小,机械强度低,不能有效包埋菌体,影响包埋效果。选择试验最优结果,最终以3%的海藻酸钠浓度为后续试验条件。
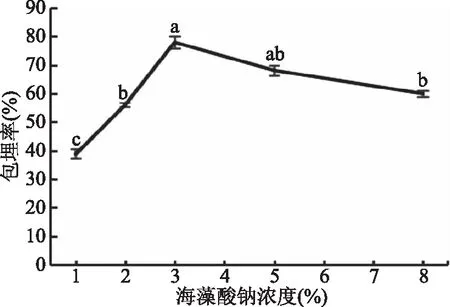
图3 海藻酸钠浓度对微胶囊包埋率的影响Fig.3 Effect of sodium alginate concentrationon microcapsule embedding rate注:不同小写字母表示差异显著,P<0.05;图4~图6同。
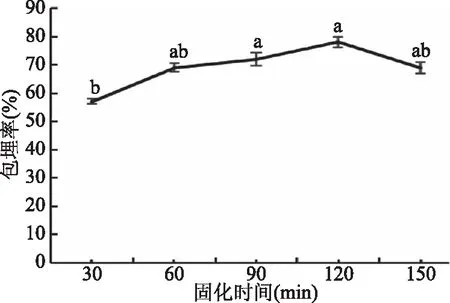
图6 时间对微胶囊包埋率的影响Fig.6 Effect of time on embedding rate of microcapsules
2.2.2 壳聚糖浓度对保加利亚乳杆菌微胶囊的影响 如图4所示,当壳聚糖的浓度为1.5%时,微胶囊包埋率最高,与其它试验组相比差异显著(P<0.05)。随着壳聚糖浓度的增加,包埋率也增高,当壳聚糖浓度大于1.5%时,包埋率显著降低(P<0.05)。可能由于,随着壳聚糖浓度的增大,壳聚糖与海藻酸钠结合越来越紧密,对包埋物质扩散的抑制作用增强[24],包埋率增加。继续增大壳聚糖浓度,壳聚糖与海藻酸钠所形成的结构致密程度较高,在微胶囊中的保加利亚乳杆菌活菌不易泄露出来,包埋产率呈下降的趋势。因此壳聚糖浓度为1.5%较适宜。
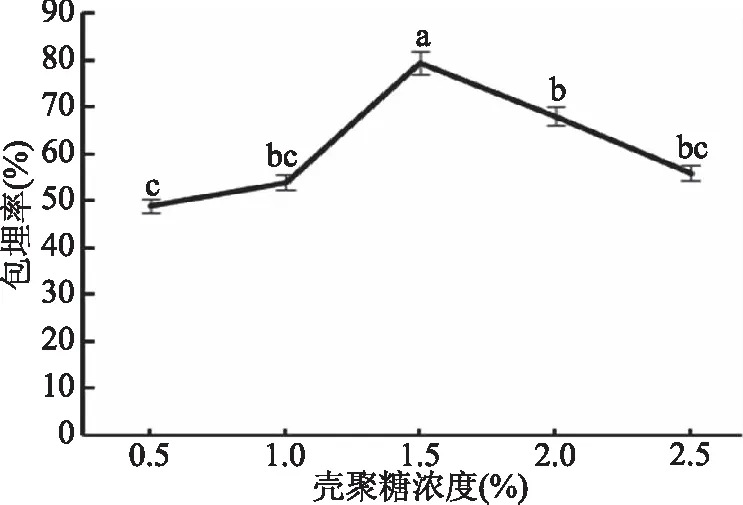
图4 壳聚糖浓度对微胶囊包埋率的影响Fig.4 Effect of chitosan concentrationon the embedding rate of microcapsules
2.2.3 氯化钙浓度对保加利亚乳杆菌微胶囊的影响 如图5所示,在CaCl2浓度为3%、5%和8%微胶囊粒径无显著差异(P>0.05),但当CaCl2浓度小于2%时,随着CaCl2浓度的升高,包埋率也增大,当CaCl2浓度为2%时,包埋率达到最大值。但随着CaCl2浓度继续升高,包埋率反而降低。分析原因可能是Ca2+含量增加时,体系中与壁材发生交联反应的钙离子相对越来越少,交联反应有限[15],无法包埋更多的保加利亚乳杆菌,导致包埋率降低。因此将2%氯化钙作为保加利亚乳杆菌微胶囊的最佳制备条件。
2.2.4 固化时间对保加利亚乳杆菌微胶囊的影响 由图6中看出,微胶囊的包埋率随固化时间的增加而逐渐增加,在固化时间为30~90 min时,包埋率显著提高(P<0.05),到120 min包埋率达到最大,而后略降低。分析原因可能是固化时间为120 min时,已能够使包埋壁材和菌液充分结合,延长时间氯化钙使微胶囊的脆性增加,菌体释放数减少,包埋率降低。因此,微胶囊呈先增加后减少的整体趋势[1]。在固化时间为120 min时,微胶囊的包埋率最高,包埋率为78%,过长的固化时间会破坏复合壁材形成的网络结构,微胶囊密度发生变化,保加利亚乳杆菌重新泄露到溶液中。在固化时间为90 min时,微胶囊的包埋率为72%,综合试验成本及节能等因素,将90 min作为保加利亚乳杆菌微胶囊的最佳固化时间。
2.3 正交试验结果
以单因素实验中获得的最适条件为基础,进行正交实验,考察海藻酸钠、壳聚糖、氯化钙浓度和固化时间等参数对益生菌微胶囊包埋效果的影响,所得结果如表2所示。
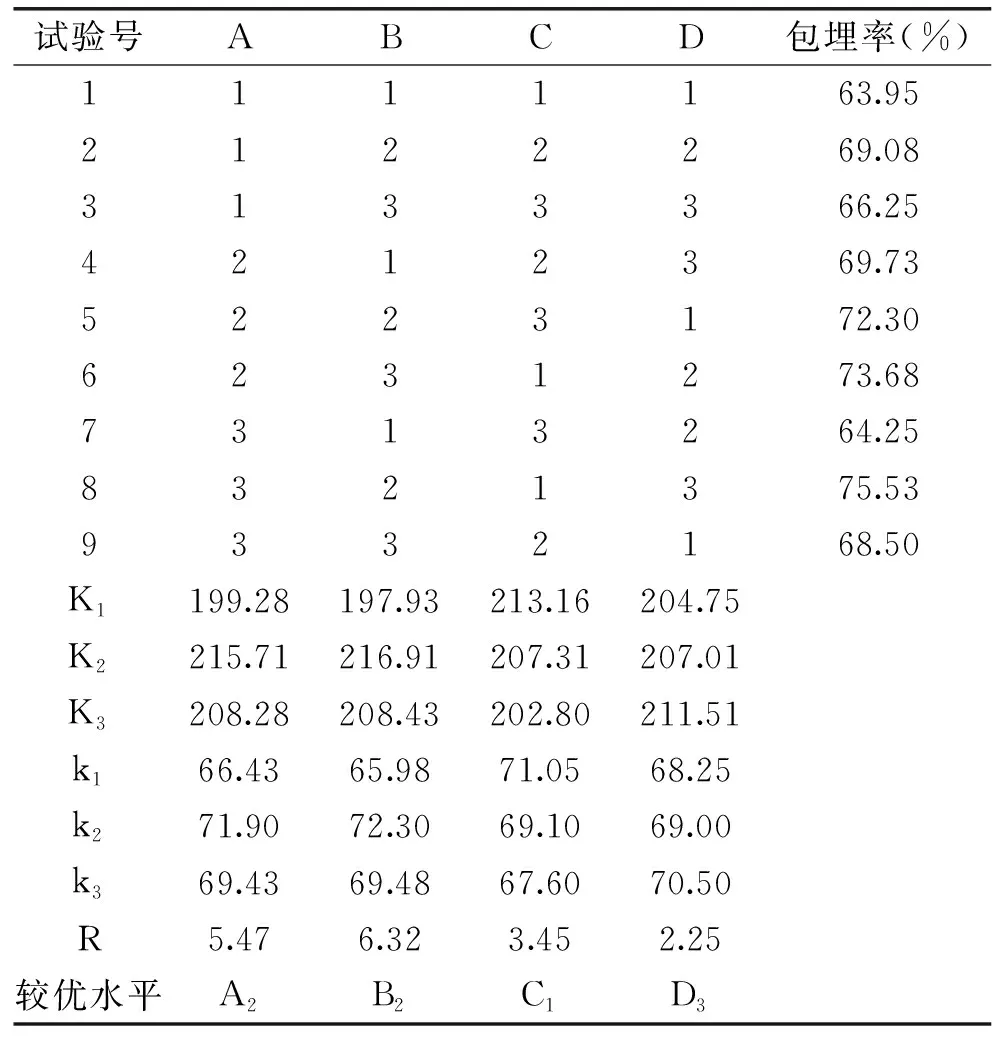
表2 正交试验结果Table 2 Results of orthogonal experiment
经正交试验得出,A2B2C1D3组合的包埋率较高,达到78%,经检验A2B2C1D3的包埋率显著高于其他组。因此,选择A2B2C1D3组合的微胶囊做后续试验。以包埋率为指标,则海藻酸钠浓度为3%,壳聚糖浓度为1.5%,氯化钙浓度为2%,固化时间为120 min,为制备微胶囊的最佳配方。
2.4 方差分析
由于实验所设计的正交表各列均饱和,且因素固化时间的极差和偏差平方和明显偏小,所以选用固化时间的偏差平方和作为误差平方和,固化时间的偏差平方和对应的自由度作为误差平方和的自由度。微胶囊方差分析如表3所示。方差分析结果显示,壳聚糖浓度和海藻酸钠浓度对保加利亚乳杆菌微胶囊包埋率的影响高度显著,氯化钙浓度和固化时间对微胶囊包埋率的影响不显著。
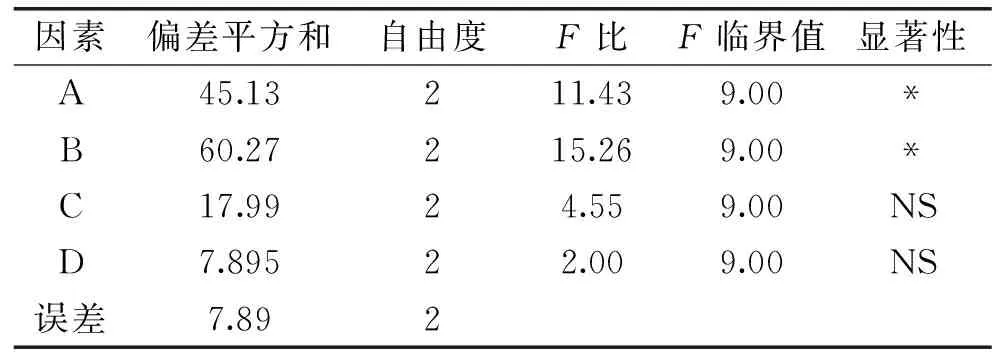
表3 方差分析表 Table 3 Analysis of variance table
2.5 重复性试验
为验证工艺条件的可靠性,进行三次平行实验。三次实验保加利亚乳杆菌的存活率分别为78.9%、79.3%、78.7%,平均值为78.96%,与预测值较为接近,说明试验能较好地反映微胶囊制备过程中的4个因素对于包埋率的影响,从而证明此实验优化后的工艺条件是可靠的。
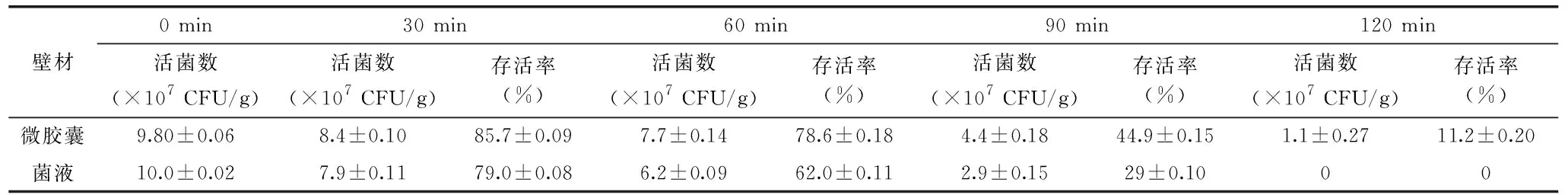
表4 微胶囊在模拟胃液中的存活情况Table 4 Survival of microcapsules in simulated gastric juice
2.6 微胶囊在模拟胃液中的存活率
未经包埋的保加利亚乳杆菌经模拟胃液处理后,活菌数从108CFU/g下降到0 CFU/g,120 min基本全部死亡,这是因为保加利亚乳杆菌对外界环境敏感,耐酸性能很差,胃液中的低酸环境使得未经处理的保加利亚乳杆菌难以存活。相比于未经包埋的保加利亚乳杆菌,复合包埋能够显著地提高益生菌在模拟胃液中的存活率(P<0.05)。经海藻酸钠和壳聚糖包埋的保加利亚乳杆菌在经60 min的人工胃液处理后,活菌数能达到7.7×107CFU/mL,存活率达到78.6%,经过120 min的人工胃液处理后,活菌数能达到1.1×107CFU/mL,存活率达到11.2%。李宁[22]利用海藻酸钠为壁材,对制备的益生菌微胶囊进行人工胃液处理,处理2 h后发现存活率达到12.5%,与本实验结果基本一致。实验表明,保加利亚乳杆菌经包埋后,对低pH的胃液的侵害有一定的抵抗力,耐胃酸效果较好。
2.7 微胶囊在模拟肠液中的释放性
无论是经包埋的益生菌微胶囊还是未包埋的菌悬液,在30~150 min时,差异较显著(P<0.05)。随着微胶囊在人工肠液处理的时间延长,保加利亚乳杆菌微胶囊会连续的释放,其在人工肠液处理中处理60 min之后,活菌数达到9 log CFU/g左右,与Meng等[25]的研究结果相一致,微胶囊在肠液中,由于阴离子的作用,微胶囊明显膨胀,最终导致体系破裂,表明本研究的微胶囊肠液溶性较好;60 min之后,保加利亚乳杆菌就会被连续的释放出来,它为微胶囊的益生作用奠定了基础。
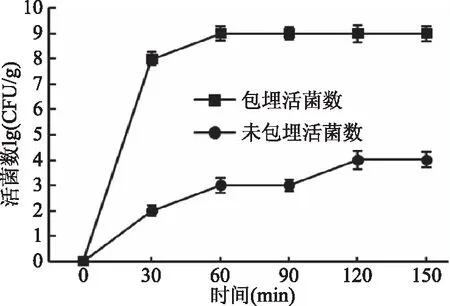
图7 微胶囊在模拟肠液中的释放情况Fig.7 Release of microcapsules in simulated intestinal fluid
2.8 微胶囊在食品中的储藏稳定性
将保加利亚乳杆菌微胶囊与纯牛奶按照1∶9的比例混合均匀,并将未包埋的保加利亚乳杆菌菌悬液作为对照,置于4 ℃条件下进行贮存,在相应的时间段对其进行活菌数测定,结果如图8所示。随着贮存时间的延长,无论是经包埋的益生菌微胶囊还是未包埋的菌悬液,活菌数都随着贮存天数的延长而呈现下降的趋势,而未包埋的菌悬液下降更快,存活率降低;而经包埋的益生菌菌体存活率较高,存活率下降不明显,这是因为微胶囊在低温条件下,包埋后菌体外有一层聚合物壁材作为物理屏障[26],益生菌环境会相对隔离外部不良环境,加强菌体的抵抗能力,储藏21 d后活菌数依然可达到6.5 log CFU/g,说明益生菌微胶囊的贮存稳定性较好。
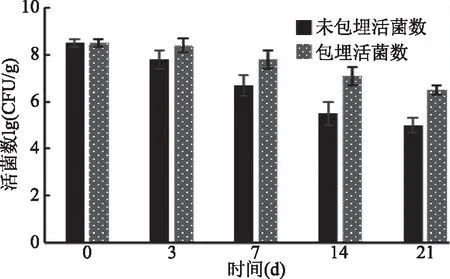
图8 4 ℃条件下在纯牛奶中的活菌数变化Fig.8 Changes of living bacteria in pure milk at 4 ℃
3 结论与讨论
本研究通过包埋保加利亚乳杆菌,确定制备保加利亚乳杆菌微胶囊最佳条件为:海藻酸钠浓度为3%,壳聚糖浓度为1.5%,氯化钙浓度为2%,固化时间120 min,该微胶囊的包埋率最大为78.96%。微胶囊在pH2.0胃液酸性条件下60 min后活菌数为7.7×107CFU/mL,存活率达到78.6%,120 min后仍有菌体存活,相比于未经包埋的保加利亚乳杆菌,微胶囊技术显著的提高了保加利亚乳杆菌在模拟胃液中的存活率(P<0.05)。经包埋的益生菌要起到较好的有益健康功能,就必须使益生菌微胶囊在肠道部位得到充分的破裂,使大量的益生菌被释放进而定殖在肠道粘膜上[27]。因此所制备的益生菌微胶囊要有很好的肠溶性[28]。在模拟肠液中60 min可完全释放,壁材具良好肠溶性。在4 ℃冷藏条件下储存21 d后,微胶囊活菌数由8.5 log CFU/g下降到6.5 log CFU/g,仅下降2个数量级,储藏期稳定性较好。本研究只探讨了保加利亚乳杆菌微胶囊在4 ℃条件下的储藏稳定性,可以在以后的研究中将其加入到不同食品中,考察它们在不同食品中的储藏稳定性。本研究制备的保加利亚乳杆菌微胶囊能够有效地保护菌体抵御外界不利因素,提高实际菌体存活率,同时也提供了一种新型有效的补充肠道益生菌的形式,提升了保加利亚乳杆菌的应用价值。国内在对微胶囊制备工艺进行研究的过程中,并没有将固化时间作为一个重要因素进行专门考察,而本实验则考察了不同固化时间对于微胶囊中保加利亚乳杆菌活菌数的影响,发现固化时间为120 min,可使包埋的活菌数达到最大值。
可以利用诱变或基因工程方法筛选出高抗性的菌株,在热、有氧等环境中去提高保加利亚乳杆菌的活性,本研究制备的保加利亚乳杆菌复合微胶囊形态和产率较好,但仅限体外,进一步拓展益生菌微胶囊的应用范围,如进行动物试验,药理学及毒理学试验等,为益生菌微胶囊在食品工业中的应用奠定基础。

