荞麦蜂花粉多糖的分离纯化及结构鉴定
李 娟,钟平娟,万仁口,邓泽元,范亚苇
(南昌大学食品科学与技术国家重点实验室,江西南昌 330047)
荞麦(FagopyrumesculentumMoench)是蓼科荞麦属一年生草本植物,在中国大部分地区均广泛种植,已有2000多年的栽培历史,年均产量约为60~70万吨[1]。荞麦蜂花粉是荞麦的主要农副产品之一,是蜂蜜从荞麦的花药中采集花粉粒并混合自身唾液、花蜜等腺体分泌物,经过储存和发酵后形成的花粉团[2]。蜂花粉中含有多种营养成分和生物活性物质,被称为“浓缩的天然营养库”[3]。丰富的荞麦资源也使荞麦蜂花粉同样具有稳定高产量,荞麦蜂花粉的开发利用前景是十分广阔。
荞麦蜂花粉含有丰富的碳水化合物,约占干重63.9%[4],主要为可溶性糖和多糖。多糖是一类由糖苷键连接而成、结构复杂的生物活性物质,具有抗氧化、抗肿瘤[5]、抗辐射[6]、降血脂[7]、降血糖[8]、提高免疫力[9]等生理功能。蜂花粉多糖因其花粉品种、产地及采收时间等因素的不同使得多糖在组成、结构及活性功能等方面存在差异性[10]。目前对于蜂花粉多糖的研究主要集中在油菜、红花及山楂等蜂花粉品种上,对上述蜂花粉多糖结构及功能方面的研究已有报道[11-14]。目前对荞麦蜂花粉多糖的研究主要集中在多糖提取和功能活性上,对其多糖结构组成的深入研究甚少。以往研究者[15]从荞麦蜂花粉中提取分离得到三种多糖组分,仅对多糖分子量及单糖组成进行测定,采用凝胶柱层析法测定多糖分子量,峰形宽且乱,对多糖的结构分析还不够深入。
本研究以荞麦蜂花粉为原料,从中提取粗多糖并对其进行分离纯化。通过高效液相色谱、气相色谱,紫外光谱及红外光谱等技术对荞麦蜂花粉多糖组分结构进行进一步的分析鉴定。以期为今后荞麦蜂花粉多糖的深入研究和荞麦蜂花粉资源的综合利用提供理论基础。
1 材料与方法
1.1 材料与仪器
荞麦蜂花粉 购自山西蜂农;考马斯亮蓝G-250 生兴生物技术有限公司;DEAE-Cellulose52 索莱宝生化科技有限公司;葡聚糖系列标准品(分子量分别为4320、12600、73800、496000、990000、3750000)、间羟基联苯、半乳糖醛酸、L-甘露糖、L-鼠李糖、D-半乳糖、L-阿拉伯糖、D-葡萄糖等标准品 上海阿拉丁生化科技有限公司;苯酚、硫酸、无水乙醇、三氟乙酸、盐酸羟胺,吡啶、乙酸酐等试剂 均为国产分析纯。
TDL-5-A台式离心机 上海安亭科学仪器厂;Bio-Tek酶标仪 美国伯腾仪器有限公司;L6S型紫外可见分光光度计 上海光谱仪器有限公司;1260高效液相色谱仪、Agilent 6890N气相色谱仪 美国Agilent公司;Nicolet 5700智能型傅里叶变换红外光谱仪 美国热电尼高力公司;JSM 6701F场发射扫描电镜带能谱仪 日本电子仪器有限公司。
1.2 实验方法
1.2.1 蜂花粉表观形态观察 采用超微粉碎机对荞麦蜂花粉进行破壁处理,粉碎功率为850 W,电机转速为25000 r/min,破壁后过60目筛备用,通过扫描电镜观察以分析蜂花粉破壁前后情况。取少量破壁前后的荞麦蜂花粉均匀的平铺于扫描电镜的载物台上,离子溅射仪镀金1 min后,采用场发射扫描电镜带能谱仪对荞麦蜂花粉表观形态进行观察并拍照。
1.2.2 多糖的提取 称取适量破碎完全的荞麦蜂花粉于锥形瓶中,按料液比1∶4 g/mL加入90%的乙醇溶液,置于50 ℃水浴下回流脱脂1 h。脱脂后加入10倍量的去离子水浸泡12 h,而后置于85 ℃恒温水浴下,震荡浸提4 h,离心(4500 r/min,10 min)取上清液,取离心后沉淀重复浸提操作三次。合并提取液,减压浓缩至300 mL入4倍体积的无水乙醇,醇沉24 h后离心取沉淀,经真空冷冻干燥后即得荞麦蜂花粉粗多糖[16]。
得率计算:
1.2.3 多糖分离纯化
1.2.3.1 Sevag法除粗多糖蛋白 称取适量荞麦蜂花粉粗多糖于锥形瓶中,按料液比1∶20 g/mL加入蒸馏水,多糖充分溶解后加入2%的木瓜蛋白酶。在50 ℃下恒温震荡水浴酶解1 h,随后置于90 ℃水浴里灭酶活10 min,5000 r/min下离心10 min,取上清液。采用Sevag法除蛋白[17],重复多次。醇沉后离心取沉淀,冷冻干燥后即得荞麦蜂花粉多糖,命名为WFPP。
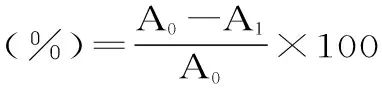

式中:A0为样品除蛋白前样品蛋白含量;A1为样品除蛋白后蛋白含量;B1为样品除蛋白前样品中多糖含量;B2为样品除蛋白后样品中多糖含量。
1.2.3.2 纯化前后多糖基本成分测定 对荞麦蜂花粉多糖中总糖、可溶性蛋白及糖醛酸含量进行分析测定。采用苯酚-硫酸法[18]测总糖含量,以葡萄糖为标准品,得标准曲线为y=8.6743x+0.0366,R2=0.9997;考马斯亮蓝法[19]测可溶性蛋白含量以牛血清蛋白为标准品,得标准曲线为y=3.225x+0.0299,R2=0.9993;间羟基联苯法[20]测糖醛酸含量,以半乳糖醛酸为标准品,得标准曲线为 y=5.006x-0.0054,R2=0.9996。
1.2.3.3 DEAE-52柱层析分离纯化 称取100 mg除蛋白后的多糖样品溶于10 mL蒸馏水中,充分溶解后经DEAE-52纤维素层析,分别用蒸馏水、0.2、0.4 moL/L氯化钠溶液依次进行梯度洗脱,洗脱流速设置为2 mL/min,每管收集5 min,每个梯度分别收集20管。收集各梯度洗脱液,每管均采用苯酚-硫酸法逐一检测,以吸光度值为纵坐标,管数为横坐标绘制洗脱曲线。合并同一洗脱峰,减压浓缩后透析除去盐离子、色素等小分子物质,冷冻干燥即得精制样品。
1.2.4 WFPP荞麦蜂花粉多糖各级分结构鉴定
1.2.4.1 多糖分子量测定 采用HPLC-RID法[21]测定蜂花粉多糖分子量:精确称取4 mg多糖样品溶于超纯水中,配制为2 mg/mL的多糖溶液。色谱条件:Agilent HPLC 1260,RID检测器,TSK gel G5000 PWXL(7.8 mm×300 mm),进样量为10 μL,流动相为超纯水,流速设置为0.5 mL/min,柱温为30 ℃。用上述方法测定葡聚糖系列(Mw分别为4.32×103、1.26×104、7.38×104、4.96×105、9.90×105、3.75×106Da)保留时间,以标准品相对分子质量对数值lgMw为纵坐标,保留时间t为横坐标,绘制标准曲线。通过标准曲线计算多糖样品的分子量。
1.2.4.2 单糖组成测定 采用文献[22]方法并作适量改进测定荞麦蜂花粉多糖的单糖组成。
多糖水解:称取5 mg蜂花粉多糖样品于安瓿瓶中,加入2 mL 2 mol/L三氟乙酸溶解后,充入氮气封管,置于110 ℃烘箱中水解反应 4 h,取上清液,加入少量甲醇,氮气吹干,重复多次使三氟乙酸完全除去。
糖腈乙酸酯衍生处理:蜂花粉多糖水解样品中加入10 mg盐酸羟胺,0.5 mL吡啶。在90 ℃水浴摇床中震荡30 min后再加入0.5 mL乙酸酐,90 ℃水浴30 min,反应产物即为糖腈乙酸酯衍生物。过0.22 μm有机滤膜,上气相色谱进行分析。
GC条件:Agilent HP-5毛细管柱(30 m×0.25 mm,0.25 μm),FID检测器,检测器温度及进样口温度分别为250、280 ℃,柱温220 ℃;进样量1 μL、分流比为20∶1、流速为1 mL/min,载气为氮气。程序升温:初始温度为160 ℃、保持2 min,20 ℃/min升温至200 ℃,保持3 min。
1.2.4.3 紫外光谱(UV)分析 将各荞麦蜂花粉多糖组分配置为1 mg/mL的溶液,在180~400 nm范围内进行紫外光谱扫描,得扫描曲线。
1.2.4.4 红外光谱(IR)分析 称取2 mg多糖样品,加入适量干燥的KBr研磨制成均匀透明压片,在4000~400 cm-1范围内用傅里叶红外光谱仪扫描分析。
1.3 数据处理
试验数据采用Excel软件整理,SPSS 16.0统计软件进行数据分析,每个试验处理设置三个平行,结果以均值±标准差表示,进行单因素方差分析,不同试验处理间的显著性检验采用Duncan式多重比较。
2 结果与分析
2.1 蜂花粉扫描电镜分析
荞麦蜂花粉呈扁圆形团粒,其细胞壁具有高阻抗性,一般酸碱等物质较难破坏。花粉含有的营养物质一般都包覆在花粉壁中,提取其营养成分时花粉壁会阻止其释放,影响提取效率[23]。所以对蜂花粉多糖的提取,需先破坏其细胞壁,使其内容物充分释放,有利于多糖的提取。
因此,采用超微粉碎技术对蜂花粉进行破壁,破壁效果如图1所示。图1a是未经处理的蜂花粉电镜图,蜂花粉为完整的细胞群且形体较大胞壁类椭圆形,单个花粉形状多为长球形,具有多条萌发孔,表面有较为密集的粗网状纹理,网眼随机排布呈不规则状[24]。图1b是经过超微粉碎处理后的蜂花粉,花粉细胞形态基本被全部破坏,花粉团呈无规则状,可看出花粉外壁较薄,花粉壁完全裂开并被分解为数块碎片,胞内物质几乎全部溢出,表明超微粉碎能充分破坏蜂花粉细胞壁,利于下一步蜂花粉多糖的提取。

图1 未破壁与破壁蜂花粉扫描电镜图Fig.1 SEM graphs of bee pollen before and after wall-broken
2.2 荞麦蜂花粉多糖分离纯化
2.2.1 荞麦蜂花粉多糖的基本组分 荞麦蜂花粉经过水提醇沉、冷冻干燥后得到荞麦蜂花粉粗多糖,提取率为8.26%。脱蛋白前后蜂花粉多糖中总糖、蛋白质及糖醛酸含量见表1,除蛋白前荞麦蜂花粉多糖总糖含量为46.12%、糖醛酸含量为7.40%、可溶性蛋白含量为8.09%。除蛋白后多糖中总糖、糖醛酸含量显著升高,可溶性蛋白含量显著降低。多糖损失率及蛋白清除率分别为26.46%、90.77%,蛋白脱除率较高的同时多糖损失量较少,除蛋白效果较好。碘-碘化钾反应溶液不变蓝,说明多糖不含有淀粉。

表1 脱蛋白前后多糖中总糖、糖醛酸及蛋白质含量(%)Table 1 Total sugar,glucuronic acid and protein content in polysaccharide before and after deproteinization(%)
2.2.2 DEAE阴离子交换柱层析 WFPP经DEAE-52阴离子柱层析纯化,苯酚-硫酸法跟踪检测,根据吸光度和洗脱管数绘制洗脱曲线,结果如图2所示,荞麦蜂花粉多糖WFPP柱层析分离主要得到三个洗脱峰,分别命名为WFPP-N、WFPP-1、WFPP-2。由图2可知,采用蒸馏水、0.2 mol/L氯化钠洗脱液得到洗脱峰较大,三个洗脱峰对称性都较好。

图2 WFPP DEAE-纤维素柱层析上洗脱曲线Fig.2 Chromatogram of WFPP on WFPP-cellulose column
收集三个洗脱峰,经透析、浓缩、冻干后三个多糖组分的得率及糖含量如表2所示,其中中性多糖组分WFPP-N为灰白色组分,得率为12.73%,总糖含量最高达94.87%,纯度较高。酸性多糖组分WFPP-1的得率最高为23.58%,而WFPP-2得率仅为10.41%,总糖含量较低而糖醛酸含量较高,这两种酸性多糖组分冻干后均为淡黄色粉末。

表2 多糖的得率及糖含量Table 2 The yield and sugar content of polysaccharides
2.3 多糖的结构鉴定
2.3.1 分子量测定 以葡聚糖系列标准品lgMw为纵坐标,葡聚糖标品HPLC图谱如图3,不同分子量的葡聚糖标准品保留时间(min)为横坐标绘制标准曲线,如图4,得标准曲线为lgMw=-0.3787x+11.77,R2=0.9969。

图3 葡聚糖标品分子量测定HPLC图谱Fig.3 HPLC chromatograms of criterion ofglucose for weight determination注:A~F依次表示葡聚糖分子量4320、12600、73800、496000、990000、3750000 Da。

图4 葡聚糖标准曲线Fig.4 The standard curve of glucan
图5为三种荞麦蜂花粉多糖组分的高效液相色谱图,由图5可知,WFPP-N、WFPP-1 为单一的洗脱峰且对称较好,纯度较高,分子量分布较为均一,保留时间分别为 19.743、20.417 min,带入回归方程,可得到WFPP-N、WFPP-1分子量分别为1.96×104、2.24×104Da。WFPP-2则出现两个峰形,含有两个多糖组分,保留时间为 19.514和21.431 min,分子量计算为2.40×104、4.38×103Da。

图5 多糖的分子量测定HPLC图谱Fig.5 HPLC chromatograms ofpolysaccharides for weight determination
2.3.2 单糖组成测定 采用气相色谱法对WFPP-N、WFPP-1及WFPP-2单糖组成进行分析,各单糖标准品和样品单糖组成色谱图的出峰顺序及保留时间见图6和图7,采用与标准单糖色谱图保留时间对照的方法分析荞麦蜂花粉多糖的单糖组成。

图6 混合标准单糖的气相色谱图Fig.6 GC chromatogram of mixed standard monosaccharides
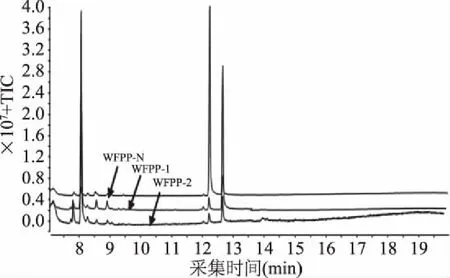
图7 WFPP各级分的气相色谱图Fig.7 GC chromatogram of WFPP polysaccharide components
由表3可知,荞麦蜂花粉中性多糖WFPP-N 则主要由葡萄糖、半乳糖组成,其中葡萄糖含量高达80.70%,其次还含有一定量的半乳糖、阿拉伯糖及少量的木糖,其各单糖物质的量比为Rha∶Ara∶Xyl∶Man∶Glc∶Gal=1.15∶2.95∶0.93∶2.53∶80.7∶8.18。荞麦蜂花粉酸性多糖WFPP-1主要由阿拉伯糖(45.30%)、半乳糖(36.80%)组成,其葡萄糖含量明显低于中性多糖WFPP-N,仅为3.20%,各单糖组成为Rha∶Ara∶Xyl∶Man∶Glc∶Gal=2.73∶45.30∶1.74∶0.70∶3.20∶36.80。WFPP-2则主要由阿拉伯糖(70.12%),半乳糖(11.27%),鼠李糖(8.19%)组成,并含有少量的木糖、甘露糖,各单糖组成百分含量比为Rha∶Ara∶Xyl∶Man∶Glc∶Gal=8.19∶70.12∶1.72∶1.02∶4.17∶11.27。

表3 单糖组成及含量Table 3 Monosaccharide composition and content of polysaccharide
有研究者[25]发现分离得到的三种荞麦蜂花粉多糖中同样含有Rha、Ara、Xyl、Man Glc、Gal,因检测方法不同还检测到含有糖醛酸GalA、GlcA,但均不含有Xyl。同时发现五味子和油菜蜂花粉多糖其单糖组成也为Rha、Ara、Xyl、Man、Glc、Gal,其百分含量比与本研究有所不同。造成上述多糖的单糖组成种类及比例不同的原因可能与花粉种类、来源、采收产地及采收季节不同等因素有关[26]。
2.3.3 紫外光谱扫描 图8表示荞麦蜂花粉多糖的紫外光谱图,未经纯化的粗多糖在260~280 nm处有较强吸收峰,说明其含有较多蛋白质、核酸等杂质。粗多糖经过除蛋白,柱层析后主要得到的三种组分WFPP-N、WFPP-1、WFPP-2,在260~280 nm处无明显吸收峰,表明多糖中基本不含有蛋白质、核酸等杂质[27]。

图8 多糖的紫外光谱图Fig.8 UV spectrum of polysaccharides
2.3.4 红外光谱扫描 三种荞麦蜂花粉多糖组分WFPP-N、WFPP-1、WFPP-2的红外光谱如图9所示。三种多糖组分均具有明显的多糖特征吸收峰。3500~3000 cm-1(3416、3420、3418 cm-1)的吸收峰是由O-H的伸缩振动引起的,峰形较宽而大,表明存在分子间和分子内氢键[28];3000~2800 cm-1的吸收峰(2930、2929 cm-1)是C-H的伸缩振动,1380 cm-1左右的吸收峰(1383、1384、1382 cm-1)则为C-H的变角振[29];1630 cm-1左右(1626、1621、1603 cm-1)的一组吸收峰是由C=O的伸缩振动引起了的,表明三种多糖组分中都存在羧基基团[30];1020~1100 cm-1出现吸收峰(1153、1077、1081 cm-1)是C-O的伸缩振动峰,说明多糖中含有吡喃糖环。三种多糖组分在900 cm-1左右处(876、896、881 cm-1)均出现小峰,推测是由次甲基的横向振动引起的,说明其中含有β-型糖苷键[31];经分析对比,600 cm-1处附近(723、607、579 cm-1)出现的吸收峰为鼠李糖的特征吸收峰[32],说明三种多糖中都含有鼠李糖。

图9 多糖的红外光谱图Fig.9 IR spectra of polysaccharides
3 结论
本研究通过水提醇沉法从荞麦蜂花粉中提取粗多糖,经分离纯化得到三个多糖组分即WFPP-N、WFPP-1和WFPP-2,通过紫外光谱分析发现三个多糖组分均不含有蛋白质、核酸等杂质。三种多糖均主要由Rha、Ara、Xyl、Glc、Gal、Man六种单糖组成,中性多糖WFPP-N主要由Glc、Gal组成,酸性多糖WFPP-1、WFPP-2则主要Ara、Gal组成,WFPP-2中还含有较多的Rha。WFPP-N、WFPP-1分子量均一,分别为1.96×104、2.24×104Da,WFPP-2中含有两种分子量的多糖,分别为2.40×104、4.38×103Da,李珊珊[25]对分离得到三种荞麦蜂花粉多糖组分进行分析鉴定,发现WFPP-N主要由Glc、Gal及Ara组成,WFPP-1则主要由Ara、Gal构成,WFPP-2的主要单糖为Ara、Gal、Rha。除此之外还检测到三种多糖还含有少量的糖醛酸,但均不含有Xyl。丛大利[15]对三种多糖组分的分子量进行测定,发现WFPP-N分子量大约集中在2.0×104Da且状态不均一。WFPP-1主要含有两种分子量多糖9.4×105,4.4×104Da。WFPP-2分子量则主要分布于5.7×105、1.6×104Da,分子量大于本研究WFPP-2测定的两种多糖的分子量。红外光谱分析三种多糖组分均具有多糖特征吸收峰,且含有β-型糖苷键。钱明辉等[33]同样对荞麦蜂花粉进行分离纯化得到三个多糖级分,但其仅对组分A结构进行了进一步的分析,发现多糖A主链是β-构型。本论文对荞麦蜂花粉多糖进行提取、纯化分离及结构分析鉴定,有利于对多糖活性进一步分析,也对开拓荞麦蜂花粉多糖的应用前景和对其产品的工业开发研究奠定理论基础。

