白鲢鱼糜漂洗水蛋白质回收工艺研究
周俊鹏,章 蔚,刘 茹,朱旭萌,熊光权,汪 兰,吴文锦,石 柳,*
(1.湖北省农业科学院农产品加工与核农技术研究所,湖北省农业科技创新中心农产品加工研究分中心,湖北武汉 430064;2.湖北工业大学生物工程与食品学院,湖北武汉 430068;3.华中农业大学食品科技学院,湖北武汉 430070;4.长江大学生命科学学院,湖北荆州 434025)
鱼糜是以鱼类为原料,经采肉、漂洗、斩拌、擂溃等工序制成,具有高蛋白、低脂肪等特点,常常作为食品加工中的重要原料[1]。在工业化鱼糜生产过程中,为了得到具有色泽白、弹性高的优质鱼糜,加工过程中往往需要多次漂洗,去除有色物质、脂肪和腥味物质等[2]。同时,漂洗处理也会导致约30%水溶性蛋白和少量盐溶性蛋白损失,据统计,生产1吨鱼糜约产生20吨漂洗废水,其中约含有3000 kg水溶性蛋白[3]。漂洗水中蛋白质含量高,化学需氧量高,废水处理费用较高[4];若将其中蛋白质回收,则可节约资源,降低生产成本和废水处理成本。
有关学者进行了鱼糜漂洗废水处理方面的研究,包括物理法、化学法和微生物发酵等方面[5-7]。目前,从废水中回收蛋白质的方法主要有絮凝法、等电点法、膜分离法等。常用的絮凝剂包括无机絮凝剂(无机氯化铁、氯化铝等)和有机絮凝剂(海藻酸钠、壳聚糖等)。吴正奇等[8]报道了三氯化铁、阳离子聚丙烯酰胺、明矾等对淡水鱼糜漂洗水中蛋白质有较好的回收效果,但再利用较困难;邵明栓等[9]、武玉学等[10]和许永安等[11]分别研究了海藻酸钠和壳聚糖对鱼糜漂洗水中蛋白质的回收。相比于无机絮凝剂,天然有机絮凝剂具有安全无害,价格低廉、来源广和易降解等特点[12],且便于回收蛋白质在食品加工中再次利用。等电点法主要是通过调节酸碱至漂洗水的等电点使蛋白质发生沉降再进行回收,如徐律等[13]利用磷酸和乙酸调节鱼糜漂洗液中蛋白质的等电点来回收蛋白质,该法简便有效。膜分离法是以筛分效应为基本原理,依靠压力使溶液中的小分子溶质透过膜,而大分子溶质被截留进行分离的过程膜,但膜分离法成本较高,且操作繁琐[14-16]。
目前关于单因素对蛋白质回收效果的研究较多,但系统研究各因素协同回收鱼糜漂洗水中的蛋白质还鲜有报道。本研究结合不同沉降温度、时间、种类的酸、pH、絮凝剂和添加量等多因素对鱼糜漂洗水进行处理,研究其对蛋白质回收率、上清液透光率和蛋白质的SDS-PAGE影响,为工业鱼糜漂洗水中蛋白质的回收和废水净化提供理论参考,还能有效降低企业鱼糜生产成本,减轻环境污染。
1 材料与方法
1.1 材料与仪器
20条约2000 g(540 mm×100 mm)鲜活白鲢(Silver Carp)购于 湖北省武汉市白沙洲水产品批发市场;Coomassie Brilliant Blue G250、Coomassie Brilliant BlueAlbuminR-250、Bovine V BIOSHARP;95%乙醇、85%磷酸、氯化钠、乙酸镁、盐酸、冰乙酸、柠檬酸、壳聚糖、海藻酸钠、黄原胶、甲醇、十二烷基硫酸钠 国药集团化学试剂有限公司;过硫酸铵、30%丙烯酰胺Acr-Bis、蛋白上样液、电泳缓冲液、1.5 mol/L Tirs-HCl 武汉科瑞生物技术有限公司;Pre-stained Protein Marker(11~245 kDa) 天根生化科技有限公司(11~245 kDa);0.5 mol/L Tris-HCl 美国Dow Chemical公司;四甲基乙二胺(TEMED) 美国MYM公司。
MG12绞肉机 民发食品包装机械厂;GD系列冷冻干燥机 江阴市新申宝科技有限公司;BCD-575WDBI 冰箱 青岛海尔股份有限公司;JJ-1精密增力电动搅拌器 江苏金坛荣华仪器制造有限公司;722N可见分光光度计 上海仪电分析仪器有限公司;FG2-B便携式pH计 梅特勒-托利多仪器(上海)有限公司;HH-ZK2恒温水浴锅 巩义市予华仪器有限责任公司;DYY-12型电泳仪电源、24DN制胶器、电泳槽、WD-9406型胶片观察灯 北京市六一仪器厂;Universal HoodⅡ凝胶拍照系统 美国Bio-Rad公司;SHA-C恒温振荡器 常州国华电器有限公司。
1.2 实验方法
1.2.1 样品制备 在4 ℃环境中将白鲢敲击致晕,去除鱼鳞、内脏、头部与尾部,流水清洗干净后,切块;将大小适宜鱼块用绞肉机制成鱼肉泥,然后以鱼肉泥和水按1∶3 (m∶V)比例进行鱼糜漂洗,搅拌10 min,静置30 min,倾倒上层浮液,用纱布过滤器,收集漂洗水,以上操作重复2次;待白鲢鱼糜漂洗水收集完成后,搅拌混匀,分装,然后真空冷冻干燥;将干燥后的样品分成多个小包装真空包装,置于恒温干燥器中备用。
1.2.2 漂洗水复原 通过预实验确定复原漂洗水的最佳条件是20 g冻干样品溶于1 L水中,搅拌60 min;称取20 g冻干样品溶解于1 L水溶液中,进行一定温度的控制,并用JJ-1精密增力电动搅拌器搅拌60 min,然后备用。
1.2.3 不同沉降温度和时间的絮凝试验 按照1.2.2方法进行漂洗水的复原,测得蛋白浓度为C0,然后分别在4和30 ℃环境中进行10、30、60、90、120 min进行温度和时间沉降絮凝试验,分别测定上清液蛋白浓度C1和透光率,然后计算蛋白质的回收率,并用沉降絮凝样品进行SDS-PAGE电泳试验,每组试样平行操作3次。
1.2.4 不同种类的酸和pH的絮凝试验 按照1.2.2方法进行漂洗水的复原,测得蛋白浓度为C0,在确定温度和沉降时间后,然后分别用盐酸、乙酸和柠檬酸调节pH至3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5进行不同种类酸和pH沉降絮凝试验,分别测定上清液蛋白浓度C1和透光率,然后计算蛋白质的回收率,并用沉降絮凝样品进行SDS-PAGE电泳试验,每组试样平行操作3次。
1.2.5 不同絮凝剂及其添加量的絮凝试验 按照1.2.2方法进行漂洗水的复原,测得蛋白浓度为C0,在确定温度、沉降时间、酸的种类和pH后,然后分别壳聚糖、海藻酸钠和黄原胶及0、0.2、0.4、0.6、0.6、0.8、1.0 mg/mL进行不同絮凝剂和不同添加量沉降絮凝试验,分别测定上清液蛋白浓度C1和透光率,然后计算蛋白质的回收率,并用沉降絮凝样品进行SDS-PAGE电泳试验,每组试样平行操作3次。
1.2.6 分析方法
1.2.6.1 蛋白质浓度测定 参考国标SN/T 3926-2014[17]方法,取6支25 mL具塞比色管,标准牛血清蛋白100 μg/mL,分别加入0、0.2、0.4、0.6、0.8、1.0 mL标准蛋白,然后各加入5.0 mL考马斯亮蓝G-250试剂,定容至6.0 mL,摇匀,放置5 min后于595 nm波长下比色,以蛋白质含量为横坐标,以吸光度值为纵坐标绘制标准曲线;另取3支25 mL具塞比色管,各加入1 mL样品溶液,5 mL 考马斯亮蓝G-250溶液,充分混合后,放置5 min后于595 nm波长下比色,测定吸光度,通过标准曲线计算样品中蛋白质的含量。
1.2.6.2 蛋白质回收率 经过絮凝试验后,参考许永安等[11]方法,分别测定漂洗水复原液和絮凝试验后其上清液的蛋白质浓度,按照下列公式计算蛋白质的回收率:
式中:C0-漂洗水复原液蛋白质浓度,mg/mL;C1-上清液蛋白质浓度,mg/mL。
1.2.6.3 透光率 经过絮凝试验后,参考许永安等[11]法,用可见分光光度计在600 nm处测定絮凝试验后其上清液透光率,用去离子水作为对照组。
1.2.6.4 SDS-PAGE 经絮凝试验后,参考朱萌等[18]方法,在分别确定酸种类、pH、絮凝剂和添加量的过程中,收集不同条件下絮凝蛋白质和漂洗水制成1 mg/mL电泳样品,然后进行SDS-PAGE电泳试验。先进行制胶,浓缩胶浓度为5%,分离胶浓度为12%,按照表1进行制胶。待胶凝固后,进行上样,其中蛋白标准品上样5 μL,蛋白样品上样7 μL;完成上样后,在电泳槽中加入适量的电泳缓冲液且没过凝胶;连接电源,在浓缩胶阶段,设定电泳80 V,电流50 mA,待进入分离胶后,调节电压至120 V,当蓝色指示线条到凝胶底部边沿时,表明电泳完成;然后将玻璃板上凝胶剥离,在染色液(50%甲醇+10%冰乙酸+0.1%考马斯亮蓝R-250+40%水)中振荡浸泡2 h,然后转移至脱色液(50%甲醇+10%冰乙酸+40%水)中脱色30 min,再用去离子水浸泡凝胶,并每2 h更换1次去离子水,直至凝胶中电泳条带清晰;最后采用Universal Hood Ⅱ凝胶拍照系统进行拍照。

表1 浓缩胶及分离胶配制Table 1 Preparation of concentrated glue and separation gel
1.3 数据处理
采用SPSS 20.0进行差异显著性分析,实验数据用GraphPad Prism5.0作图。
2 结果与分析
2.1 蛋白质标准曲线
蛋白质标准曲线如图1,回归方程y=0.006x+0.0098,R2=0.9991,表明蛋白质质量浓度在0~100 μg/mL范围与吸光度A间线性关系良好,在后续试验中蛋白质浓度的测定中均使用此标准曲线。
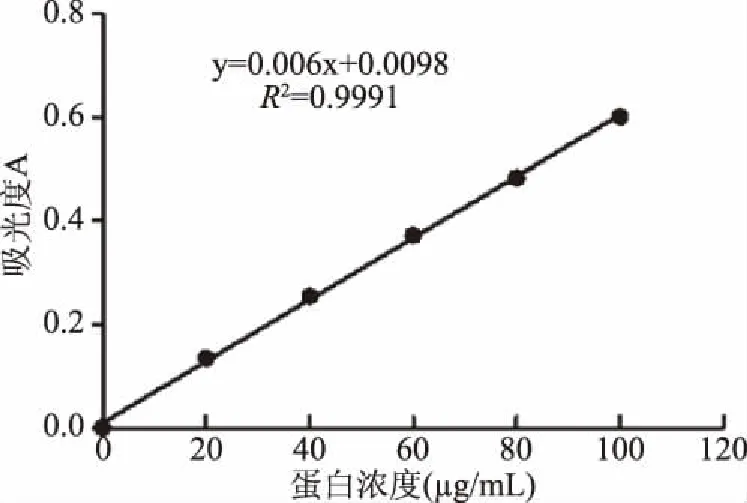
图1 蛋白质标准曲线Fig.1 Protein standard curve
2.2 不同沉降时间和温度对蛋白质回收效果的影响
如图2A和图2B所示,经不同温度和时间沉降絮凝后,鱼糜漂洗水其蛋白质回收率和上清液透光率都存在显著性差异(P<0.05)。在4和30 ℃条件下,漂洗水中蛋白质回收率随着沉降时间延长都呈现先增大后减小,最后趋于平衡的趋势;在前60 min过程中,30 ℃条件下蛋白质的回收率大于4 ℃,60 min后则相反;在30 min时,4和30 ℃环境中漂洗水的蛋白质回收率均达到最大值,分别为25.3%和44.7%,且30 ℃条件下蛋白质回收率大于4 ℃。

图2 不同沉降时间和温度对鱼糜漂洗水蛋白质回收率(A)、透光率(B)和SDS-PAGE(C)的影响Fig.2 Effect of different time and temperature on protein recovery yield(A),light transmittance(B)and SDS-PAGE(C)of surimi rinsing water注:不同小写字母代表不同温度间存在显著差异(P<0.05);不同大写字母代表不同沉降时间间存在显著差异(P<0.05)。
漂洗水经过沉降后,上清液的透光率随沉降时间延长逐渐增大,且30 ℃条件下上清液透光率大于4 ℃。随环境温度升高,漂洗水中蛋白质发生变性,蛋白质在水溶液中稳定性降低,在重力作用下发生沉降。因此,30 ℃环境条件下鱼糜漂洗水的蛋白质回收率和上清液透光率均大于4 ℃,且变化速率较快。这一现象在Bourtoom等[19]和Scopes等[20]研究中得到了证实。在自然沉降条件下,漂洗水上清液的透光率分布范围为1.0%~1.3%,此时上清液仍较为浑浊,表明蛋白质沉降不完全。随沉降时间延长,蛋白质回收率和上清液透光率均逐渐增大,最终趋于稳定。
漂洗水回收蛋白的SDS-PAGE结果如图2C所示。漂洗水中主要含有分子量约为35、42、48、63和100 kDa附近蛋白质,还含有少量分子量为190 kDa的蛋白质。在一定环境条件下沉降后,已有的蛋白条带浓度加深,且在25~28 kDa附近出现了多条新的电泳条带。漂洗水中不同分子量的蛋白质在温度和时间作用下发生富集,这是25~100 kDa分子量蛋白质浓度升高的主要原因。同时190 kDa的电泳条带消失,可能是漂洗水中蛋白质在蛋白水解酶的作用下发生降解[21]。结合环境温度对蛋白质性质的影响和实际生产情况考虑,采用4 ℃条件下沉降60 min来回收鱼糜漂洗水中的蛋白质。
2.3 不同酸和pH对蛋白质回收效果的影响
如图3A和图3B所示,在确定温度和沉降时间后,采用不同种类酸和pH处理后,鱼糜漂洗水蛋白质回收率和透光率存在显著性差异(P<0.05)。采用盐酸、乙酸和柠檬酸调节鱼糜漂洗水至酸性,其蛋白质回收率分别在pH5.5、5.0和5.5处达到最大值,分别是65.8%、25.5%和38.4%。由此可知,本试验中漂洗水的等电点范围为5.0~5.5,与王路[7]的研究较为一致。采用盐酸调节漂洗水pH,其蛋白质回收率始终高于乙酸和柠檬酸,这可能因为不同酸在水溶液中可电离出的氢离子浓度不同,对蛋白质分子所带的负电荷产生不同程度中和,最终使蛋白质产生差异性沉降效果[3,13]。

图3 不同种类酸和pH对鱼糜漂洗水蛋白质回收率(A)、透光率(B)和SDS-PAGE(C)的影响Fig.3 Effect of different acid and pH on protein recovery yield(A),light transmittance(B)and SDS-PAGE(C)of surimi rinsing water注:不同小写字母代表不同种类酸间存在显著差异(P<0.05);不同大写字母代表不同pH间存在显著差异(P<0.05)。
当漂洗水pH低于5.0(盐酸)或4.5(乙酸和柠檬酸)时,上清液透光率约为1%~2%,与图2B相似。当pH继续升高时,盐酸处理组的上清液透光率呈持续上升趋势,乙酸和柠檬酸处理组上清液透光率均在pH5.5处达到最大值,结合蛋白质回收率和透光率可以得出白鲢鱼糜漂洗水等电点在pH5.5附近。
确定温度和时间后,不同酸和pH处理的回收蛋白SDS-PAGE结果如图3C所示,其处理组蛋白质电泳条带较漂洗水条带浓度进一步加深,且pH至5.0~7.0左右时30.0 kDa附近的蛋白质电泳条带缺失,这可能是因为pH到一定时会使30.0 kDa附近蛋白质发生降解[22]。结合酸碱对蛋白质性质的影响,采用盐酸调节pH5.5来回收鱼糜漂洗水中的蛋白质。
2.4 不同絮凝剂和添加量对蛋白质回收效果的影响
如图4A和图4B所示,在确定温度、时间、盐酸调节pH5.5后,鱼糜漂洗水蛋白质回收率和透光率受絮凝剂种类和添加量影响(P<0.05)。随絮凝剂添加量逐渐增大,鱼糜漂洗水的蛋白质回收率呈现不同的变化趋势,其中壳聚糖和黄原胶处理后蛋白质回收率逐渐增大,而海藻酸钠处理后蛋白质回收率先增加,当添加量大于0.6 mg/mL时蛋白质回收率呈减小趋势。经盐酸调节pH5.5处理后,蛋白质回收率进一步升高,这是因为鱼糜漂洗水中残留的蛋白质与絮凝剂之间产生桥连作用、静电相互作用和基团反应而沉降聚集[23-26]。Wenbei等[27]研究表明在酸性溶液中经质子化后壳聚糖会形成带正电荷的分子,其与鱼糜漂洗水中残留蛋白质经静电相互作用发生沉降,同时壳聚糖分子通过离子键、氢键形成中间“桥梁”或某些活性基团反应也会使残留蛋白质发生沉降[28]。而海藻酸钠随着添加量增大后期会出现蛋白质回收率下降,可能因为海藻酸钠添加过量会使已经形成的絮凝状态变成稳定胶体且不能进行有效地络合作用降低絮凝效果,这种现象在刘婷婷等[29]和施亚芳[26]研究中得到了证实。黄原胶具有絮凝效果,这可能是因为在溶液中黄原胶与等电点处蛋白质发生络合,使漂洗水中蛋白质发生沉降[30]。
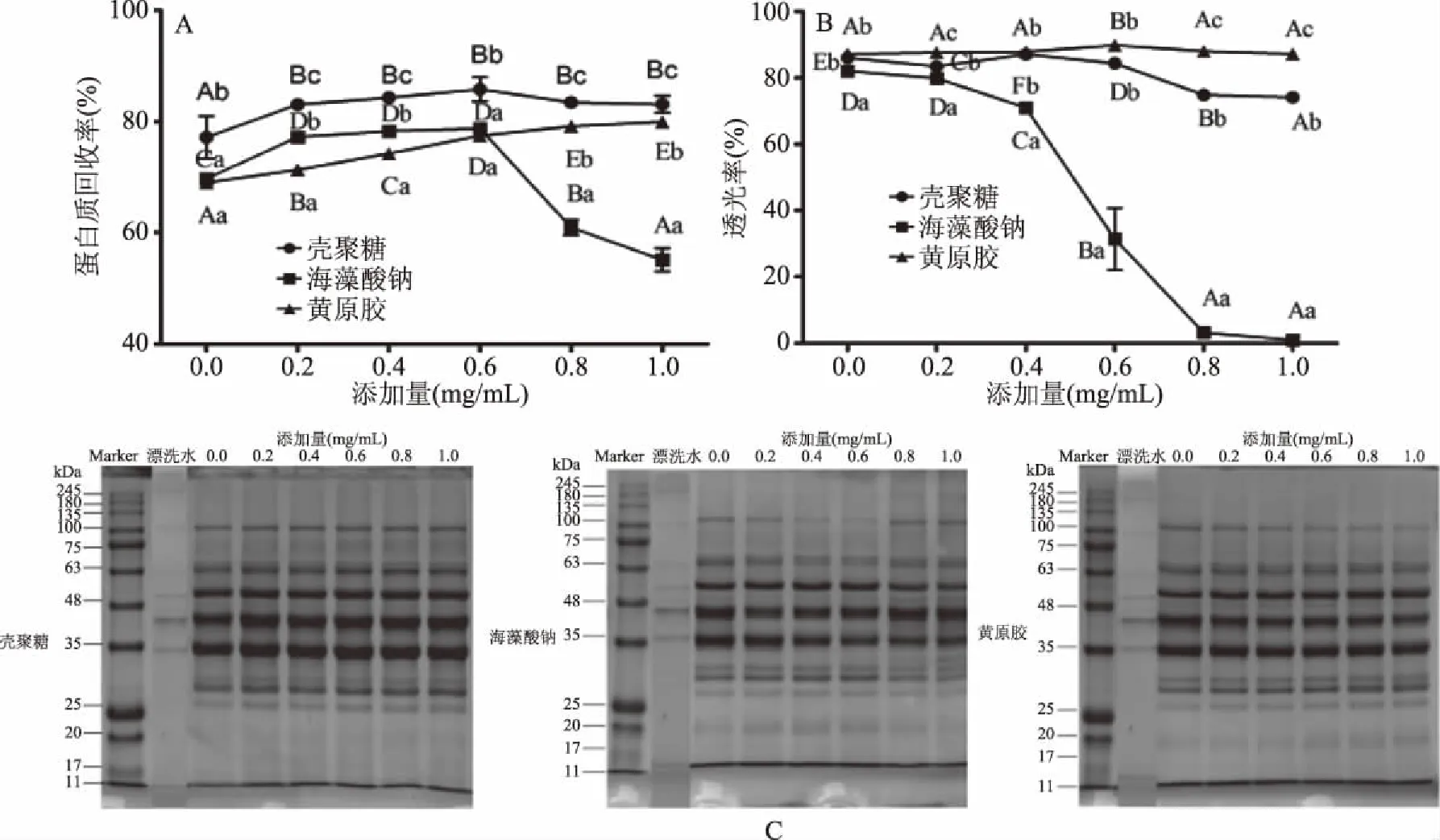
图4 不同絮凝剂和添加量对蛋白质回收率(A)、透光率(B)和SDS-PAGE(C)的影响Fig.4 Effect of different flocculants and additions on protein recovery yield(A),light transmittance(B)and SDS-PAGE(C)of surimi rinsing water注:不同小写字母代表不同种类絮凝剂间存在显著差异(P<0.05);不同大写字母代表不同添加量间存在显著差异(P<0.05)。
漂洗水添加絮凝剂后,上清液透光率差异显著(P<0.05)。随絮凝剂添加量增大,壳聚糖和黄原胶处理组的上清液透光率呈先增大后略有减小趋势,海藻酸钠处理组呈持续减小趋势,与蛋白质回收率变化趋势相似。当絮凝剂添加量低于0.6 mg/mL时,壳聚糖和黄原胶处理组的上清液透光率无显著性差异(P>0.05),当添加量继续增大时,黄原胶处理组的上清液透光率高于壳聚糖组;海藻酸钠处理组的上清液透光率始终最低,这可能是因为海藻酸钠处于酸性环境(pH5.5)时其—COO-转变成—COOH,电离度降低,亲水性降低,使漂洗水上清液透光率降低[31]。通过添加絮凝剂,漂洗水上清液透光率从1.2%继续上升至87.8%。
结合以上温度、时间、pH结果,采用絮凝剂进一步处理回收的蛋白SDS-PAGE结果如图4C所示。经絮凝剂处理后,不同分子量蛋白质的条带浓度继续加深,且壳聚糖处理组蛋白条浓度带明显高于海藻酸钠和黄原胶处理组,表明添加絮凝剂使蛋白回收效果进一步加强,壳聚糖的回收蛋白效果优于其他两种物质,且在20 kDa附近出现新的电泳条带,说明小分子量蛋白质随着回收效果的加强也得到了一定的回收。因此,结合蛋白质回收率、上清液透光率和电泳结果考虑,0.6 mg/mL壳聚糖添加量使蛋白质回收效果最优。
3 结论
本试验通过确定4 ℃沉降60 min、盐酸调节pH5.5、添加0.6 mg/mL壳聚糖等各条件,鱼糜漂洗水的蛋白质回收效果不断提高,蛋白质回收率依次为22.5%、65.8%和85.7%,上清液透光率依次为1.2%、50.1%和87.8%;SDS-PAGE电泳实验也表明,经系列条件处理后不同分子量蛋白质含量也显著提高。在本试验确定的条件下,鱼糜漂洗水中绝大部分的蛋白质都能得到回收,且废水澄清度也得到较好提升,这为工业鱼糜漂洗水中蛋白质的回收和废水净化提供了一定的指导,同时也具有较好的经济效益。

