金银花和蒲公英提取物对肉源性假单胞菌生物被膜的清除作用
王 琳,李宇轩,刘国荣,范 维,李贺楠,高晓月,董雨馨,陈淑敏,*
(1.中国肉类食品综合研究中心,北京食品科学研究院,北京 100068;2.北京工商大学,北京食品营养与人类健康高精尖创新中心,北京市食品添加剂工程技术研究中心,北京 100048)
生物被膜是微生物为了适应生存环境而将自身包被于自体产生的黏液性不均一聚合基质中,形成一种与浮游细胞不同生长方式的群体[1-2]。形成生物被膜的假单胞菌对环境耐受性增强,很难从食品接触面和加工设备表面清除,对食品的贮藏和加工带来一定危害3[-4]。冷却肉中腐败菌种类繁多,其中假单胞菌是优势腐败菌,能够分泌大量胞外多糖形成生物被膜粘附在冷却肉及加工设备表面,且常以生物被膜形式存在[5-6]。
将植物性成分用于控制生物被膜是近年来的研究热点。徐子恒等[7]用白果外种皮多糖GBSP控制金黄色葡萄球菌生物被膜。张洺嘉等[8]通过测定icaA和cidA两个被膜相关基因的表达量证明了黄芩素可以抑制金黄色葡萄球SA26112生物被膜的形成。王金玉等[9]通过测定毒力基因的表达量证明穿心莲内酯在亚抑菌浓度下干预生物被膜的形成。大量研究均证明植物活性成分能够抑制生物被膜,但针对腐败菌生物被膜的研究不足。
金银花和蒲公英是原卫生部批准的具有抑菌性的药食同源食品原料,但对肉源性假单胞菌生物被膜的作用效果及机制尚不明确。鉴于此,分析来源于冷却肉中假单胞菌生物被膜的形成规律,研究不同质量浓度的金银花提取物和蒲公英提取物对假单胞菌生物被膜的抑制及清除作用,旨在更好地控制假单胞菌生物被膜的产生,为冷却肉保鲜提供思路。
1 材料与方法
1.1 材料与仪器
铜绿假单胞菌CICC 10351 中国工业微生物菌种保藏管理中心;恶臭假单胞菌5-3、荧光假单胞菌3-2、铜绿假单胞菌5-1、浅黄假单胞菌8-4等共33株菌株 从市售冷却肉中分离,本实验室保存;胰蛋白胨大豆肉汤(TSB)、LB肉汤、BHI肉汤、营养琼脂 北京陆桥生物有限公司;50%戊二醛溶液、结晶紫、95%乙醇、甲醇、二甲基亚砜 国药集团化学试剂有限公司;24孔细胞培养板、96孔细胞培养板 美国Corning;FITC-conA(Fluoresce inisothiocyanate-conjugated concanavalin A) 美国Sigma公司;蒲公英提取物、金银花提取物、金银花提取物(含98%绿原酸) 南京泽朗生物科技有限公司。
BPC-150F型生化培养箱 上海一恒科学仪器有限公司;MULTISKANGO1510型酶标仪美国Thermo公司;MQD-S2R恒温震荡培养箱 上海旻泉仪器有限公司;TCSSP5激光共聚焦扫描电镜 Leica Co. Germany。
1.2 实验方法
1.2.1 菌株的活化 将冻存的菌种于室温解冻后划线接种于营养琼脂平板,30 ℃下培养24 h,取单菌落经两次12 h活化,用无菌生理盐水稀释至OD600为0.5备用。
1.2.2 生物被膜形成规律研究 测定30 ℃下培养12、24、36、48 h的铜绿假单胞菌CICC 10351生物被膜产量,确定最佳培养时间。将33株假单胞菌在30 ℃按照最佳培养时间,分别利用甲醇、乙醇固定,确定最佳固定方法,并于30和4 ℃下检测33株假单胞菌在最佳培养时间的生物被膜产量。
1.2.3 结晶紫染色法定量检测 33株假单胞菌生物被膜产量参考文献[10-11]的方法测定生物被膜,具体步骤如下:在96孔PVC板中加入195 μL TSB培养基,每孔加入5 μL制备好的OD600为0.5的假单胞菌悬液,每组6个平行孔,以无菌TSB培养基为空白对照。30 ℃静置培养一定时间后,弃培养液,用生理盐水清洗3次去除浮游细菌,按照1.2.2的最佳固定方式固定15 min,每孔加入200 μL 0.1%结晶紫,染色5 min,用生理盐水清洗3次,干燥后,加入200 μL 30%乙酸溶液,于655 nm下测定数值。
1.2.4 植物提取物对假单胞菌生物被膜的影响研究 在恶臭假单胞菌5-3形成生物被膜0 h的96孔板中添加含有质量浓度为0.78、1.56、3.125、6.25、12.5、25、50 g/mL的金银花提取物、蒲公英提取物的TSB培养基,对照组加入等体积不含提取物的TSB培养基,30 ℃培养24 h,于655 nm下测定数值,计算生物被膜抑制率。
参考刘永吉等[12]的方法,将假单胞菌在含有TSB培养基的96孔板中培养24 h,吸出培养基,用生理盐水清洗被膜3次。添加含有质量浓度为0.78、1.56、3.125、6.25、12.5、25、50 g/mL的金银花提取物、蒲公英提取物TSB培养基,对照组加入等体积不含提取物的TSB培养基,30 ℃培养24 h,测定生物被膜,计算清除率。

1.2.5 金银花提取物对假单胞菌生物被膜的作用 将恶臭假单胞菌5-3菌液稀释至OD600为0.5,以0.5%接种于含无菌盖玻片(15 mm)和1 mL TSB培养基的24孔板中,置于30 ℃培养24 h。用PBS清洗孔板3次,添加含有不同质量浓度植物提取物(3.125、6.25、12.5、25、50 mg/mL)TSB培养基,并设置空白对照。将24孔板置于30 ℃培养24 h,将菌液轻轻吸出,用PBS清洗3次,每次3~5 min。加入2.5%戊二醛固定2 h后,再用PBS清洗3次。从玻片边缘吸干水分,在玻片上滴加50 μg/mL的FITC-conA覆盖,置于4 ℃避光染色30 min[13]。用PBS冲洗后制作载玻片,用LeicaTCS SP5激光共聚焦扫描电镜在488 nm激发波长获取图像。
1.2.6 扫描电镜分析金银花提取物(含98%绿原酸)对假单胞菌生物被膜的作用 采用场发射扫描电子显微镜观察植物提取物对生物被膜结构的作用。将恶臭假单胞菌5-3菌液稀释至OD600为0.5,以0.5%接种于含无菌盖玻片(15 mm)和1 mL TSB培养基的24孔板中,置于30 ℃条件下培养24 h。用PBS清洗孔板3次,将不同质量浓度的金银花提取物添加到TSB培养基中,并设置空白对照。将24孔板置于30 ℃培养24 h,将菌液吸出,用PBS清洗3次,每次3~5 min。加入2.5%戊二醛4 ℃固定过夜,再次用PBS清洗3次。依次用50%、70%、80%、90%、95%乙醇脱水各10 min,100%乙醇脱水3次,每次10 min。将制好的样品送中科百测公司检测。
1.3 数据处理
每组样品设有3个重复。采用Microsoft Excel和Origin 7.5进行数据处理和作图。采用SPSS Statistic 18.0(SPSS,USA)对数据进行单因素方差分析及Ducan’s检验(P<0.05)。
2 结果与分析
2.1 假单胞菌生物被膜形成规律研究
96孔微孔板检测生物被膜数值的方法简便,适用性强,但操作较为繁琐,培养时间、固定方式、培养温度对微孔板法测定生物被膜数值影响较大。本研究以铜绿假单胞菌CICC 10351为模式菌,参考邹志慧等[15]的方法,在30 ℃下研究培养时间对生物被膜产量的影响,确定了培养24 h为生物被膜积累最佳时间,如图1所示。

图1 培养时间对铜绿假单胞菌生物被膜形成的影响Fig.1 Effect of incubation time on theformation of Pseudomonas aeruginosa biofilms注:不同小写字母代表差异显著,P<0.05。
图1表明,随着培养时间的延长,生物被膜测定数值显著升高(P<0.05),30 ℃培养24 h,OD655值达到最高;延长培养时间至36 h,生物被膜测定数值显著降低(P<0.05)。这表明铜绿假单胞菌生物被膜在24 h左右是成熟期,24 h后铜绿假单胞菌生物被膜进入衰退期。在生物被膜的生长周期内,其生物被膜测定数值所体现的粘附能力很大程度上取决于所粘附材料的类型。Malegori等[16]对荧光假单胞菌DSM50106生物被膜的生长规律研究表明,在培养第48 h以后,钢材表面和陶瓷表面的生物被膜数值均出现降低趋势。这种现象可能是由于接触壁材表面缺乏营养而导致生物被膜脱离了表面,塑料表面也会出现这种降低趋势,只是未在其实验设定的时间范围内。因此,对于生物被膜的研究不能仅依靠测定数值,还需要结合电镜等方法。
2.2 固定方式对假单胞菌生物测定数值的影响
图2是甲醇固定、乙醇固定对生物被膜测定数值,甲醇固定的测定数值普遍高于乙醇固定的数值,这说明甲醇的固定效率更高。浅黄假单胞菌8-4的乙醇固定数值高于甲醇固定数值,但乙醇固定数值结果差异较大,这可能是由于测定操作过程带来的误差。腐败菌的蛋白水解活性在冷却猪肉腐败过程中发挥重要作用。假单胞菌是冷却肉中常见的产蛋白酶和酰基高丝氨酸内酯(AHLs)的腐败菌,影响冷却肉货架期及食用安全性。AHLs是群体感应信号分子,与水解脂肪或蛋白质、产生生物膜等导致冷却肉腐败相关的生理功能有关[17]。Molin等[18]研究了200个肉样中的嗜冷假单胞菌,莓实假单胞菌和隆德假单胞菌也是主要的腐败菌。相关研究也表明,恶臭假单胞菌在贮藏初期较为常见[19-20]。在冷却肉中分离筛选的假单胞菌中,恶臭假单胞菌数量最多,其产生物被膜能力普遍较强,是冷却肉中最常见的假单胞菌。
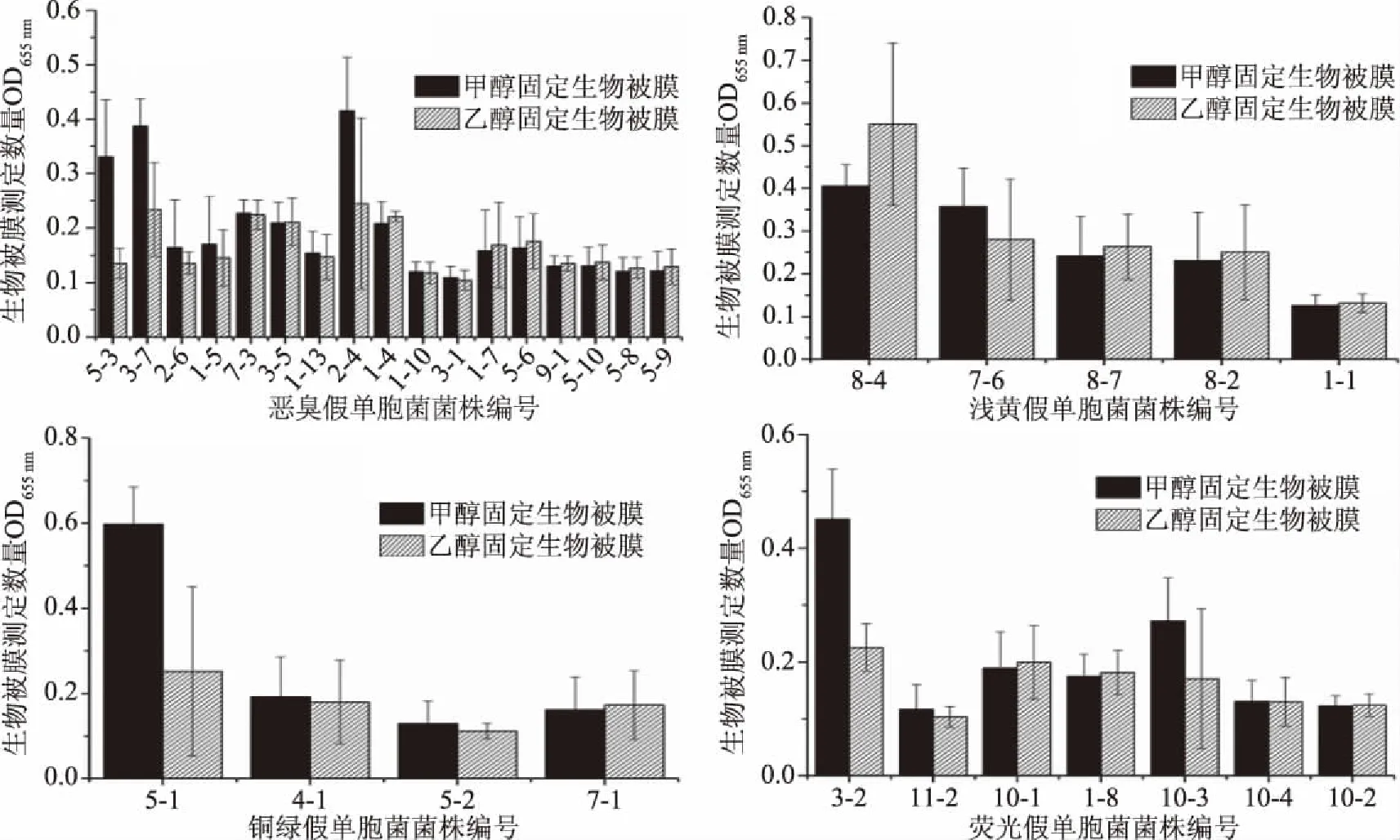
图2 固定方式对假单胞菌生物被膜的影响Fig.2 Effect of immobilized materials on biofilm of Pseudomonas strains
2.3 培养温度对假单胞菌生物被膜的影响
冷却肉中具有生物被膜形成能力的菌株,在4 ℃的模拟储藏环境中均能形成生物被膜。且多数菌株在30 ℃生物被膜形成能力较4 ℃更强。30 ℃下,恶臭假单胞菌中粘附力强的菌株为5-3、3-7、2-4;浅黄假单胞菌中粘附力强的菌株为8-4、7-6;铜绿假单胞菌中粘附力强的菌株为5-1;荧光假单胞菌中粘附力强的菌株为3-2、10-3。除菌株3-2以外,荧光假单胞菌在4 ℃时生物被膜的产量要高于30 ℃。生物被膜是菌株在特殊状态下的自我保护形式,与培养条件和菌株类型均存在相关性[21]。在冷却肉加工、运输、储藏、销售过程中,温度一旦升高,会导致菌体形成生物被膜粘附在冷却肉及加工设备表面,难以去除,影响食用安全性[22-23]。恶臭假单胞菌5-3在30及4 ℃下形成生物被膜能力均较强,因此后续研究中以恶臭假单胞菌5-3为研究对象,进行植物提取物对假单胞菌生物被膜的控制作用研究。
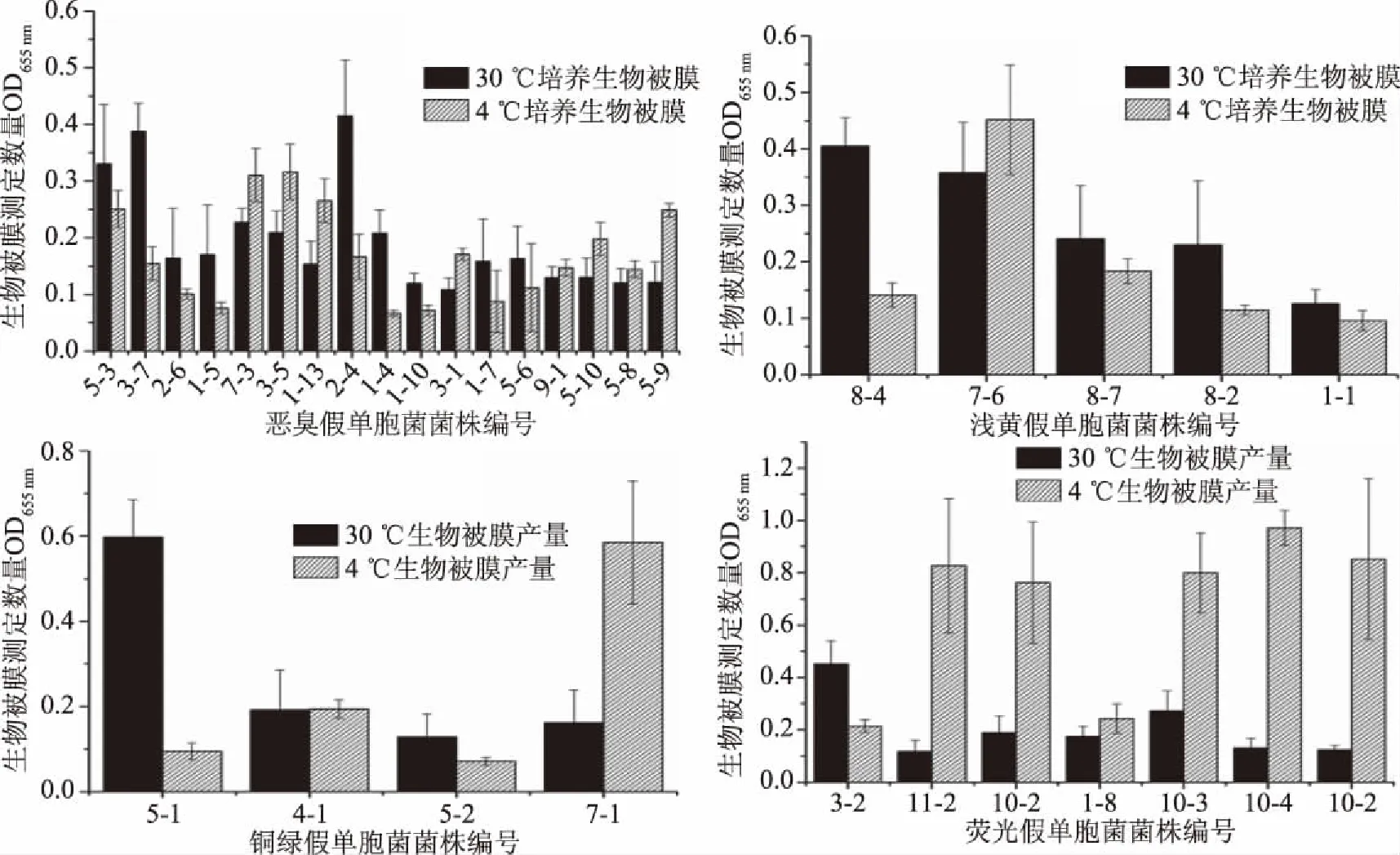
图3 培养温度对假单胞菌生物被膜的影响Fig.3 Effect of incubation temperature on biofilm of Pseudomonas strains
2.4 植物提取物对假单胞菌生物被膜的影响
分别用金银花提取物(图4)和蒲公英提取物(图5)抑制和清除假单胞菌(5-3)生物被膜。金银花提取物和蒲公英提取物均可清除假单胞菌在培养24 h形成的成熟生物被膜(图4B和图5B)。但在生物被膜形成0 h加入植物提取物对生物被膜的作用效果强于24 h加入的效果,这是由于两种提取物抑制菌株生长,因此也就抑制了生物被膜的产生。在25~50 mg/mL条件下,生物被膜的清除率略高于50%。50 mg/mL质量浓度植物提取物的抑制率低于25 mg/mL的抑制率,这可能是由于50 mg/mL植物提取物在微孔板测定体系里是过量添加,培养过程中存在少量析出,导致溶质析出于微孔板表面,与结晶紫结合,导致测量结果增大,需后续结合电镜实验证明这一猜想。在小于25 mg/mL时,清除率呈现明显降低趋势。因此,植物提取物对生物被膜具有清除作用,且对于生物被膜的初始粘附效果更强,对于24 h培养的成熟生物被膜清除效果减弱。
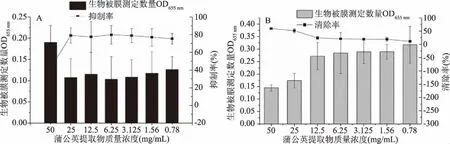
图4 蒲公英提取物对恶臭假单胞菌5-3生物被膜的影响Fig.4 Effect of dandelion root extract on the biofilm of P. putida 5-3注:A:形成生物被膜0 h时加入蒲公英提取物;B:形成生物被膜24 h时加入蒲公英提取物;图5同。

图5 金银花提取物对恶臭假单胞菌5-3生物被膜的影响Fig.5 Effect of honeysuckle extract on the biofilm of P. putida 5-3
2.5 假单胞菌生物被膜的激光共聚焦观察
FITC标记的ConA可与胞外多糖特异结合并发出绿色荧光。FITC-ConA染色生物被膜后,激光共聚焦显微镜下的生物被膜抑制效果见图6。如图6A和图6B所示,在高于最小抑菌浓度25 mg/mL条件下,金银花提取物通过抑制菌体生长而达到清除生物被膜的效果,其胞外多糖和菌体呈散落状分布。图6C和图6D可见荧光信号增强,菌体明显聚集,生物被膜厚度增加,且周围布满孔隙。在图6D中可见少量褶皱,这表明在6.25 mg/mL下,生物被膜已经开始呈立体结构。图6E褶皱、沟壑明显增多,生物被膜立体结构呈堆状连结。图6F为TSB培养基对照,为多层的成熟生物被膜。金银花提取物浓度与其对假单胞菌生物被膜的抑制作用成正相关,在高于最小抑菌浓度下,通过初期抑制菌体生长而抑制菌体形成生物被膜,在低于最小抑菌浓度的条件下,通过抑制生物被膜形成立体结构抑制生物被膜形成。
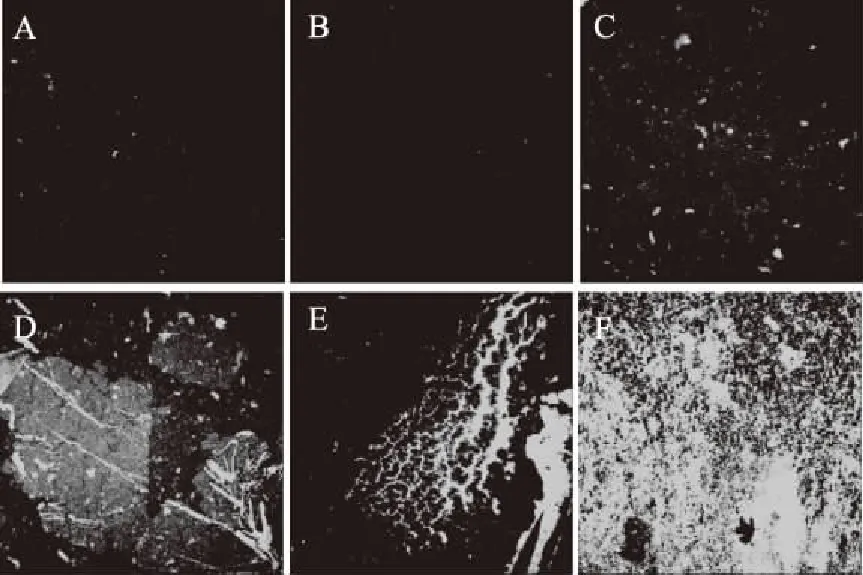
图6 激光共聚焦显微镜下金银花提取物抑制假单胞菌的生物被膜结构图(40×)Fig.6 Confocal laser scanning microscopy(CLSM)images of Pseudomonas biofilm structures underthe inhibition of honeysuckle extract(40×)注:A:50 mg/mL金银花提取物;B:25 mg/mL金银花提取物;C:12.5 mg/mL金银花提取物;D:6.25 mg/mL金银花提取物;E:3.125 mg/mL金银花提取物;F:TSB培养对照组。
激光共聚焦显微镜观察结果对生物被膜的清除效果,见图7。在培养24 h的成熟生物被膜中加入不同浓度金银花提取物,随着提取物浓度的逐渐降低,对生物被膜的清除效果逐渐减弱。随着金银花提取物浓度降低,生物被膜褶皱明显增多,生物被膜立体结构增强。金银花提取物对生物被膜的清除作用是通过破坏生物被膜的立体结构来实现的。
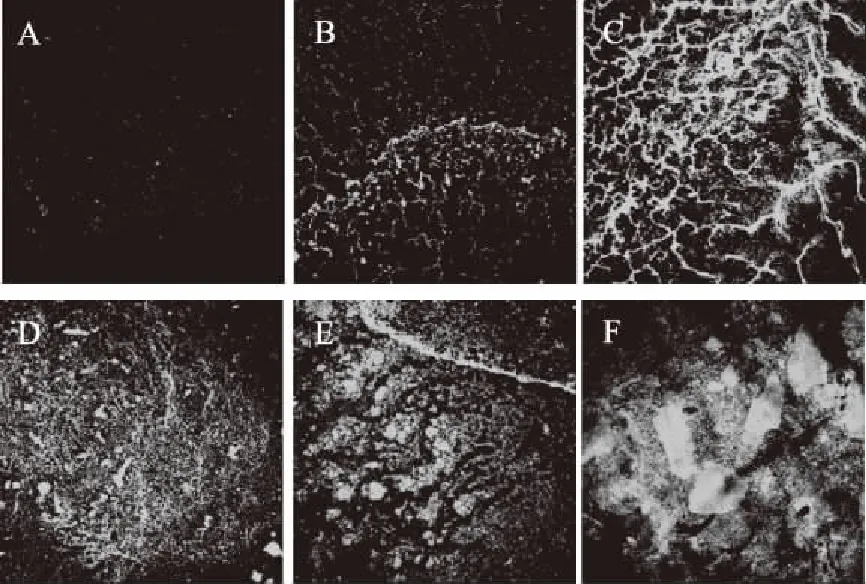
图7 激光共聚焦显微镜下金银花提取物清除假单胞菌的生物被膜结构图(40×)Fig.7 Confocal laser scanning microscopy(CLSM)images of Pseudomonas biofilm structuresunder scavenging effect of honeysuckle extract(40×)注:A:50 mg/mL金银花提取物;B:25 mg/mL金银花提取物;C:12.5 mg/mL金银花提取物;D:6.25 mg/mL金银花提取物;E:3.125 mg/mL金银花提取物;F:TSB培养对照组。
激光共聚焦显微镜可观察生物被膜的整体发展和结构,而SEM可在高倍镜下观察生物被膜的微观结构。由于金银花提取物和蒲公英提取物中主要功效性成分是绿原酸,因此以含98%绿原酸的金银花提取物清除恶臭假单胞菌5-3生物被膜,SEM成像结果如图8所示。生物被膜上的孔洞随提取物浓度的降低越来越少,且变小,图8F对照组没有孔洞。金银花提取物(含98%绿原酸)清除恶臭假单胞菌5-3生物被膜效果明显。推测金银花提取物和蒲公英提取物对假单胞菌生物被膜的清除作用是通过绿原酸发挥作用的。
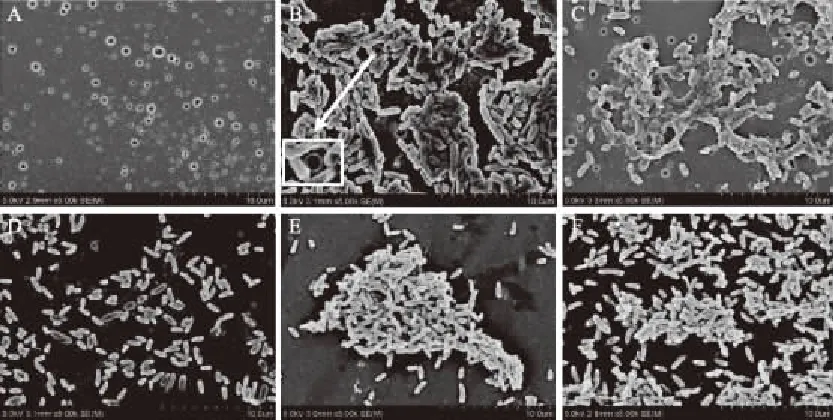
图8 扫描电镜下金银花提取物(含98%绿原酸)清除假单胞菌生物被膜的结构图(5000×)Fig.8 Scanning electron microscopy(SEM)images of Pseudomonas biofilm structuresunder Scavenging effect of honeysuckle extract(5000×)注:A:50 mg/mL金银花提取物(含98%绿原酸);B:25 mg/mL金银花提取物(含98%绿原酸);C:12.5 mg/mL金银花提取物(含98%绿原酸);D:6.25 mg/mL金银花提取物(含98%绿原酸);E:3.125 mg/mL金银花提取物(含98%绿原酸);F:TSB培养对照组。
菌体所产胞外多糖是生物被膜的主要成分,维持生物被膜的结构和功能[24]。绿原酸是由咖啡酸和奎尼酸形成的酯类物质,分子结构中存在不稳定的多元酚基[25]。绿原酸对生物被膜的作用机制可能是通过溶解生物被膜中的多糖组分或弱化生物被膜内不同分子间作用力,使生物被膜出现孔洞,导致粘附能力降低。陈一强[26]也证明,绿原酸可抑制铜绿假单胞菌的多种毒力因子的释放,并降低其对载体的粘附能力。因此推测,金银花提取物中,绿原酸含量是衡量其清除生物被膜功效的重要指标。
3 结论
研究发现,30 ℃培养假单胞菌24 h能形成成熟生物被膜,甲醇固定生物被膜的效果优于乙醇。且30 ℃体外培养条件能够反映4 ℃冷藏条件下假单胞菌生物被膜形成能力。生物被膜测定结果表明,恶臭假单胞菌5-3的生物被膜形成能力较强。利用蒲公英提取物和金银花提取物均能够抑制、并清除其生物被膜。蒲公英提取物和金银花提取物在0.78~50 mg/mL范围内,对恶臭假单胞菌5-3生物被膜的抑制率均高于50%,抑制效果较好。但在25~50 mg/mL范围内清除率仅为50%,且低于12.5 mg/mL时,清除效果微弱。
激光共聚焦扫描电镜和场发射扫描电镜结果表明,金银花提取物(含98%绿原酸)在50 mg/mL主要通过杀菌作用清除生物被膜。随着质量浓度逐渐降低,对生物被膜作用生成形成的孔洞变小、且数量减少。因此,金银花提取物和蒲公英提取物能够抑制并清除假单胞菌生物被膜。本研究证明植物提取物对冷却肉的保鲜具有潜在应用价值,为植物提取物在冷却肉保鲜中的应用提供数据基础。但目前的研究无法解释植物提取物功效性成分对于生物被膜的控制机制,后续应加强植物提取物功效性成分与细菌生物被膜的分子间相互作用基础研究。

