栀子花果胶和苹果果胶包覆丁香酚脂质体的制备及稳定性研究
陈 琦,薛 刚,何 易,张有做,许光治
(浙江农林大学农业与食品科学学院,浙江省农产品品质改良技术研究重点实验室,浙江临安 311300)
丁香酚是丁香精油中的主要成分,具有较好的抑菌和抗氧化活性[1]。但水溶性差、稳定性差和易挥发等缺点限制了其在食品、化妆品等领域的应用[2]。为了延长抑菌时间和提高生物利用度[3-4],目前主要采用微胶囊或纳米乳液技术对丁香酚进行包埋,但是利用明胶、壳聚糖等作为壁材制成的微胶囊包埋率50%左右[4],利用壳聚糖和三聚磷酸钠制成的纳米乳液包埋率仅为10%左右[5],存在包埋率低的问题。
以卵磷脂等两亲性分子为壁材的脂质体对不同极性物质均具有包埋率高、可变形性好等优点。脂质体壁材可溶于乙醇,非常适合醇溶性的化合物的包埋,具有包埋率高、可变形性好等优点[6],已经被广泛地用于包埋茶多酚、姜黄素等不稳定的物质[7-8]。但脂质体也存在壁材易氧化、聚集从而导致包埋的活性物质泄露等问题。亲水性高分子化合物如聚乙二醇[9]、壳聚糖[10-11]等对其进行修饰能增强脂质体双分子层稳定性,延缓脂质体中活性物质释放的作用。
果胶是来源于植物细胞壁富含半乳糖醛酸的酸性多糖,作为胶凝剂、稳定剂或增稠剂广泛应用于食品行业[12]。此外,也有研究将果胶包覆于微胶囊表面,其可以通过氢键、离子键等化学键与脂质体表面基团作用,可提高微胶囊的稳定性,改善被包埋活性物质的缓释效果,甚至靶向性[13-14]。但不同来源的果胶,其分子量、侧链基团、乙酰化度、酯化度、酸性糖含量等有较大差异,对包埋稳定性、缓释性效果会产生很大的影响[15-16]。因此,研究不同来源果胶包覆对脂质体的影响,对脂质体在食品领域的应用有一定的意义。
为此,本论文比较了栀子花果胶和苹果果胶对丁香酚脂质体(eugenol liposome,EP)缓释性能的影响,以期为脂质体包埋丁香酚在食品中的应用及栀子花果胶资源的利用提供参考。
1 材料与方法
1.1 材料与仪器
新鲜栀子花 来源于浙江农林大学平山试验基地的山栀子;苹果果胶 美国Sigma-Aldrich公司(NO93854);葡萄糖(>99%)、葡萄糖醛酸(>99%)、间羟联苯(99%)、卵磷脂(>98%)、丁香酚(99%)和吐温20(分析纯) 均购于阿拉丁试剂(上海)有限公司;无水乙醇、氢氧化钠、氯化钠、氯化钾、十二水合磷酸氢二钠、磷酸二氢钾等其他试剂 分析纯,国药集团化学试剂有限公司。
ZetaPALS电位及粒度分析仪 美国Brookhaven公司;UV-5500紫外可见分光光度计 上海元析仪器有限公司;JY92-Ⅱ超声波细胞粉碎机 宁波新艺超声设备有限公司;TP-350S智能数显磁力加热搅拌器 杭州米欧仪器有限公司;JEM-1400 Plus 120KV高衬度透射电子显微镜 日本电子株式会社(JEOL)。
1.2 实验方法
1.2.1 栀子花果胶的提取 根据Tabarsa等[17]的方法略作修改。将新鲜的栀子花在60 ℃烘箱中干燥24 h,用高速多功能粉碎机磨成粉,过40目筛备用。取干燥的栀子花粉与蒸馏水以1∶40 (W/V)的比例在90 ℃下搅拌2 h。将混合物以5000×g离心20 min,取上清液。整个提取过程重复两次,合并上清液,并通过旋转蒸发仪在60 ℃浓缩至原体积的一半,然后加入3倍体积的无水乙醇沉淀并在4 ℃下静置过夜。通过抽滤分离沉淀物,并用无水乙醇脱水。将得到的栀子花果胶在40 ℃下干燥。
1.2.2 果胶的成分分析 对栀子花果胶和苹果果胶的主要成分进行分析。中性糖含量以D-葡萄糖作为标准品,采用苯酚-硫酸法进行测定[18]。酸性糖含量以半乳糖醛酸为标准品,采用硫酸-间羟联苯法进行测定[19]。蛋白质含量以牛血清蛋白为标准品,采用考马斯亮蓝法进行测定[20]。酯化度采用滴定法进行测定[21]。
1.2.3 EP的制备 根据Jin等的方法略作修改[22]。将100 μL丁香酚溶液(终浓度为0.25%,V/V)和吐温20加入无水乙醇中,于37 ℃,350 r/min下,持续磁力搅拌10 min,然后向上述体系中加入大豆卵磷脂,于37 ℃下保持转速为350 r/min,持续磁力搅拌10 min,再用注射器向上述体系中缓慢匀速地加入一定体积的超纯水,整个操作过程处于密闭状态,于37 ℃下调节转速为1000 r/min,持续磁力搅拌5 min后,立即取出,将溶液倒入圆底离心管中,于冰浴上300 W超声2 min(每持续超声5 s,间隔1 s)后过0.22 μm的有机滤膜,即得EP,封口膜封口放入4 ℃冰箱备用。
1.2.4 单因素实验 采用1.2.3中EP的制备方法。在丁香酚终浓度0.25%(V/V),吐温20终浓度为1.0%(W/V)和乙醇终浓度为20%(V/V)的条件下探究大豆卵磷脂浓度(终浓度为0.25%、0.5%、1%、1.5%和2%,W/V)对EP粒径、多分散系数(Polydispersity,PDI)和包埋率的影响。
在丁香酚终浓度0.25%(V/V),卵磷脂终浓度为1.5%(W/V)和乙醇终浓度为20%(V/V)的条件下探究吐温20浓度(终浓度为0%、0.25%、0.5%、1%和1.5%,W/V)对EP粒径、PDI和包埋率的影响。
在丁香酚终浓度0.25%(V/V),卵磷脂终浓度为1.5%(W/V)和吐温20终浓度为0.5%(W/V)的条件下探究乙醇浓度(终浓度为10%、15%、20%、25%和30%,V/V)对EP粒径、PDI和包埋率的影响。
1.2.5 果胶包覆丁香酚脂质体的制备
1.2.5.1 果胶溶液的制备 称取一定量的苹果果胶和栀子花果胶溶解在超纯水中,在室温下磁力搅拌过夜,分别配制浓度为(0.1%、0.2%、0.4%和0.6%,W/V)的苹果果胶和栀子花果胶,备用。
1.2.5.2 果胶包覆丁香酚脂质体的制备 根据Zhou等[13]的方法略作修改。在单因素实验确定制备EP的最优条件下,将EP按果胶溶液与脂质体溶液体积比1∶1匀速滴入不同浓度的果胶溶液中,于室温下,800 r/min磁力搅拌30 min后于冰浴300 W超声45 s,过0.45 μm的有机滤膜,置于4 ℃冰箱备用。用与果胶溶液体积相同的超纯水代替果胶溶液重复上述操作制备实验的对照组。
1.2.6 EP和果胶包覆丁香酚脂质体的结构表征
1.2.6.1 粒径、电位及EP的测定 取一定量的EP和果胶包覆丁香酚脂质体,用超纯水稀释10倍后,通过布鲁克海文ZetaPALS高分辨Zeta电位及粒度分析仪对样品的粒径、ζ-电位和PDI进行测定,每个样品重复测定三次。测试温度为25 ℃,散射角度为90 °,扫描波长为658 nm。样品的粒径以有效粒径表示,以直径计;粒径的分布以多分散系数(PDI)表示[23]。
1.2.6.2 包埋率的测定 丁香酚标准曲线的测定:称取一定量的丁香酚溶液溶解在95%的乙醇中,配制成浓度为0.08 mg/mL的丁香酚母液。用95%的乙醇稀释成浓度为0.005~0.04 mg/mL的丁香酚溶液。以95%的乙醇作为空白对照,于278 nm处用紫外分光光度计测定吸光值,绘制丁香酚标准曲线方程:y=18.8x+0.0078,R2=0.9997[24]。
包埋率的测定:脂质体中丁香酚的包埋率采用超滤离心法测定[23]。取300 μL的EP、栀子花果胶包覆丁香酚脂质体(gardenia flower pectin-coated eugenol liposomes,GLMP-EP)和苹果果胶包覆丁香酚脂质体(apple pectin-coated eugenol liposomes,ALMP-EP)于分子截留为100 kD的超滤离心管中,5000 r/min离心25 min,取适量滤液用95%的乙醇稀释20倍于278 nm处测滤液中丁香酚的浓度。另外取适量的EP、GLMP-EP和ALMP-EP用95%的乙醇溶液稀释20倍,5000 r/min离心20 min,取上清液于278 nm处测丁香酚的浓度,每个样品平行测定三次。
丁香酚包埋率的计算公式如下:
式中:m-样品溶液中丁香酚的总质量,mg;m0-根据标曲计算得到的游离丁香酚的质量,mg。
1.2.6.3 透射电镜观察 采用负染法[25]对EP、GLMP-EP和ALMP-EP的形貌进行观察。取一定浓度的样品溶液,滴几滴在碳涂覆的铜网上,放置3 min后用1%的磷钨酸对其染色5 min并在室温下进行干燥。采用透射电镜在120 KV下对EP、GLMP-EP和ALMP-EP进行观察。
1.2.7 EP、GLMP-EP和ALMP-EP贮藏稳定性的研究
1.2.7.1 贮藏温度的影响 根据张伟华[26]的方法将丁EP、GLMP-EP和ALMP-EP于4和25 ℃贮藏60 d,分别于0、30和60 d取样,测定样品的粒径、PDI及包埋率。
1.2.7.2 蔗糖浓度的影响 调节蔗糖在EP、GLMP-EP和ALMP-EP的浓度为0、50和100 mg/mL。分别于25 ℃贮藏60 d,于第0、30和60 d取样,测定样品的粒径、PDI和包埋率。
1.2.7.3 氯化钠浓度的影响 根据Shao等[27]的方法。调节氯化钠在EP、GLMP-EP和ALMP-EP的浓度为0、50和100 mmol/L,分别于25 ℃贮藏60 d,于第0、30和60 d取样,测定样品的粒径、PDI和包埋率。
1.2.8 EP、GLMP-EP和ALMP-EP释放性能的研究 参考邹立强的方法略作修改[28]。分别取5 mL的EP、GLMP-EP和ALMP-EP于分子截留为8000 Da的透析袋中,将透析袋分别放置于pH1.2的盐酸溶液和pH7.4的PBS溶液两种释放介质中,在温度为25 ℃,磁力搅拌器转速为100 r/min的条件下,分别于1、2、3、4、6、8、12和24 h取出3 mL的释放介质,于278 nm处测定释放介质的吸光值,并补充等温等量的释放介质,计算不同释放介质中丁香酚的含量和丁香酚的累积释放率。丁香酚的累积释放率的计算公式如下[5]:
式中:m0-丁香酚总质量,mg;mt-每个采样时间点丁香酚的累积释放量,mg。
1.3 数据处理
2 结果与分析
2.1 果胶的成分分析
不同来源的果胶,其结构和组成不同,可能导致对脂质体包覆的效果也不同,因此本文首先对提取的栀子花果胶和苹果果胶的成分进行了比较(如表1)。栀子花果胶与苹果果胶的中性糖含量没有显著性差异(P>0.05),苹果果胶的酸性糖含量显著大于栀子花果胶的酸性糖含量(P<0.05),分别为64.11%和35.21%。栀子花果胶和苹果果胶的酯化度分别为32.76%和5.89%,表明苹果果胶与栀子花果胶均为低甲氧基果胶,且苹果果胶的酯化度更低。

表1 苹果果胶与栀子花果胶的成分对比Table 1 Comparison of the composition ofapple pectin and gardenia flower pectin
2.2 EP制备工艺的优化
2.2.1 卵磷脂浓度对EP制备的影响 在丁香酚浓度为0.25%(V/V),吐温20浓度为1.0%(W/V)和乙醇浓度为20%(V/V)条件下探究了卵磷脂浓度对EP的影响。随着卵磷脂浓度的增大,EP的粒径和PDI均呈现先增大后减小的趋势,当卵磷脂浓度为1.5%时,EP的PDI值最小(如图1),表明在卵磷脂浓度为1.5%时EP的分散性最好,此时制备得到的EP粒径也较小。当卵磷脂浓度由0.25%增大到0.5%时,包埋率上升较快,当卵磷脂浓度由0.5%增大到1.5%时,包埋率上升缓慢(如图1),这可能是由于卵磷脂浓度过低时无法将丁香酚全部包裹住,导致包埋率较低;卵磷脂浓度为1.5%时对丁香酚的包埋已经达到了饱和状态,所以包埋率基本不变。因此,综合粒径、PDI及包埋率三个因素,选择卵磷脂浓度为1.5%进行后续实验。

图1 卵磷脂浓度对EP粒径、PDI及包埋率的影响Fig.1 Effect of concentrations of lecithinon particle size,PDI and embedding rate of EP
2.2.2 吐温20浓度对EP制备的影响 在丁香酚浓度为0.25%(V/V),卵磷脂浓度为1.5%(W/V)和乙醇浓度为20%(V/V)条件下探究了吐温20浓度对EP的影响。从图2中可以看出,加入吐温20可以减小EP的粒径和PDI值,且当吐温20浓度为0.5%时粒径最小。吐温20从0%增大到0.5%时,包埋率迅速增长,当吐温20浓度大于1%后,包埋率又有所下降(如图2),这可能是由于吐温是一种非离子型亲水性表面活性剂,含有亲水性和疏水性的长链。向脂质体中加入吐温后,其聚氧乙烯基会从脂质体的磷脂双分子层中伸出,致密地覆盖在脂质体表面,对脂质体形成保护作用,使得丁香酚不易发生泄露[29]。但是,较高浓度的吐温也会破坏脂质体的结构导致包埋的丁香酚泄露。因此,综合粒径、PDI值和包埋率的考虑,选择吐温20浓度为0.5%进行后续实验。

图2 吐温20浓度对EP粒径、PDI及包埋率的影响Fig.2 Effect of tween 20 concentrationson particle size,PDI and embedding rate of EP
2.2.3 乙醇浓度对EP制备的影响 在丁香酚浓度为0.25%(V/V),卵磷脂浓度为1.5%(W/V)和吐温20浓度为0.5%(W/V)条件下探究了乙醇浓度对EP的影响。图3表明,随着乙醇浓度的增加,EP的粒径和PDI值均呈现先减小后增大的趋势。当乙醇浓度大于20%后,包埋率下降较明显,这可能是由于乙醇可以增强脂质体的流动性,较高浓度的乙醇会破坏脂质体的囊泡结构使得丁香酚发生泄漏,导致包埋率减小[6]。因此,综合粒径、PDI值和包埋率的考虑,选择乙醇浓度为20%进行后续实验。

图3 乙醇浓度对EP粒径、PDI及包埋率的影响Fig.3 Effect of concentrations of ethanolon particle size,PDI and embedding rate of EP
通过单因素实验确定EP的制备工艺为:卵磷脂浓度1.5%,吐温20浓度0.5%,乙醇浓度20%。此时,EP的包埋率为77.40%±0.06%,粒径为(43.2±0.9) nm,PDI为0.116±0.023。与传统的乙醇注入结合微射流法[28]制得的丁香酚纳米脂质体相比(粒径58.6±3.4 nm,PDI 0.381±0.053,包埋率59.2%±4.7%),本法制得的EP粒径较小,分散性较好且包埋率较高。
2.3 果胶包覆对EP制备的影响
表2表示的是不同浓度的栀子花果胶对EP粒径、PDI、电位和包埋率的影响。随着果胶浓度的增大,EP的粒径和PDI值均逐渐增大,可能是由于果胶与脂质体发生了氢键相互作用,使得果胶包覆在了EP的表面导致粒径增大[13]。

表2 不同浓度的栀子花果胶对EP粒径、PDI、电位和包埋率的影响Table 2 Effect of different gardenia flower pectin concentrations on the particle size,PDI,zeta potential and embedding rate of EP
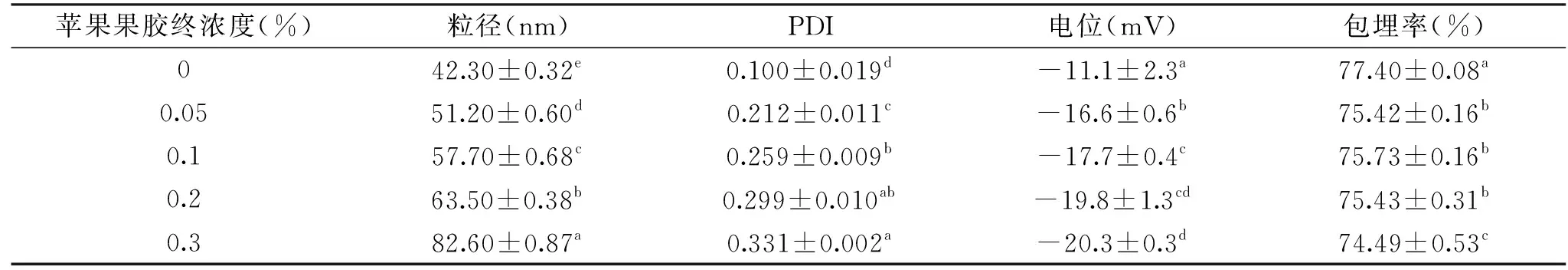
表3 不同浓度的苹果果胶对EP粒径、PDI、电位和包埋率的影响Table 3 Effect of different apple pectin concentrations on the particle size,PDI,zeta potential and embedding rate of EP
果胶终浓度从0.2%增大到0.3%时,电位值减小了6 mV左右,但不存在显著性差异(P>0.05),而包埋率显著下降(P<0.05),这表明终浓度为0.2%(W/V)的栀子花果胶在脂质体表面可能已经达到了饱和[13]。加入苹果果胶后也能看到类似的现象(如表3)。但是在相同果胶浓度的条件下,GLMP-EP的ζ-电位值比ALMP-EP的更低。
因此,综合粒径、电位、PDI和包埋率的影响,选择栀子花果胶和苹果果胶终浓度均为0.2%进行后续实验。
2.4 EP、GLMP-EP和ALMP-EP透射电镜图
用栀子花果胶和苹果果胶包覆后的EP如图4所示。通过对比发现,EP呈现圆形,分布较均匀。经过栀子花果胶包覆后的EP呈现椭圆形且发生了链状的聚集。经过苹果果胶包覆后的EP呈现圆形,粒径有所增大,也有轻微的聚集现象。这可能是由于果胶分子与脂质体的外层磷脂头端发生了桥联、成环、悬挂等作用,使得EP相互连接在了一起[30]。

图4 EP、GLMP-EP和ALMP-EP的透射电镜图Fig.4 TEM imagines of EP,GLMP-EP and ALMP-EP
从图中可以看出,部分EP的囊泡状结构发生了破裂,但是经过栀子花果胶和苹果果胶包覆的EP的结构均较为完整,这也可以说明EP经过果胶包覆后更加稳定。
2.5 EP、GLMP-EP和ALMP-EP贮藏稳定性的研究
2.5.1 贮藏温度对EP、GLMP-EP和ALMP-EP粒径、PDI和包埋率的影响 如图5所示,在4和25 ℃下贮藏60 d后,EP的粒径均增大了5 nm左右,包埋率分别降低了3.35%和2.45%;GLMP-EP的粒径均增大了2 nm左右,包埋率分别降低了1.16%和0.77%;ALMP-EP的粒径分别增大了4.6 nm左右和增大了2.1 nm左右,包埋率分别降低了1.46%和3.05%。在4 ℃下贮藏60 d后,ALMP-EP的PDI值均没有显著性变化(P>0.05);与0 d相比,EP和GLMP-EP的PDI值显著变大。在25 ℃下贮藏60 d后,GLMP-EP的PDI值没有显著性变化(P>0.05);与0 d相比,EP的PDI值显著变大,ALMP-EP的PDI值显著减小。经过60 d的贮藏,所有样品的包埋率均在70%以上,表明在4 ℃和25 ℃下三种样品均具有较高的稳定性。
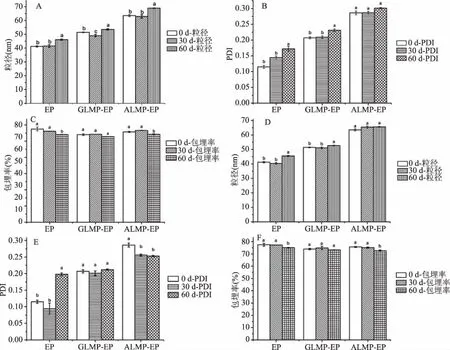
图5 不同贮藏温度对EP、GLMP-EP和ALMP-EP粒径、PDI和包埋率的影响Fig.5 Effects on particle size,PDI and encaopsulation efficiency of EP,GLMP-EP and ALMP-EP at different temperatures注:A:4 ℃对粒径的影响;B:4 ℃对PDI的影响;C:4 ℃对包埋率的影响;D:25 ℃对粒径的影响;E:25 ℃对PDI的影响;F:25 ℃对包埋率的影响;不同的小写字母代表同一样品在不同天数的粒径、PDI及包埋率存在显著性差异,P<0.05。
2.5.2 蔗糖浓度对EP、GLMP-EP和ALMP-EP粒径、PDI和包埋率的影响 为研究EP、GLMP-EP和ALMP-EP在不同蔗糖浓度条件下的稳定性,对EP、GLMP-EP和ALMP-EP在25 ℃不同浓度的蔗糖溶液(0、50和100 mg/mL)下进行了为期60 d的贮藏稳定性实验。如图6所示,EP、GLMP-EP和ALMP-EP在不同蔗糖浓度(0、50和100 mg/mL)的情况下,随着蔗糖浓度的增大,粒径均增大,但是增长幅度均小于5 nm。与0 d相比,GLMP-EP在100 mg/mL的蔗糖溶液中贮藏60 d时,PDI值和包埋率均显著减小(P<0.05);ALMP-EP在50 mg/mL的蔗糖溶液中贮藏60 d时,PDI值显著减小(P<0.05);ALMP-EP在100 mg/mL的蔗糖溶液中贮藏60 d时包埋率显著减小(P<0.05)。但是,贮藏60 d时所有样品的PDI值均小于0.3,包埋率均大于70%,表明EP、GLMP-EP和ALMP-EP在不同浓度的蔗糖(0、50和100 mg/mL)溶液中均具有良好的稳定性。
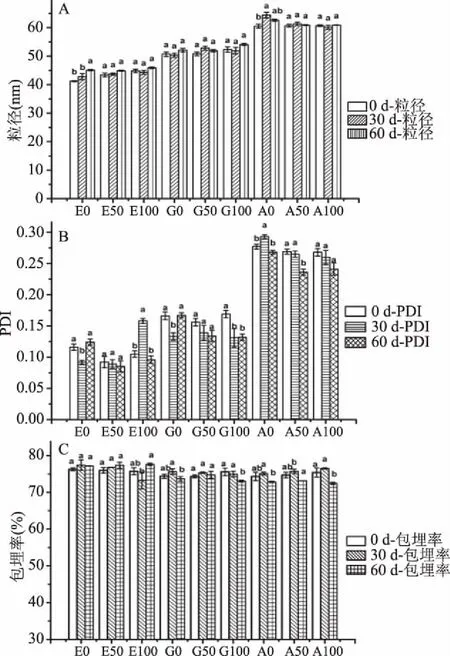
图6 不同浓度的蔗糖对EP、GLMP-EP和ALMP-EP稳定性的影响Fig.6 Effect of sucrose concentrations on stability ofEP,GLMP-EP and ALMP-EP注:A:蔗糖浓度对粒径的影响;B:蔗糖浓度对PDI的影响;C:蔗糖浓度对包埋率的影响;E0、G0和A0分别代表未添加蔗糖的EP、GLMP-EP和ALMP-EP;E50、G50和A50分别代表添加了50 mg/mL蔗糖的EP、GLMP-EP和ALMP-EP;E100、G100和A100分别代表添加了100 mg/mL蔗糖的EP、GLMP-EP和ALMP-EP,不同小写字母表示同一样品,相同添加量,不同天数之间差异显著(P<0.05)。
2.5.3 氯化钠浓度对EP、GLMP-EP和ALMP-EP粒径、PDI和包埋率的影响 为研究EP、GLMP-EP和ALMP-EP在不同盐浓度条件下的稳定性,对EP、GLMP-EP和ALMP-EP在25 ℃不同浓度的氯化钠(0、50和100 mmol/L)下进行了为期60 d的贮藏稳定性实验。结果如图7所示,随着氯化钠浓度的增大,EP的粒径逐渐增大,GLMP-EP和ALMP-EP的粒径均逐渐减小。与0 d相比,EP在0和50 mmol/L的氯化钠溶液中贮藏60 d时,PDI值显著增大(P<0.05);GLMP-EP在50和100 mmol/L的氯化钠溶液中贮藏60 d时,PDI值也显著增大(P<0.05);ALMP-EP在0和50 mmol/L中贮藏60 d时包埋率显著降低(P<0.05)。但是,贮藏60 d时所有样品的PDI值均小于0.3,包埋率均大于70%,表明EP、GLMP-EP和ALMP-EP在不同浓度的氯化钠(0、50 和100 mmol/L)存在的条件下均具有良好的稳定性。
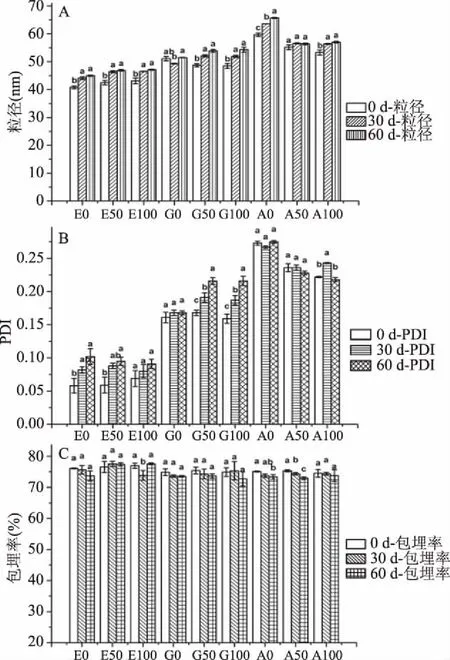
图7 不同浓度的氯化钠对EP、GLMP-EP和ALMP-EP稳定性的影响Fig.7 Effect of NaCl concentrations on stability ofEP,GLMP-EP and ALMP-EP注:A:氯化钠浓度对粒径的影响;B:氯化钠浓度对PDI的影响;C:氯化钠浓度对包埋率的影响;E0、G0和A0分别代表未添加氯化钠的EP、GLMP-EP和ALMP-EP;E50、G50和A50分别代表添加了50 mmol/L氯化钠的EP、GLMP-EP和ALMP-EP;E100、G100和A100分别代表添加了100 mmol/L氯化钠的EP、GLMP-EP和ALMP-EP,不同小写字母表示同一样品,相同添加量,不同天数之间差异显著(P<0.05)。
2.6 丁香酚溶液、EP、GLMP-EP和ALMP-EP的释放特性分析
为研究在不同pH下的缓释效果,本文探究了酸性(pH=1.2)和弱碱性(pH=7.4)两种情况下丁香酚溶液,EP、GLMP-EP和ALMP-EP的缓释情况(如图8所示)。

图8 丁香酚溶液、EP、GLMP-EP和ALMP-EP在不同pH溶液中的缓释情况Fig.8 Cumulative release rate of Eugenol,EP,GLMP-EP and ALMP-EP in different pH solutions注:A:在pH1.2的盐酸溶液中的缓释情况;B:在pH7.4的PBS溶液中的缓释情况,不同小写字母表示相同释放时间,不同样品间差异显著(P<0.05)。
在酸性环境下,丁香酚溶液中的丁香酚释放速率较快,前4 h释放了89.9%,但是,丁香酚在EP、GLMP-EP和ALMP-EP中存在着持续释放的现象(如图8A)。前6 h,EP、GLMP-EP和ALMP-EP中丁香酚的释放率分别为62.9%、49.8%和57.0%,且存在显著性差异(P<0.05)。EP具有缓释性能可能是因为丁香酚被包裹在囊泡状脂质体的内部,磷脂双分子层对丁香酚有一定保护作用[25]。有部分游离的丁香酚会附着在脂质体的表面,而加入果胶后果胶会包覆在脂质体的表面,与表面的丁香酚结合从而导致释放速率减慢[25]。在弱碱性环境中也可以看到类似的现象(如图8B),但是ALMP-EP中丁香酚的释放情况和EP无显著性差异(P>0.05),前6 h分别释放了57.4%和56.1%,而GLMP-EP中的丁香酚仅释放了43.4%,存在着显著性差异(P<0.05)。
3 结论
确定了栀子花果胶和苹果果胶包覆EP的最佳终浓度为0.2%。此时,GLMP-EP和ALMP-EP的粒径分别为51.3和63.5 nm,PDI分别为0.157和0.299,包埋率分别为76.39%和75.43%。透射电镜表明EP和ALMP-EP呈现圆形结构,GLMP-EP呈现椭圆形结构。果胶包覆脂质体后粒径的增大、电位值的下降、TEM图中的聚集现象都表明果胶成功包覆在了脂质体的表面。在不同温度(4和25 ℃),不同蔗糖浓度(0、50和100 mg/mL)和不同氯化钠浓度(0、50和100 mmol/L)的条件下贮藏60 d后,EP和经过栀子花果胶及苹果果胶包覆的EP仍具有较强的稳定性。缓释实验表明栀子花果胶在酸性环境和弱碱性环境中均能增强EP的缓释性能且效果优于苹果果胶。

