右美托咪定复合舒芬太尼对肺癌患者术后镇痛效果及细胞免疫功能的影响
李国利,高晓茹,王暐,张悦,曹亮,李福龙,滕金亮△
肺癌发病率和病死率高,位居各种类型肿瘤前列,严重威胁人类生命健康[1]。近年来,已开发了放化疗、干细胞治疗、免疫治疗等新型治疗手段[2],但严重的不良反应、药物耐受、机体免疫抑制微环境和高昂的治疗费用限制了其广泛应用。直到目前,根治手术仍然是治疗肺癌的最重要手段。然而,在手术过程中产生的创伤、麻醉刺激和术后疼痛可造成机体不良应激,加剧免疫抑制,降低患者的免疫功能,最终导致术后感染和肿瘤转移[3]。因此,选择有效的术后镇痛策略尤为重要。右美托咪定是一种高选择性α2 肾上腺素受体激动剂,具有镇痛、降低应激反应和缓解免疫抑制的功能,与麻醉药主要表现为协同作用[4]。目前右美托咪定联合麻醉剂用于肺癌术后镇痛的应用较多,但少有对患者术后免疫功能的变化及免疫功能恢复情况的报道。基于此,本研究探讨了右美托咪定复合舒芬太尼对肺癌患者根治手术后的镇痛效果和对其机体免疫功能的影响,以期为临床提供参考。
1 对象与方法
1.1 研究对象 选取河北北方学院附属第一医院在2017年7月—2019年7月行肺癌根治术的120例患者为研究对象,根据影像诊断结果和手术病理结果证实。患者年龄18~79岁,满足肺叶切除术指征且手术均由同一组医生完成。根据麻醉方式不同分为单一组和复合组,每组60 例。单一组男35例,女25例,年龄42~75岁,平均(62.05±8.92)岁,体质量指数(22.13±1.94)kg/m2,平均手术时间(170.56±39.83)min,美国麻醉医师协会(ASA)Ⅰ级24例,Ⅱ级36例。复合组男36例,女24 例,年龄40~74 岁,平均(61.24±8.58)岁,体质量指数平均(21.82±1.79)kg/m2,手术时间平均(173.43±37.26)min,ASA Ⅰ级22 例,Ⅱ级38 例。2 组患者 的性别比例(χ2=0.035)、年龄(t=0.513)、体质量指数(t=0.908)、手术时间(t=0.41,ASA 分级(χ2=0.140)等基本资料差异均无统计学意义(P>0.05)。本研究经医院伦理委员会审核批准,所有患者及家属均知情且签署知情同意书。
1.2 纳入及排除标准 纳入标准:(1)ASA 分级Ⅰ~Ⅱ级,患者术前无其他部位恶性肿瘤、高血压病史、消化系统病史、感染性疾病病史、神经系统病史,且未接受过放、化疗,对手术中所使用的药物无过敏史。排除标准:(1)术前2周内接受免疫治疗者。(2)既往长期服用镇痛、镇静药物者。(3)凝血功能、肝肾功能严重异常者。(4)肺癌转移者[5]。
1.3 药物及仪器 丙泊酚(四川国瑞药业有限责任公司,批准文号:国药准字H20040079;规格:10 mL∶100 mg)、咪达唑仑(宜昌人福药业有限责任公司,批准文号:国药准字H20067040;规格:2 mL∶2 mg)、舒芬太尼(宜昌人福药业有限责任公司,国药准字H20054256,规格:按C22H30N2O2S 计5 mL∶250 μg)、罗库溴铵(扬子江药业集团有限公司,批准文号:国药准字H20066941;规格:4 mg)、右美托咪定液(江苏恒瑞医药股份有限公司,国药准字H20061193,规格:5 mL∶5 mg)、盐酸瑞芬太尼(宜昌人福药业有限责任公司,批准文号:国药准字H20030197,规格:按C20H28N2O5计1 mg);自然杀伤(NK)细胞、T 细胞亚群(CD3、CD4、CD8)抗体(Sigma),干扰素-γ(IFN-γ)和白细胞介素-10(interleukin-10,IL-10)酶联免疫吸附测定(ELISA)试剂盒(英国Abcam 公司)。仪器:流式细胞仪(美国BD FACSCanto II)、酶标仪(BIOBASEEL10C)。
1.4 镇痛方法 所有患者在术前8 h禁食、禁饮,入室后常规监测血压、心率、血氧饱和度、心电图,左上肢桡动脉穿刺监测有创血压。患者深呼吸吸纯氧1 min后进行麻醉诱导。具体方法为:静脉注射丙泊酚1.5 mg/kg,咪达唑仑0.05 mg/kg,罗库溴铵0.9 mg/kg和枸橼酸舒芬太尼2 μg/kg。然后进行麻醉维持:泵注丙泊酚3~6 mg/(kg·h),盐酸瑞芬太尼8~11 mg/(kg·h)以维持脑电双频指数在40~60[6]。手术结束后,停止泵注丙泊酚和盐酸瑞芬太尼,所有患者连接自控静脉镇痛(PCIA)泵。PCIA 给药方案为:单一组100 μg 舒芬太尼溶于100 mL 生理盐水,复合组100 μg 舒芬太尼和500 μg 右美托咪定溶于100 mL 生理盐水。2 组中舒芬太尼的设定持续剂量均为0.02 μg/(kg·h),复合组右美托咪定的持续剂量为0.05 μg/(kg·h),2 组锁定时间均为10 min[7]。若镇痛效果不理想,可静脉注射舒芬太尼50 μg/次进行补救镇痛。
1.5 镇痛效果评估 选取术后1、6、12、24、48 h作为监测点,对2 组患者行疼痛视觉模拟评分(VAS)和舒适度评分(BCS)。VAS评分范围为0~10分,得分越高表明患者的术后疼痛越严重,0分为完全无痛,1~3分为轻度疼痛,4~6分为中度疼痛,7~10 分为重度疼痛[6]。根据静息、深呼吸和咳嗽时有无痛感,BCS 评分为0、1、2、3、4 分,分值越高表明痛感越低,舒适度越高[8]。
1.6 IFN-γ和IL-10水平检测 分别于术前,术后12、24、48 h、1 周取2 组患者的外周血3 mL,常温状态下3 500 r/min 离心5 min,弃下层红细胞,保留上层血清。利用流式细胞仪测定2组各时间点NK细胞、CD3+、CD4+、CD8+T细胞的数量,并计算CD4+/CD8+的比例;NK细胞和CD3+T细胞、CD4+T细胞水平和CD4+/CD8+的比值越低,CD8+T 水平越高表明机体的免疫抑制越强;采用ELISA 法检测血清中IFN-γ 和IL-10 的表达水平。所有检测操作均严格按照各试剂盒的说明书进行,每个检测重复3次。
1.7 术后不良反应监测 记录2组患者术后48 h内恶心、干呕、皮肤瘙痒、低血压、心动过缓等不良反应的发生情况。
1.8 统计学方法 采用SPSS 23.0对数据进行分析。计量资料采用均数±标准差(±s)表示,各指标总体比较采用重复测量方差分析,组间比较行t检验;计数资料以例(%)表示,组间比较采用χ2检验;以P<0.05为差异有统计学意义。
2 结果
2.1 2组患者的VAS和BCS评分比较 不同处理和时间对患者的VAS 和BCS 评分均有影响,存在交互作用。组间比较:复合组患者术后1、6、12、24、48 h的VAS评分均低于单一组,BCS评分高于单一组,差异有统计学意义(P<0.01)。组内比较,整体上2 组患者的VAS 评分在术后48 h 内逐渐下降,BCS 评分逐渐升高(P<0.01)。见表1、2。
2.2 2 组患者围手术期血浆中免疫细胞的水平比较 组间比较:术前2 组患者血浆中的各免疫细胞水平差异均无统计学意义(P>0.05)。复合组患者术后12、24、48 h 和1 周时NK 细胞、CD3+T 细胞、CD4+T细胞及CD4+/CD8+均高于单一组,术后12、24、48 h 时CD8+T 细胞的水平明显低于单一组,差异有统计学意义(P<0.05)。组内比较:单一组和复合组患者术后1 周内血浆NK 细胞、CD3+T 细胞、CD4+T细胞先下降后升高;此外单一组CD8+T 细胞在术后1周内基本稳定,复合组则呈先降低后升高的变化,同时复合组CD4+/CD8+在术后1周内基本稳定,单一组则呈先降后升的变化。见图1。
2.3 2 组患者围手术期的IFN-γ 和IL-10 水平比较 组间比较:术前2 组IFN-γ 和IL-10 的水平差异无统计学意义(P>0.05)。复合组在术后12、24、48 h、1 周时IFN-γ 的水平低于同期单一组(P<0.05 或P<0.01),IL-10水平则高于同期单一组(P<0.05)。组内比较:术后12、24、48 h、1周时,单一组IFN-γ及IL-10 水平均明显高于术前;复合组在术后12、24、48 h IFN-γ 水平高于术前(P<0.05),术后1 周即恢复至术前水平(P>0.05),而各时点IL-10水平均高于术前(P<0.05)。见表3、4。
2.4 术后不良反应比较 患者术后共出现恶心、呕吐、皮肤瘙痒、低血压和心动过缓5种不良反应,2组患者不良反应总发生率比较差异无统计学意义(P>0.05)。见表5。
Tab.1 Comparison of VAS scores at different time points after surgery between the two groups表1 2组患者术后不同时间点的VAS评分结果(分,±s)
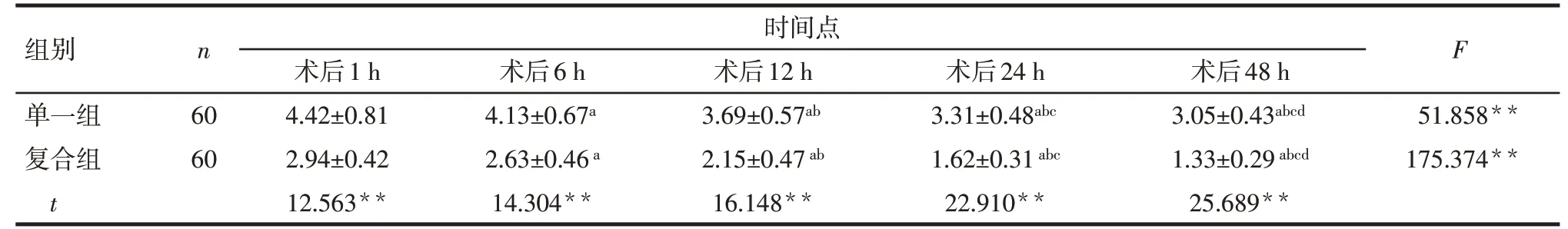
Tab.1 Comparison of VAS scores at different time points after surgery between the two groups表1 2组患者术后不同时间点的VAS评分结果(分,±s)
**P<0.01;F组间=49.532**,F时间=67.384**,F交互=29.668**;组内比较:a与术后1 h相比,b与术后6 h相比,c与术后12 h相比,d与术后24 h相比,P<0.05
组别单一组复合组t n 时间点F 60 60术后1 h 4.42±0.81 2.94±0.42 12.563**术后6 h 4.13±0.67a 2.63±0.46a 14.304**术后12 h 3.69±0.57ab 2.15±0.47ab 16.148**术后24 h 3.31±0.48abc 1.62±0.31abc 22.910**术后48 h 3.05±0.43abcd 1.33±0.29abcd 25.689**51.858**175.374**
Tab.2 Comparison of BCS scores at different time points after surgery between the two groups表2 2组患者术后不同时间点的BCS评分结果(分,±s)
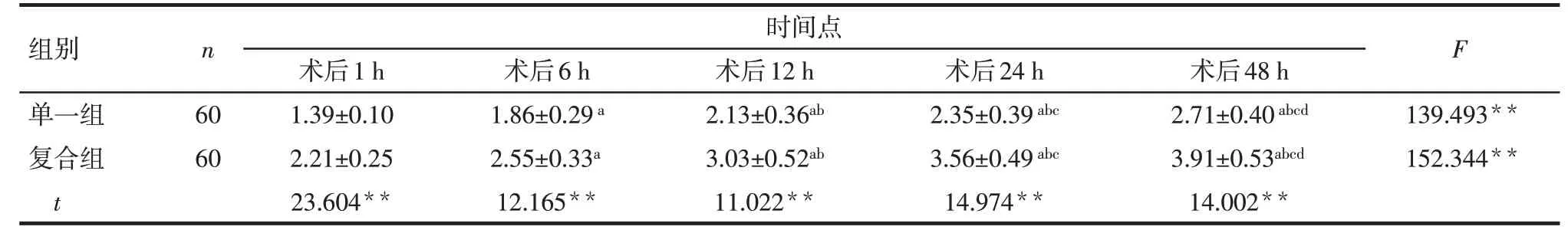
Tab.2 Comparison of BCS scores at different time points after surgery between the two groups表2 2组患者术后不同时间点的BCS评分结果(分,±s)
**P<0.01;F组间=53.273**,F时间=72.157**,F交互=23.693**;组内比较:a与术后1 h相比,b与术后6 h相比,c与术后12 h相比,d与术后24 h相比,P<0.05
组别单一组复合组t n 时间点F 60 60术后1 h 1.39±0.10 2.21±0.25 23.604**术后6 h 1.86±0.29a 2.55±0.33a 12.165**术后12 h 2.13±0.36ab 3.03±0.52ab 11.022**术后24 h 2.35±0.39abc 3.56±0.49abc 14.974**术后48 h 2.71±0.40abcd 3.91±0.53abcd 14.002**139.493**152.344**
3 讨论
在过去的几十年中,PCIA已普遍应用于术后镇痛。与传统的阿片类药物给药方式相比,PCIA具有更好的术后疼痛减轻效果和更好的患者满意度[9]。舒芬太尼是静脉PCIA中最常用的镇痛药,其主要作用于μ阿片受体,相比于芬太尼或吗啡,具有更短的消除半衰期和更小的分布体积,有利于患者更快恢复[10]。然而,当其单独使用时,往往伴随不良的术后风险,这限制了其作为管理术后疼痛的单一治疗方法的应用[11]。
随着麻醉技术的发展,基于舒芬太尼的复合麻醉策略的应用日益广泛。Wang 等[12]发现罗哌卡因联合舒芬太尼应用于孕妇分娩时的脊柱-硬膜外麻醉时具备起效时间快、分娩期短的双重优势,镇痛作用显著,受试者满意度高。Zhan 等[13]以舒芬太尼-丙泊酚全麻联合椎旁阻滞应用于肺癌患者的手术切除,可明显提高术后镇痛活性,减少术中舒芬太尼的使用剂量。Xu 等[14]开发了酮咯酸氨丁三醇联合舒芬太尼的策略用于外伤性骨科手术患者的术后镇痛,不仅能起到良好的镇痛、镇静作用,而且能显著减少舒芬太尼用量和术后相关不良事件的发生。然而,基于舒芬太尼在PCIA 的临床应用仍存在较大挑战。
右美托咪定是一种高度选择性的肾上腺素α2受体激动剂,常用作多模式镇痛中的辅助成分。其可通过激活K+通道促进K+信号传导,激活内源性促进睡眠通路,产生催眠效应,发挥镇痛作用;另外,右美托咪定可有效结合蓝斑受体,抑制组织胺释放,增强迷走神经的活性,从而实现良好的术中镇痛效果[15]。由于右美托咪定和舒芬太尼的作用位点不同,两者联合使用时可实现协同镇痛效果,且不会引起呼吸抑制,目前已被广泛应用于腹腔镜手术[15]、剖宫产术[16]、喉切除术[17]、肺叶切除术[18]、胃肠道肿瘤切除[19]等手术中。本研究使用右美托咪定作为舒芬太尼用于肺癌切除术后PCIA 的佐剂,结果表明,相比于单独使用舒芬太尼作为镇痛剂,复合组患者在术后的疼痛指数明显降低,患者舒适度大幅提高,且作用可维持48 h,这与姜慧芳等[20]的研究结果一致。
手术产生的疼痛和压力往往会破坏患者术后的免疫功能,造成免疫力低下和炎症反应。在人体的免疫稳态调节中,免疫细胞和免疫因子发挥重要作用。NK细胞作为第一道天然防线,可以直接非特异性地杀伤入侵细胞[21];CD3 是成熟T 细胞表面的共同标志物,并且可在成熟的过程中进一步分化为CD4+和CD8+T细胞。CD4+T细胞可直接参与细胞免疫应答,起辅助免疫作用[22];CD8+T细胞只有在辅助性T 细胞的刺激下才能被激活,起免疫抑制作用。因此,NK细胞、CD4+T细胞和CD4+/CD8+的水平下降可指示机体处于免疫抑制状态。本研究结果表明,2组患者在手术后均出现一段时间的免疫失衡,进而导致炎症反应的发生,表现为抗炎因子IL-10 和促炎因子IFN-γ的表达上升。但单一组患者免疫失衡更严重,状态维持时间更长。笔者认为,出现这种现象的原因是右美托咪定可有效地抑制交感神经,减少氧自由基的生成和儿茶素的释放,从而使儿茶酚介导的免疫抑制作用被有效缓解[23]。另外,右美托咪定还可通过调节NF-κB通路发挥抗炎作用[24],缓解机体的炎症应激反应。
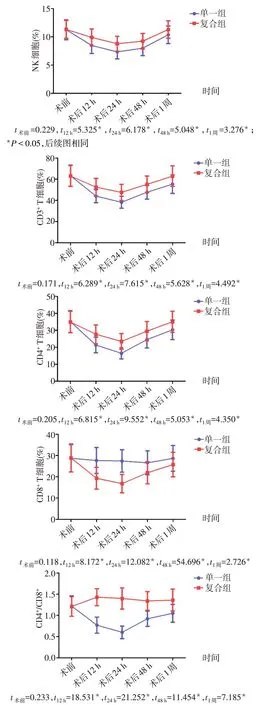
Fig.1 Results of perioperative changes in immune cell levels in two groups of patients图1 2组患者围手术期的免疫细胞水平的变化
给药后的不良反应是临床治疗中需要重点关注的事件。当以临床推荐的剂量给药时,右美托咪定会产生剂量依赖性的低血压和心动过缓,这是由于抑制了交感神经的信号传递并降低了交感神经张力;当给予大剂量或快速静脉注射后,右美托咪定会过度激活平滑肌细胞上的α2 肾上腺素受体而产生高血压[25]。本研究结果显示,单一组和复合组之间低血压或心动过缓的发生率无显著差异,推测原因在于整个研究过程中右美托咪定的输注剂量小于0.1 μg/(kg·h),该剂量低于建议的0.2~0.7 μg/(kg·h)。另外,恶心、呕吐等不良反应的发生率在2组患者间无明显差异,这可能是由于低剂量右美托咪定造成的不良反应较轻[16]。
本研究存在一定的局限性。由于样本数量有限,本研究只采用了一种输注速率的右美托咪定作为辅助成分,未能实现对舒芬太尼和右美托咪定最佳剂量的探索;另外,本文未进行血清中右美托咪定的浓度测定,这在不同的患者中可能会存在差异,进而对结果产生一定的影响。综上,本研究结果表明,与单独麻醉相比,复合麻醉策略能够显著降低患者术后痛感,缓解免疫抑制状态,提高术后舒适度。
Tab.3 Comparison of the levels of IFN-γ in perioperative period between the two groups表3 2组患者围手术期的IFN-γ水平比较(ng/L,±s)

Tab.3 Comparison of the levels of IFN-γ in perioperative period between the two groups表3 2组患者围手术期的IFN-γ水平比较(ng/L,±s)
*P<0.01,**P<0.01;F组间=113.473**,F时间=78.357**,F交互=55.172**;组内比较:a与术前相比,b与术后6 h相比,c与术后12 h相比,d与术后48 h相比,P<0.05
组别单一组复合组t n 时点F 60 60术前310.42±30.15 309.73±31.09 0.118术后12 h 408.77±41.26a 377.66±37.63a 4.324**术后24 h 382.63±38.42ab 335.45±35.51ab 6.993**术后48 h 343.28±34.61abc 328.44±32.67abc 2.418*术后1周327.19±32.56abcd 310.58±30.78bc 5.653**77.432**40.614**
Tab.4 Comparison of the levels of IL-10 in perioperative period between the two groups表4 2组患者围手术期的IL-10水平比较(ng/L,±s)

Tab.4 Comparison of the levels of IL-10 in perioperative period between the two groups表4 2组患者围手术期的IL-10水平比较(ng/L,±s)
**P<0.01;F组间=89.562**,F时间=62.458**,F交互=39.712**;组内比较:a与术前相比,b与术后6 h相比,c与术后12 h相比,d与术后48 h相比,P<0.05
组别单一组复合组t n 时点F 60 60术前205.43±23.64 205.09±24.02 0.083术后12 h 264.92±27.73a 328.86±31.45a 11.809**术后24 h 290.49±29.68ab 361.62±33.47ab 12.319**术后48 h 310.57±30.49abc 382.64±35.78abc 11.876**术后1周248.36±25.34abcd 330.26±32.02abcd 15.535**129.883**284.813**
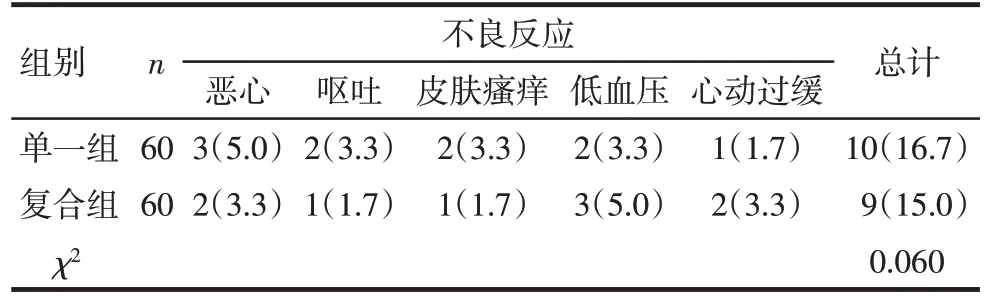
Tab.5 Results of postoperative adverse reactions表5 2组术后不良反应结果[例(%)]

