响应面优化超声协同高压矩形脉冲电场提取黄花菜多糖工艺及其抗氧化活性研究
陆海勤,宫晓丽,李冬梅,骆文静,李毅花,李 文
(1.广西大学轻工与食品工程学院,广西南宁 530004;2.广西民族大学化学化工学院,广西林产化学与工程重点实验室,广西南宁 530008)
黄花菜(HemerocalliscitrinaBaroni或Liliaceae)又称萱草、忘忧草、萱草花等,为百合科萱草属多年生草本植物的花蕾。在我国,黄花菜作为蔬菜或药材食用已经有几千年历史。中药志中记载黄花菜具有健胃安神、平肝养血、镇痛、通乳、抗菌消炎、消肿利尿等功效,对黄疽、大便下血、水肿、感冒、痢疾、尿路感染、腰痛、关节肿痛等症状的治疗具有很好的效果[1]。除此之外,黄花菜含有丰富的卵磷脂,具有解酒的作用,可以保护肝细胞,促进肝细胞活化再生,增强肝功能。其丰富的卵磷脂还可以增强大脑功能,清除血管中的沉积物,提高记忆力[2]。
随着科技的发展,人们开始采用各种不同的提取技术来提取植物多糖。如热水浸提法是提取植物多糖最传统的方法之一,其技术简单安全、易操作,但提取温度高、提取时间长,可能会引起多糖的降解,破坏其结构和生理活性[3];酸碱浸提法能有效利用酸碱液使植物细胞的细胞壁吸水破裂,同时破坏细胞膜的通透性,使多糖从细胞中游离出来,但此方法也会使多糖的结构和生理活性遭到破坏[4];超声辅助水提法具有提取时间短、提取效率高、提取温度低等优势,但此法效率受设备影响较大[5-6];微波辅助水提法具有提取量高、原料预处理成本低、快速准确等优势,同时也存在耗能大、耗材多、耗时长、提取效率低等缺点[7-8];酶法提取的反应条件温和,产物不易变性、环保节能,但对温度、pH等实验条件的要求较高[9];亚临界水提取法提取速度快、效率高、能够连续运行,但对样品的形状粒度要求较高[10];复合水提法操作较简便,但浸出成分较复杂,不利于精制[11]。因此可根据原料的特性和实验的具体要求选择合适的方法。
目前,有关超声辅助提取和高压脉冲电场辅助提取[12-14]的研究很多,两者各具有不同优势[15-16],但关于超声协同静电场辅助提取的文献不多。谢阁等[17]将超声波技术和高压脉冲电场技术相结合,开发了一种新型提取技术,用于酵母细胞中蛋白质和核酸的提取。结果表明:蛋白质和核酸得率分别达到45.86%和53.75%,其中蛋白质的得率是高压脉冲电场单独作用时的1.37倍,是超声波单独作用时的1.74倍,核酸的得率是高压脉冲电场单独作用时的1.33倍,是超声波单独作用时的1.96倍。王家德等[18]等利用超声-电场集成反应器研究有机物2-氯酚的降解效果,结果表明在超声电场协同作用下,2-氯酚的降解速率常数是单独作用时的1.32倍,说明超声和电场之间存在协同效应。
用超声协同高压矩形脉冲电场辅助提取技术对黄花菜粉末进行处理,在超声场中加入静电场,可对溶液产生细微的干扰,增加溶液中的大直径气泡的数量,从而增强超声的空化效应,使黄花菜多糖充分溶出。目前关于超声-电场耦合提取植物多糖应用研究较少,因此本实验在前期单因素实验的基础上,提出了超声协同矩形高压脉冲电场提取植物多糖的方法,利用响应曲面对实验条件(提取时间、提取温度、超声功率和电压)进行优化,并对黄花菜粗多糖Hemerocallis citrina polysaccharide(HCPS)的抗氧化活性进行测定。
1 材料与方法
1.1 材料与仪器
黄花菜 产地广州,购于梅州银新现代农业有限公司;无水乙醇、苯酚、浓硫酸、葡萄糖、氢氧化钠、硫酸亚铁、水杨酸、Tris试剂、抗坏血酸、邻苯三酚等 均为国产分析纯。
DFY-500型手提式万能粉碎机 浙江省温岭市林大机械有限公司;SB-5DTD型超声波提取器 宁波新芝生物科技有限公司;DE-100型高精度双极高压静电场发生器 大连鼎通科技有限公司;DKB-10型数显智能低温恒温循环器 宁波新芝生物科技有限公司;SH2-CD型循环水式真空泵 巩义市予华仪器有限责任公司;UV-5200型可见光分光光度计 上海元析仪器有限公司;DHG-9146A型电热恒温鼓风干燥箱 上海精宏实验设备有限公司;BS200S型电子天平 德国Sartorous公司。
1.2 实验方法
1.2.1 黄花菜的预处理 将黄花菜在50 ℃的电热鼓风恒温干燥箱中烘干、粉碎、过60目筛,将粉碎后的粉末用石油醚(沸点中60~90 ℃)回流脱脂4 h,再用75%的乙醇浸泡24 h后抽滤,以除去色素、黄酮、单糖、寡糖等物质,自然风干后装入塑封袋中待用。
1.2.2 超声协同矩形高压脉冲电场辅助提取黄花菜多糖的方法
1.2.2.1 超声协同矩形高压脉冲电场提取黄花菜多糖实验装置 提取实验装置如图1;超声发生器的频率为20 kHz,不可调,额定输出电功率为450~1050 W,作用方式为无间歇连续作用;高精度双极高压静电场发生器的额定输出电压可在0~50 kV间连续变化;矩形脉冲电场的脉冲频率通过时间控制器调节,电压的变化频率如图2所示;恒温循环器的温度变化范围为-5~100 ℃。提取过程中,超声发生器和电场发生器同时开同时关。
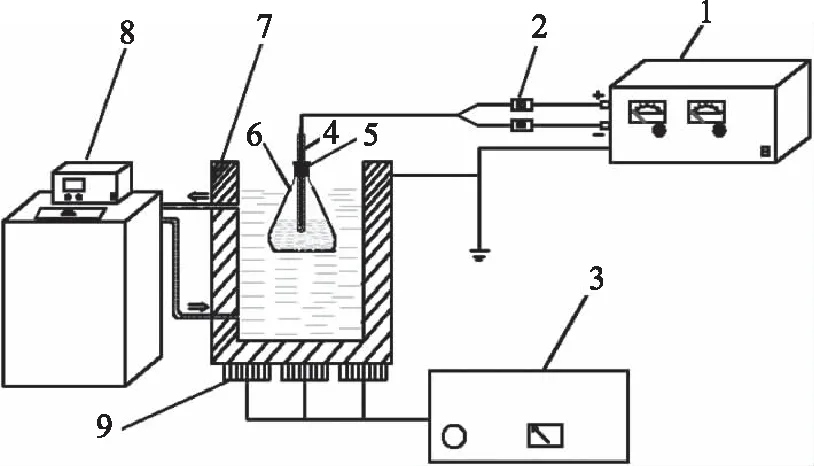
图1 超声协同矩形高压脉冲电场提取装置示意图Fig.1 Schematic diagram of ultrasound combinedwith high pulsed electric field assisted-extraction device注:1:高精度双电极高压静电场发生器,2:时间控制器,3:超声波发生器,4:被绝缘玻璃包裹的电极,5:密封橡胶塞,6:锥形瓶,7:超声水浴槽,8:恒温循环器,9:超声波换能器。
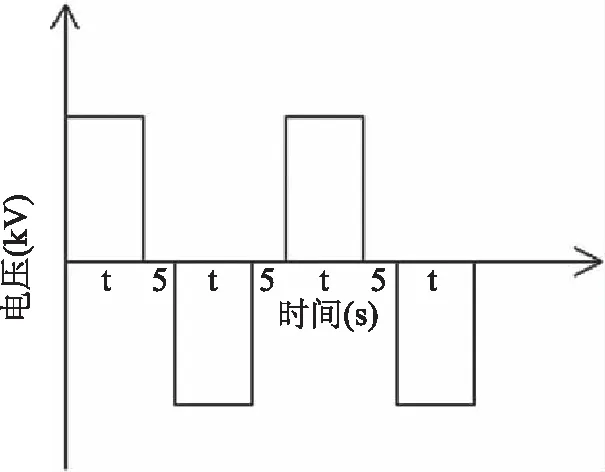
图2 矩形脉冲电场电压变化示意图Fig.2 The diagram of the change of theelectrical field voltage with time
1.2.2.2 超声协同矩形高压脉冲电场提取黄花菜多糖工艺 准确称取经预处理后的黄花菜粉末5.00 g,置于250 mL锥形瓶中,添加一定比例的蒸馏水,用橡胶塞密封,固定于超声水浴槽的中央(事先将超声水浴槽中的水温恒定在一定温度),调整电极棒的位置,使其下端位于提取液以下,同时打开超声和静电场发生器,在设定的提取条件(液料比、提取时间、提取温度、超声功率、电压、电场频率)下进行提取。提取一段时间后,将提取后的物料在4000 r/min下离心15 min,收集上清液,通过400目纱布过滤,得到黄花菜多糖粗提液,测量粗提液体积。精确移取5 mL粗提液加入4倍体积无水乙醇搅拌均匀,密封置于4 ℃冰箱醇沉24 h,在4000 r/min,4 ℃条件下离心10 min得黄花菜多糖沉淀物,将沉淀物复溶于蒸馏水,置于250 mL容量瓶中定容,得黄花菜粗多糖溶液。
1.2.3 单因素实验
1.2.3.1 料液比对黄花菜多糖得率的影响 在温度50 ℃、超声功率550 W、脉冲电压5 kV、脉冲频率为1/120 s-1的条件下,分别以1∶10、1∶15、1∶20、1∶25、1∶30 (g/mL)的料液比提取20 min,考察不同液料比对黄花菜多糖得率的影响。
1.2.3.2 提取时间对黄花菜多糖得率的影响 在液料比为1∶25 (g/mL)、提取温度50 ℃、固定超声功率550 W、电场电压5 kV,脉冲频率为1/120 s-1的条件下,分别提取10、20、30、40、50 min,考察不同提取时间对黄花菜多糖得率的影响。
1.2.3.3 提取温度对黄花菜多糖得率的影响 在液料比为1∶25 (g/mL)、提取时间为30 min、超声功率550 W、电场电压为5 kV、脉冲频率1/120 s-1的条件下,分别在40、50、60、70、80 ℃的温度下提取30 min,考察不同温度对黄花菜多糖得率的影响。
1.2.3.4 电场电压对黄花菜多糖得率的影响 在液料比为1∶25 (g/mL)、温度60 ℃、超声功率550 W、脉冲频率1/120 s-1的条件下,分别以5、10、15、20、25 kV的电压提取30 min,考察不同脉冲电压对黄花菜多糖得率的影响。
1.2.3.5 超声功率对黄花菜多糖得率的影响 在液料比为1∶25 (g/mL)、温度为60 ℃、电场电压15 kV、脉冲频率1/120 s-1的条件下,分别以450、550、650、750、850 W的超声功率提取30 min,考察不同超声功率对黄花菜多糖得率的影响。
1.2.3.6 脉冲频率对黄花菜多糖得率的影响 在料液比为1∶25 (g/mL)、温度60 ℃、电场电压15 kV、超声功率650 W的条件下,脉冲频率分别以1/120、1/360、1/600、1/900、1/1800 s-1的脉冲频率提取30 min,考察不同脉冲频率对黄花菜多糖得率的影响。
每组实验均平行三次,考察单因素对黄花菜多糖提取得率的影响。
1.2.4 响应面试验 在前期超声协同矩形高压脉冲电场提取黄花菜多糖单因素实验的基础上(液料比、提取时间、提取温度、超声功率、电场电压、电场频率),在液料比为1∶25 (g/mL),脉冲频率为1/600 s-1的条件下,选取提取时间、提取温度、超声功率、电场电压四个对黄花菜多糖得率有显著影响的因素进行四因素三水平响应面优化实验。运用Box-Behnken响应面实验设计来研究不同提取参数间的交互影响及其对黄花菜得率的影响,并通过实验确定最优的提取方案。实验因素和水平见表1。

表1 响应面试验因素及水平Table 1 Factors and levels of Box-Behnken design
1.2.5 硫酸-苯酚法测定黄花菜多糖含量 葡萄糖标准曲线的绘制参考文献[19]中的方法:葡萄糖标准品烘干至恒重,准确称取50 mg,定容于500 mL容量瓶中,分别准确吸取0.50、1.00、2.00、3.00、4.00、5.00、6.00 mL葡萄糖标准溶液置于100 mL容量瓶中定容。分别准确移取1 mL定容后的溶液,置于10 mL具塞比色管中,加入1 mL 6%苯酚,摇匀后加入5 mL浓硫酸,振荡均匀后,置于40 ℃的水浴锅中反应30 min,冷却后测定490 nm处的吸光度值,蒸馏水作为空白。以葡萄糖的浓度为横坐标,吸光度值为纵坐标,绘制葡萄糖标准曲线(回归方程为y=0.00814+0.01071x,R2=0.9999)。
样品中多糖含量的测定:精确移取上述定容后的粗多糖溶液1 mL于10 mL具塞比色管中,按上述步骤反应测定其吸光度,通过葡萄糖标准曲线回归方程计算多糖含量。每组实验重复3次,取三次平均值作为最终结果。
多糖含量(g)=(硫酸-苯酚法测得沉淀中多糖的含量×提取液的总体积)/5×0.9

其中,0.9为葡萄糖换算成粗多糖的校正系数。
式(1)
式中:A0为用蒸馏水代替多糖溶液的空白组溶液的吸光度;Ai为反应结束后混合溶液的吸光度;Aj为多糖样品本身的吸光度。
1.2.7 黄花菜多糖对羟自由基的清除能力 参照文献[21]中的方法进行测定:分别移取0、0.2、0.4、0.6、0.8、1.0 mL响应面优化后最优条件下的黄花菜粗多糖溶液于10 mL具塞比色管中,补加蒸馏水至1 mL,加入6 mmol/L的FeSO4溶液2 mL,6 mmol/L的H2O2溶液2 mL,摇匀,静置10 min后,再加入6 mmol/L的水杨酸溶液2 mL,摇匀后在37 ℃条件下恒温水浴反应30 min,冷却,在510 nm波长处测吸光度。以抗坏血酸溶液作为对照。对·OH的清除率计算公式如下;
式(2)
式中:A0为用蒸馏水代替多糖溶液的空白组溶液的吸光度;Ai为反应结束后混合溶液的吸光度;Aj为多糖样品本身的吸光度。
1.2.8 黄花菜多糖对DPPH·的清除能力 黄花菜多糖对DPPH自由基的清除能力参照[22]中描述的方法进行测定,具体步骤如下:分别移取0、0.2、0.4、0.6、0.8、1.0 mL的黄花菜粗多糖溶液于10 mL具塞比色管中,补加蒸馏水至1 mL,加入0.1 mmol/L的DPPH溶液2 mL,摇匀后置于暗处在室温下反应30 min,随后517 nm处测定溶液的吸光度,以抗坏血酸溶液作为对照。对DPPH自由基的清除率的计算公式如下:
式(3)
其中:A0为用蒸馏水代替多糖溶液的空白组溶液的吸光度;Ai为多糖溶液与DPPH溶液反应结束后混合溶液的吸光度;Aj为多糖样品本身的吸光度。
1.3 数据处理
Design Expert 软件(版本8.0.6)专业版统计分析软件和Origin(版本9.0)软件对获得的数据进行分析。
2 结果与分析
2.1 单因素实验结果
2.1.1 料液比对黄花菜多糖得率的影响 由图3可知,当液料比从1∶10 (g/mL)增加至1∶30 (g/mL)时,黄花菜多糖的得率从5.31%增至7.46%,当液料比为1∶25 (g/mL)时,得率达到最大,随着液料比的继续增大,得率出现了略微的降低,这是由于料液比越大,溶液中溶出杂质相对增多,加入乙醇后醇沉多糖较困难,导致测得的得率降低。除此之外,较高的液料比会加大后期多糖处理过程中的难度。因此选择最适宜的料液比为1∶25 (g/mL)。
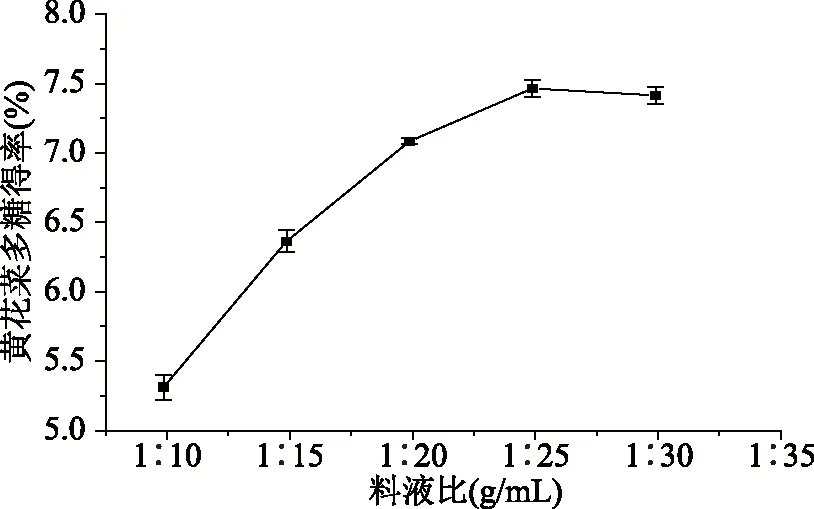
图3 料液比对黄花菜多糖得率的影响Fig.3 Effect of solid-liquid ratio on the yield of HCPS
2.1.2 提取时间对黄花菜多糖得率的影响 由图4可知,当提取时间从10 min延长至30 min时,黄花菜的得率随之增加,从6.11%增至7.84%;继续延长提取时间,黄花菜的得率开始下降,这是由空化效应和超声传播过程产生的机械振动造成的,除此之外,超声作用时间的延长可能会造成更多溶解在溶剂中的多糖被分解,从而使多糖的含量降低,因此选择最适宜的提取时间为30 min。
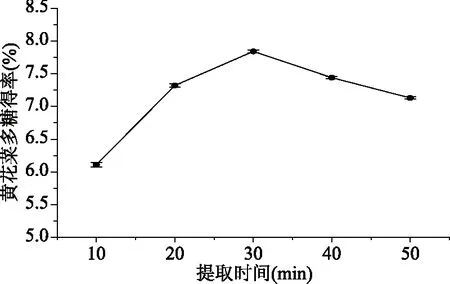
图4 提取时间对黄花菜多糖得率的影响Fig.4 Effect of extraction time on the yield of HCPS
2.1.3 提取温度对黄花菜多糖得率的影响 由图5可知,当提取温度为60 ℃,黄花菜多糖的得率最高,为8.16%。低于或者高于60 ℃,黄花菜多糖的得率都随之降低。这说明在60 ℃时,体系中超声空化和溶质扩散的协同效应达到了最大。因此选择最适宜的提取温度为60 ℃。
图5 提取温度对黄花菜多糖得率的影响Fig.5 Effect of extraction temperature on the yield of HCPS
2.1.4 电场电压对黄花菜多糖得率的影响 由图6可知,当电场电压从5 kV增至15 kV时,黄花菜多糖的得率随之增加,从7.92%增至8.57%;随着电场电压继续增大,黄花菜多糖的得率开始下降。电场电压的大小直接影响了体系中电场的强度,并加速了溶剂中阴阳离子的扩散速度,进而加快多糖的扩散速度,并且高压电场的存在可以对溶液产生微干扰,使溶液中空化气泡的形状发生变化,爆破时间减短,从而增加空化效应,促进多糖得率的增加[23]。因此选择最适宜的脉冲电压为15 kV。
图6 电场电压对黄花菜多糖得率的影响Fig.6 Effect of electrical voltage on the yield of HCPS
2.1.5 超声功率对黄花菜多糖得率的影响 由图7可知,当超声功率在450~850 W范围内变动时,超声功率为650 W最接近此范围内的声化学产额的极值,此时多糖的得率最大,高于或低于650 W,多糖的得率都有所降低。出现这种现象的原因可能是:当超声功率低于极限值时,超声空化效应增强,当功率高于极限值时,体系中产生冲击波和微射流相互作用,通过反射或散射使彼此的能量衰减,相随而来的正声压相来不及被压缩至崩溃,空化时间减少。因此选择最适宜的超声功率为650 W。
图7 超声功率对黄花菜多糖得率的影响Fig.7 Effect of ultrasonic power on the yield of HCPS
2.1.6 脉冲频率对黄花菜多糖得率的影响 由图8可知,随着脉冲频率的变化,黄花菜得率的波动不大,当脉冲频率为1/600 s-1时,黄花菜多糖的得率达到最大9.61%。通过不断改变电压的正负来调整电场的方向,使电场中的离子可以不停做往返的定向运动,从而加快体系中物质的扩散速度。除此之外,电场方向的改变会引起空化泡形状的改变从而影响超声空化作用。由实验结果可知,当脉冲频率为1/600 s-1时,黄花菜多糖的得率最高,说明体系中电场和超声的耦合作用最强,因此选择最适宜的脉冲频率为1/600 s-1。
图8 脉冲频率对黄花菜多糖得率的影响Fig.8 Effect of pulsed frequency on the yield of HCPS
2.2 响应面对黄花菜多糖提取条件的优化试验
单因素实验结果帮助确定了响应面优化试验的因素和因素水平,综合超声协同矩形高压脉冲电场提取黄花菜多糖单因素实验的结果,在液料比为1∶25 (g/mL),脉冲频率为1/600 s-1的条件下,选取提取时间、提取温度、超声功率、电场电压四个对黄花菜多糖得率有显著影响的因素进行四因素三水平响应面优化试验[24-25]。
2.2.1 响应面结果及分析 响应面实验设计及结果见表2。对实验结果进行多重回归分析各个提取因素与多糖得率之间的关系,并对实验结果进行拟合,得到二次回归方程:

表2 Box-Behnken试验设计及响应面值Table 2 Box-Behnken experimental designand the response values
其中,Y为黄花菜多糖得率;X1、X2、X3、X4分别为提取时间、提取温度、超声功率、电场电压的编码水平。
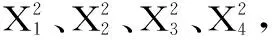
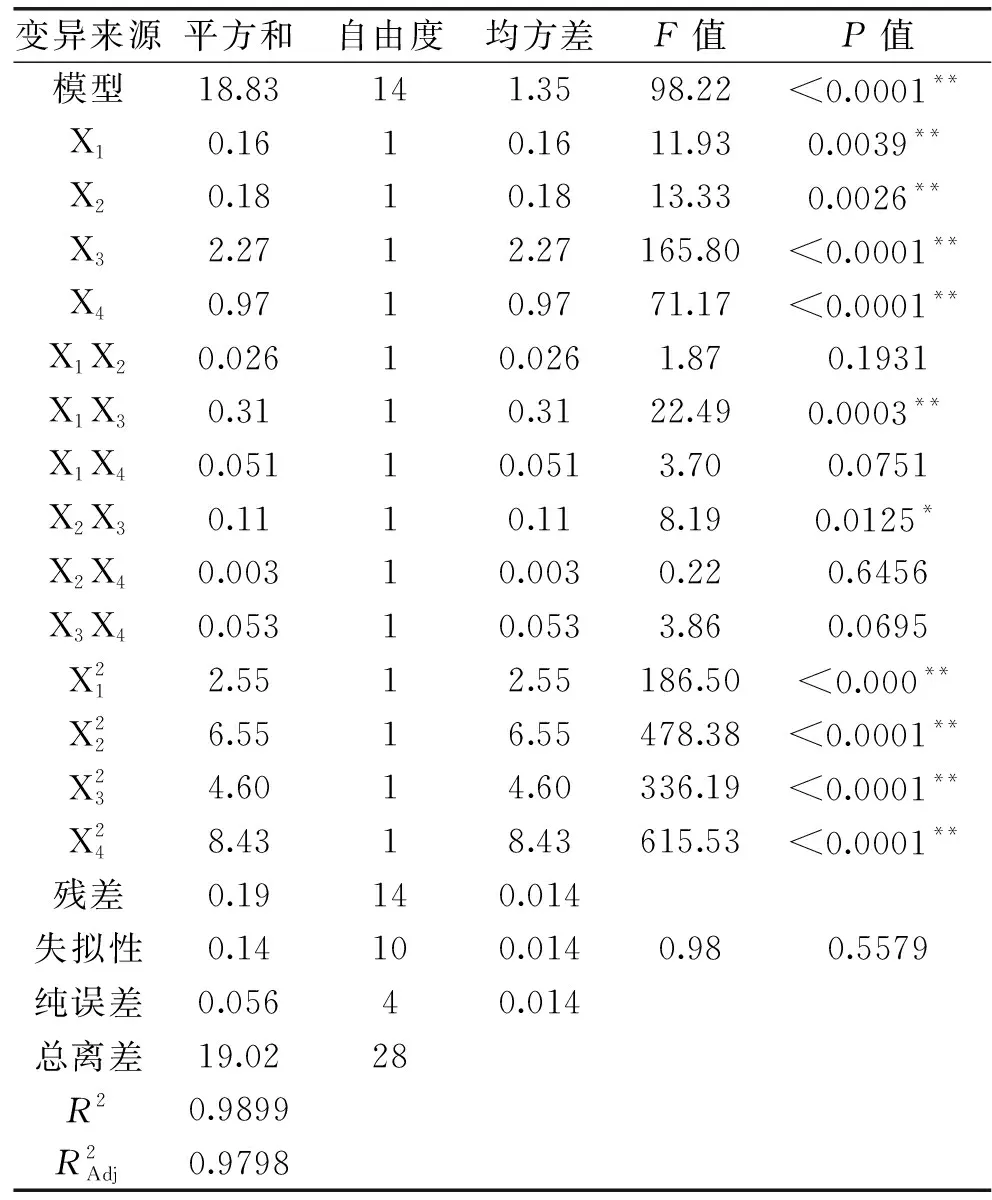
表3 方差分析结果Table 3 Results of variance analysis
2.2.2 因素间交互影响 根据回归方程利用Design-Expert软件绘制的等高线图和响应面分析图见图9,每个响应面3D分析图及其等高线图都表示当其中两个独立变量保持在0水平时,另外两个独立变量之间的交互作用。由图9可知,超声功率对黄花菜多糖得率的影响最为明显,因为其对应的曲线陡峭程度最高,其次是电场电压、提取温度,提取时间对黄花菜多糖得率的影响最小。从等高线中可以显示交互效应的强弱,圆形表示交互作用不显著,椭圆形则表示交互作用显著,由图9等高线图可以看出,提取时间与超声功率的交互作用对黄花菜多糖得率的影响最为显著,表现为等高线分布最密集,且图形为椭圆形[26-27];提取温度与超声功率之间的交互作用也较为显著。而提取时间与提取温度、提取时间与电场电压、提取温度与电场电压、超声功率与电场电压之间的交互作用并不明显。
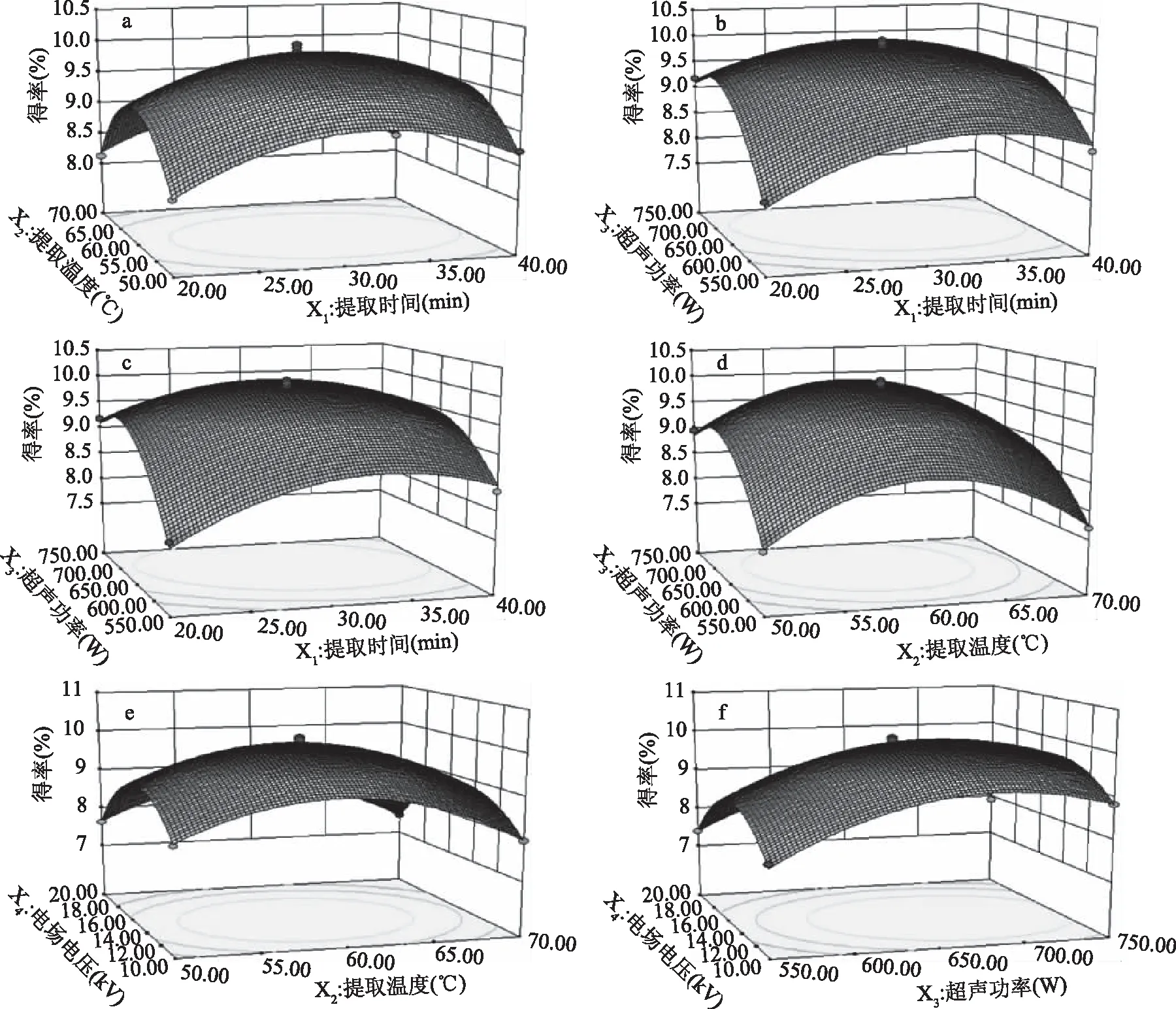
图9 各因素交互作用对黄花菜多糖得率的响应曲面图和等高线图Fig.9 Response surface diagram and contour diagram of the interaction of various factors on the yield of HCPS
为了得到最佳提取方案,对所得的回归拟合方程进行相应优化,选择黄花菜多糖得率最高的工艺参数组合作为最佳提取方案。结果表明,当提取时间为30.52 min,提取温度为59.11 ℃,超声功率为676.80 W,电场电压为14.29 kV时,黄花菜多糖的得率最高为10.07%。考虑到实际操作的可行性,将最优提取工艺改为提取时间30 min,提取温度59 ℃,超声功率700 W,脉冲电压14 kV,此条件下进行三次平行验证实验,每次实验测定两个平行值,实验结果分别为10.09%、10.13%、9.98%、10.19%、9.92%、9.85%,得到黄花菜多糖的平均得率为10.03%。与模型预测的得率相比,实验值与预测值之间没有显著差异(P>0.05),表明响应面优化分析得到的实验结果准确。
2.3 黄花菜多糖对超氧阴离子自由基的清除能力
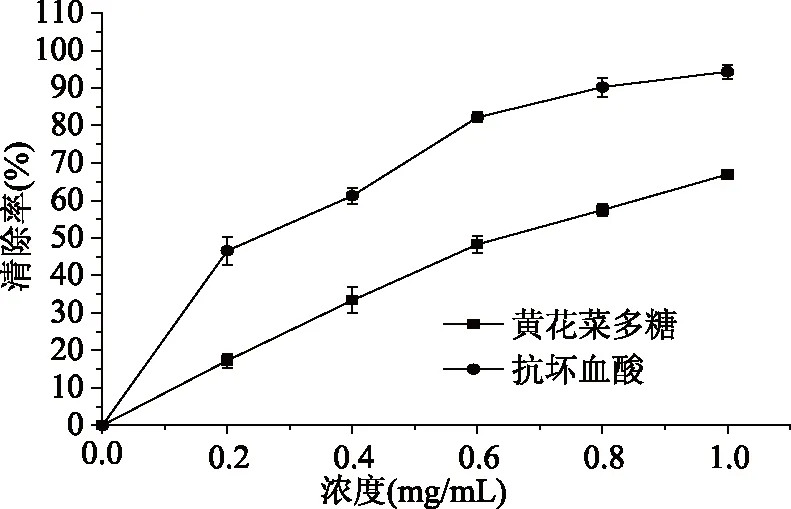
图10 黄花菜粗多糖超氧阴离子自由基清除能力Fig.10 The scavenging activity of HCPS
2.4 黄花菜多糖对·OH的清除能力
·OH在人体的含量最高,它能够杀死红细胞,降解DNA和破坏细胞膜,因此危害性最大。黄花菜多糖清除·OH的效果见图11。由图可知,黄花菜多糖清除·OH的能力最好。在0~1.0 mg/mL浓度范围内,其对·OH的清除率随浓度的增加而增加,具有一定的量效关系。当浓度为1.0 mg/mL时,黄花菜粗多糖对·OH的清除率可达70.61%,低于相同浓度的抗坏血酸的清除率。
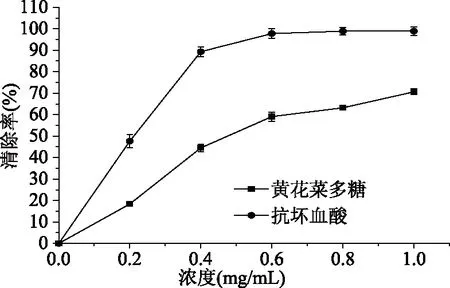
图11 黄花菜粗多糖羟基自由基清除能力Fig.11 The ·OH scavenging activity of HCPS
2.5 黄花菜多糖对DPPH·的清除能力
黄花菜多糖对DPPH·的清除能力见图12。在0.2~1.0 mg/mL浓度范围内,黄花菜粗多糖HCPS对DPPH·具有一定地清除能力,并且随着多糖浓度的增大,对DPPH·的清除能力也随之增大,呈一定的线性关系,当浓度为1 mg/mL时,黄花菜粗多糖对DPPH·的清除率为49.28%,而相同浓度条件下阳性对照组抗坏血酸DPPH·的清除率达到了95.75%,由此可知,与抗坏血酸相比,黄花菜多糖清除DPPH·的能力较弱。
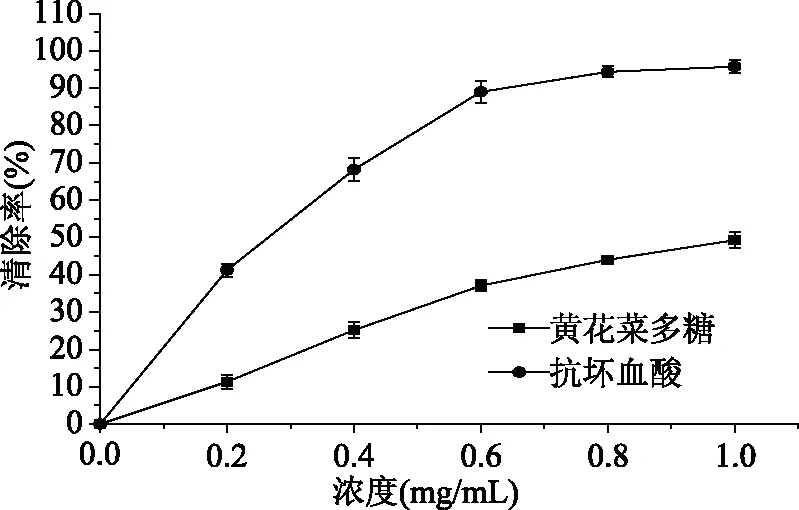
图12 黄花菜粗多糖对DPPH·的清除能力Fig.12 The DPPH free radical scavenging activity of HCPS
3 结论
在单因素实验的基础上,利用Box-Behnken响应面优化实验对超声协同矩形高压脉冲电场提取黄花菜多糖的提取工艺进行优化,结果如下:影响黄花菜多糖得率的各因素按其影响程度的大小排序依次为超声功率>电场电压>提取温度>提取时间,通过多重回归分析实验数据,得到最佳提取工艺为:提取时间30 min,提取温度59 ℃,超声功率700 W,脉冲电压14 kV,液料比1∶25 (g/mL),脉冲频率1/600 s-1。在此提取条件下黄花菜多糖的得率可达到10.03%,这对于提高多糖得率具有一定的指导意义。对黄花菜多糖的体外抗氧化活性进行研究可知,黄花菜多糖对DPPH自由基的清除效果不是很明显,但对超氧阴离子自由基和羟基自由基都具有一定的清除效果,并且清除羟基自由基的能力大于清除超氧阴离子自由基的能力,因此可以作为一种抗氧化剂加以利用。

