Ni系低温钢的高温氧化行为研究
曹光明, 高欣宇, 单文超, 潘 帅
(东北大学 轧制技术及连轧自动化国家重点实验室, 辽宁 沈阳 110819)
低温钢一般用来制造各种液化气体(例如LPG,LNG,液化乙烯、液氮等)的储运和生产设备.按照钢中有无镍元素,可分为无镍低温钢和含镍低温钢,其中含镍低温钢又称Ni系低温钢[1-5].Ni是Ni系低温钢中最主要的合金元素,Ni质量分数越高,其服役温度越低.Ni与铁的晶体结构相同,导致两者间的错配度小,因此Ni的直接强化作用较差.但Ni能够降低C原子的扩散激活能、提高其扩散系数,从而提高钢的强度[6].Ni系低温钢的发展和应用十分重要,但目前关于Ni系低温钢的研究主要集中在热处理过程中组织和低温韧性的演变,考虑其生产过程处于高温有氧条件下,钢材表面高温氧化现象不可避免,然而氧化所生成的氧化铁皮对产品的表面质量、使用性能影响重大,因此在Fe-Ni合金的高温氧化行为、机理等方面还有待进一步的研究.
钢的氧化速率主要由碳含量和合金元素控制.Ni元素对提高抗氧化性是有利的.加藤等[7]研究了Ni质量分数0~4.8%的钢材在900~1300 ℃干燥空气下的氧化行为,研究发现,Ni元素对抑制氧化有一定作用,即使Ni质量分数不足1%也会在氧化层中产生Ni富集,但Ni元素含量对铁氧化层的影响不大.Otsuka等[8]的结果表明,当Ni质量分数增加到12%以上时,Ni对氧化增重的影响尤为明显,单位面积氧化增重显著降低.800 ℃时干燥空气下进行氧化,Ni质量分数为12%的实验钢的氧化增重仅仅为Ni质量分数为6%的实验钢的氧化增重的0.5倍.此外,对于热轧生产过程,Ni元素的添加会大大降低合金钢的可除鳞性.陆关福等[9]研究了少量Ni、Cr元素对低碳钢氧化铁皮粘附性的影响,结果表明,Ni元素的存在显著增强了氧化铁皮的粘附性.
综上所述,目前针对Ni系低温钢的发展趋势是在保证使用性能的条件下向低Ni含量方向进行研究,而关于Ni元素对Ni系低温钢高温氧化行为研究较少,本文结合生产实际以3.5Ni和9Ni的Ni系低温钢为研究对象,利用热重法进行温度为700~1 200 ℃的高温氧化实验,对不同Ni含量条件下的Fe-Ni合金体系的高温氧化行为进行系统研究.
1 实验材料和实验方法
本文所用的实验钢为Fe-3.5Ni,Fe-9Ni系低温钢,其化学成分如表1所示.首先将试样加工成2.5 mm×5 mm×8 mm的长方体,为方便悬挂试样,需在试样一端钻取φ1.5 mm的孔洞,随后用超声波清洗机清洗试样表面油污,用砂纸打磨至5 000#,最后将试样置于盛有酒精的烧杯中进行震荡清洗,用吹风机吹干备用.实验设备为Setsys Evolution型高温同步热分析仪;将试样悬挂于加热炉内,对炉腔进行真空处理,待炉腔真空度满足要求后,迅速充入惰性气体高纯氩,流速为200 mL/min,直至炉腔内的压力与外界相同.设定升温速度为90 ℃/min,升温阶段仍以20 mL/min 的流速充入高纯氩.待TG升到设定温度进行恒温氧化阶段时,系统自动切换高纯氩为空气,流速由20 mL/min转换为100 mL/min,并保持恒定流速进行氧化,氧化时间为120 min,同设备自带的天平实时记录试样的重量变化.待试样氧化结束后,重新切换为20 mL/min的高纯氩保护,以90 ℃/min的冷却速率快速降至室温以保证氧化阶段试样的状态.
采用扫描电子显微镜(SEM)观察试样表面微观形貌,利用X射线光谱仪(EDX)分析表面物相,随后将试样进行热镶嵌,经过研磨、抛光和腐蚀后,利用电子探针(EPMA)和X射线能谱分析(EDS)表征氧化物微观形貌和物相组成.
2 结果与讨论
2.1 Ni系低温钢氧化增重
Fe-3.5Ni钢在不同氧化温度下的氧化增重曲线如图1所示.由图可知,在低温时(700 ℃和800 ℃)Fe-3.5Ni单位面积氧化增重低于4 mg,增重曲线较平缓,在整个氧化过程中接近直线规律.900 ℃时氧化增重量急剧上升,达到11.5 mg.随着氧化温度的升高,氧化增重趋势增大,在1 200 ℃ 时单位面积氧化增重达到最大值,为64.5 mg.此外,单位面积氧化增重曲线在初期阶段(0~10 min)呈现线性关系,而后呈现抛物线规律.这是由于第一阶段是快速氧化阶段,以“气-固”反应为主.第二阶段是慢速氧化阶段,以气相-氧化铁皮-固相反应为主.
图2为Fe-9Ni钢在不同氧化温度下的氧化增重曲线.与Fe-3.5Ni钢对比发现,在相同温度下,Fe-9Ni的增重量均低于Fe-3.5Ni钢.在不同温度下Fe-9Ni钢的氧化增重曲线与前者相似.

图1 实验钢Fe-3.5Ni氧化增重相关曲线

图2 实验钢Fe-9Ni氧化增重相关曲线
2.2 Ni系低温钢高温氧化产物表面形貌
Fe-3.5Ni钢在700~1 200 ℃氧化120 min后的试样表面微观形貌如图3所示.氧化温度较低时(700 ℃),试样表面出现不均匀生长的小颗粒状或团絮状的氧化物,并在其上方生长出一层新的晶须状氧化物.从图3b中可明显看出血小板状氧化物均匀分布在试样表面;当温度升高至900 ℃以上时,试样表面氧化物晶粒呈现不规则多边形状,且随着温度升高,氧化物的晶粒尺寸变大.当温度升至1 200 ℃时,连续的氧化物层分布在试样表面.试样表面颗粒状、晶须状以及多边形状的氧化物均为Fe2O3[10].经相同氧化条件后的Fe-9Ni钢微观表面形貌与Fe-3.5Ni钢相似,因此在这里没有示出.

图3 Fe-3.5Ni钢在700~1 200 ℃氧化120 min的微观表面形貌
2.3 Ni系低温钢高温氧化产物断面形貌
图4为Fe-3.5Ni在不同温度下氧化120 min 后的断面形貌.可以清楚地观察到氧化层分为内氧化的镍富集区和外氧化的氧化铁皮层.700 ℃时氧化铁皮约为21 μm.800 ℃时氧化铁皮生长至38 μm.随着氧化温度的升高,氧化铁皮厚度逐渐增加,当氧化温度为1 200 ℃时,氧化铁皮厚度达到最大,约为410 μm.此外,基体与氧化铁皮层之间的内氧化层在700~800 ℃时以点状和树枝状形式存在,并随温度升高,逐渐向内生长;当温度达到900 ℃以上时,内氧化形态不发生改变,Ni富集层以层状结构为主.图5为Fe-9Ni 钢在相同条件下氧化后的断面形貌,其形态与Fe-3.5Ni 钢相似,分为内氧化层和外氧化层.

图4 Fe-3.5Ni钢在不同氧化温度下氧化铁皮断面形貌

图5 Fe-9Ni钢在不同氧化温度下氧化铁皮断面形貌
图6所示为Fe-3.5Ni钢关于镍元素、氧元素的面扫描图.700 ℃时,Ni元素已开始在铁氧化层与基体间形成富集,此时Ni的富集以点状物存在.800 ℃ 时Ni元素以网状结构存在.晶界是元素扩散的快速通道,铁元素亲氧能力强于镍元素,铁元素率先向外扩散与氧反应生成铁氧化物,镍元素也沿着晶界向外扩散,但由于镍元素相比较铁元素难以氧化,继而在铁氧化物内侧形成富镍层.900 ℃时镍富集层继续增多以层状结构存在,且Ni元素分布均匀.

图6 Fe-3.5Ni钢氧化铁皮成分面扫描分析
对Fe-9Ni钢1 000 ℃氧化后的试样进行XRD分析,结果如图7所示,试样表面氧化铁皮中所存在的物相包括Fe2O3,Fe3O4,FeO,NiO和NiFe2O4.
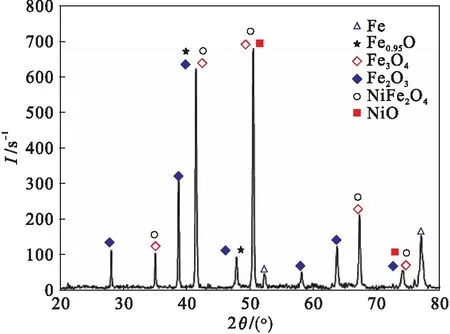
图7 Fe-9Ni钢1 000 ℃氧化后氧化铁皮XRD分析
两种实验钢的内外氧化层的厚度统计结果如图8所示.随着氧化温度的升高,内、外氧化层厚度均增大,当温度升高至900 ℃时,镍富集层不再为点状或树枝状,而形成由密集点状组成的连续且致密的片层状,阻碍了离子的扩散,使得900 ℃时外氧化层厚度发生突变.当低于900 ℃时,温度对内、外氧化层的厚度影响较小,厚度曲线较为平缓,3.5Ni与9Ni钢的内外氧化层厚度相差较小;当温度高于900 ℃时,内外氧化层厚度差均增大,相同温度下,3.5Ni钢的镍富集层厚度小于9Ni的镍富集层,而铁氧化层厚度大于9Ni的铁氧化层厚度.
从图4中可看出,Fe-3.5Ni钢在700~1 100 ℃氧化2 h后,外氧化层为典型的三层结构,分别为最外层的Fe2O3、中间层的Fe3O4和内层的FeO.然而,当氧化温度达到1 200 ℃时,氧化铁皮层中Fe2O3和FeO比例较少,主要为Fe3O4.此外,当氧化温度为1 100 ℃时,在内层的FeO上分布着岛状的Fe3O4,在中间层的Fe3O4和内层的FeO界面处及岛状的Fe3O4附近分布着尖晶石状的白色氧化物,如图9所示,EPMA-EDS分析结果如表2所示,A点的白色的氧化物为NiFe2O4.相同的,当氧化温度为1 200 ℃时,FeO上岛状Fe3O4附近也可观察到NiFe2O4.内氧化的镍富集区断面形貌如图10所示,EPMA-EDS分析结果表明B点灰白色相的成分为24.13Fe和75.87Ni(质量分数,%),C点黑色相的成分为48.37Fe和51.63O(质量分数,%),D点黑色相的成分为41.26Fe和58.74O(质量分数,%),因此内氧化的镍富集区由黑色氧化物(FeO+Fe3O4)和灰白色相FeNi3组成.
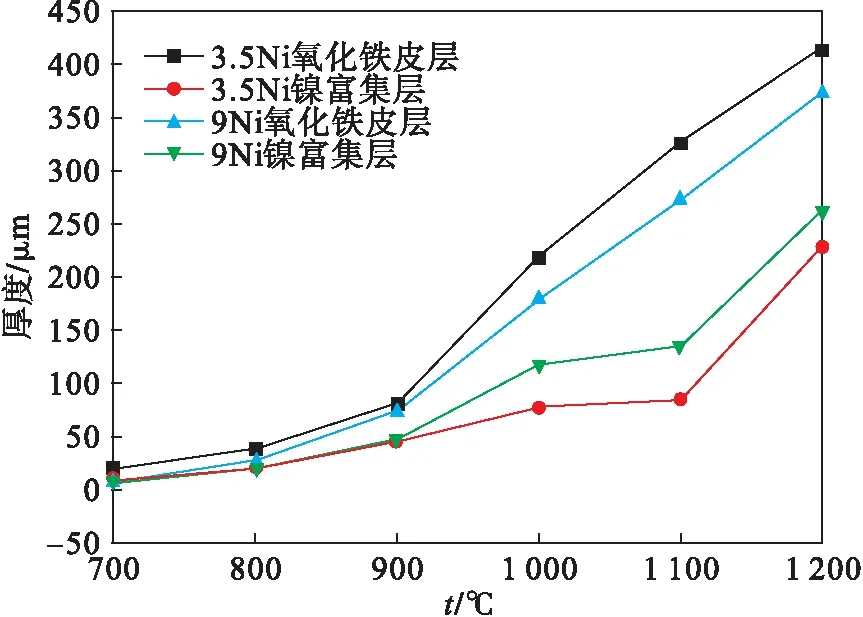
图8 不同实验钢氧化铁皮层、镍富集层厚度对比

图9 尖晶石状白色氧化物NiFe2O4

表2 氧化铁皮断面形貌的能谱分析(质量分数)

图10 内氧化层的断面形貌
Fe-9Ni钢在700~1 100 ℃氧化2 h后,外氧化层仍为典型的氧化铁皮三层结构,内氧化层为镍富集区,如图5所示.与Fe-3.5Ni钢不同的是,1 000 ℃时,在Fe3O4和镍富集区界面处出现白色氧化物NiFe2O4薄带且FeO内岛状分布的Fe3O4周围出现零星的NiFe2O4.当温度升高至 1 100 ℃ 时,NiFe2O4薄带厚度增加,且NiFe2O4相开始大量向Fe3O4内部生长.
2.4 Ni系低温钢高温生长动力学
式(1)为氧化增重量与氧化速率常数的数学表达式[11],利用氧化增重数据可计算出不同温度下的氧化速率常数kw,见表3.
(1)
式中:Δg为氧化增重量(mg);S为实验试样的表面积(cm2);t为氧化时间(s);kw为抛物线速率常数(mg2·cm-4·s-1).
氧化速率常数kw随氧化温度的升高而增大.根据Arrhenius公式,kw可表示为[12]
(2)
式中:Q为实验钢的氧化激活能,J/mol;R为气体常数,8.314 J/(mol·K);T为氧化温度,K;A为模型常数.由此可见,氧化温度是影响氧化速率常数的重要因素,氧化温度愈高,氧化速率愈大.
对式(2)等号两边取对数得
(3)
图11给出了实验钢的氧化激活能,实验钢Fe-3.5Ni的氧化激活能Q值为147 kJ/mol,而Fe-9Ni在高温氧化时氧化激活能为189 kJ/mol,相比较Fe-3.5Ni,氧化激活能Q增大.氧化激活能Q值的大小反映氧化的难易程度,Q值越大,表示氧化反应越难进行.因此随着Ni含量的增加,实验钢越难被氧化,对应氧化铁皮的厚度越薄.

表3 不同温度下Fe-3.5Ni和Fe-9Ni的氧化增重速率常数
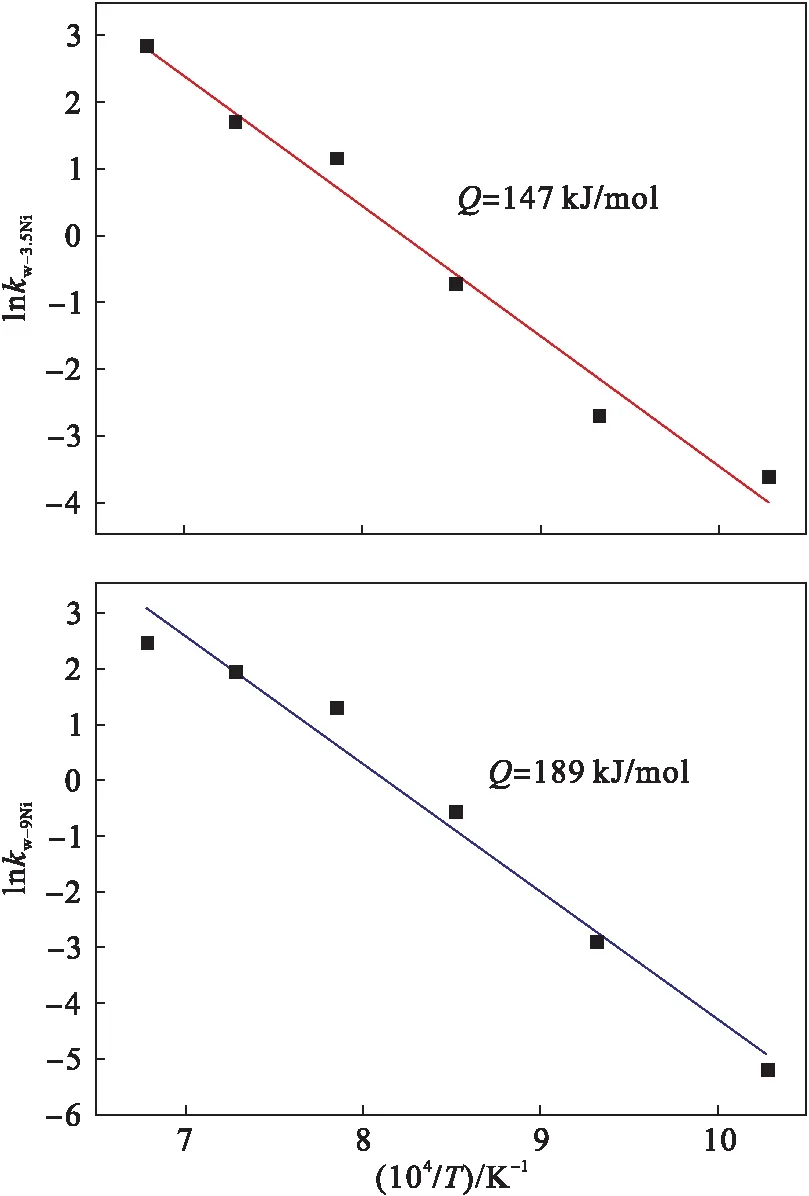
图11 实验钢Fe-3.5Ni和Fe-9Ni的高温 氧化Arrhenius曲线
2.5 Ni系低温钢高温腐蚀速率
利用金属高温氧化的腐蚀厚度同样可计算出金属的内氧化速率常数、外氧化速率常数及腐蚀速率常数[13].如前所述,建立内氧化动力学模型:
(4)
式中:Xi为内氧化层厚度,本文中为Ni富集层厚度;ki为Ni富集速率常数.
建立外氧化动力学模型:
(5)
式中:Xp为外氧化层厚度,本文中为外侧氧化铁皮层厚度;kp为铁氧化速率常数.
统计实验钢种各氧化层的厚度,将数值代入式(4),式(5)中计算,得出实验钢种的kp,ki,如图12所示.可以看出,随着温度的增加,kp,ki均增加,且ki和kp的变化趋势与图8中各层的厚度变化趋势相似.
腐蚀速率常数kc与铁氧化速率常数kp之间存在一定关联[13].因此,可以通过计算得出的kp求出kc,计算方法如下:
(6)
FeO,Fe3O4是氧化铁皮的主要成分,在此取两者的PBR(合金上氧化物的体积比)的平均值.两者的PBR分别为1.72,2.10,故在此PBR取1.91.将图12中的kp代入到式(6)中,即可求出腐蚀速率常数kc,见图13.通过对比图中的数据发现,不同温度下Fe-3.5Ni的腐蚀速率常数kc均大于Fe-9Ni的值,这与Fe-3.5Ni钢的增重量大于Fe-9Ni钢的结果一致.同时随着温度的升高,不同钢种的腐蚀速率常数kc的差值增大,即不同温度下氧化增重量差值也逐渐增大.此外,通过观察图12中实验钢种腐蚀速率常数kc可以发现, 900℃时腐蚀速率常数kc迅速增大,导致氧化铁皮厚度迅速增加,这与图4和图5中的观察结果一致.
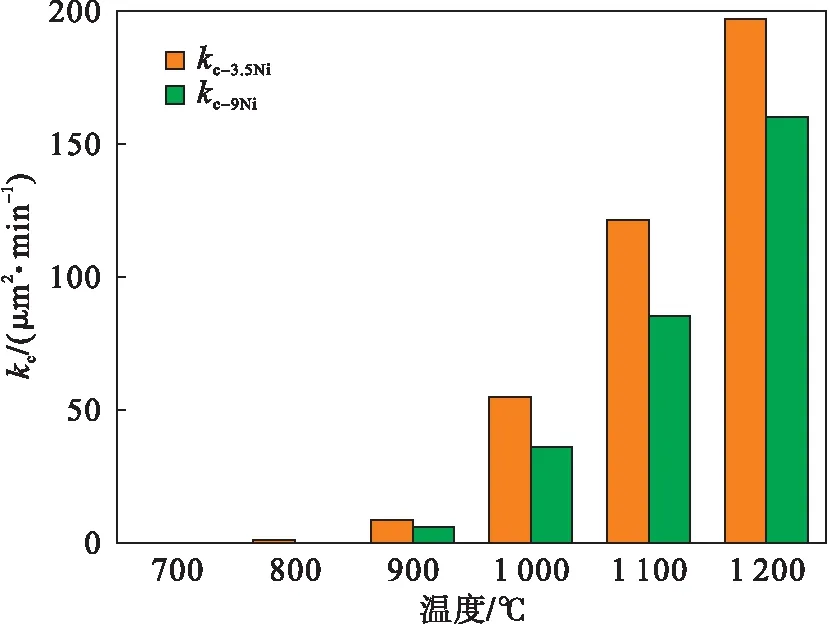
图13 腐蚀速率常数kc
2.6 Ni系低温钢高温氧化机理
Ni元素对氧化铁皮形成及影响机理如图14所示.考虑到铁与氧的亲和力强于镍与氧的亲和力,因此在高温氧化过程中铁离子优先与氧离子发生反应.如图14a所示,高温氧化初期阶段,氧气直接与钢基体接触,氧亲和力强的铁离子与氧气反应生成铁氧化物,如式(7)所示:
(7)
此时由于氧化时间极短,铁氧化物没有充足时间形成连续的氧化层,只是在试样表面形成局部的铁氧化物.与此同时,氧气继续向内扩散,铁离子和镍离子沿着晶界向外扩散.
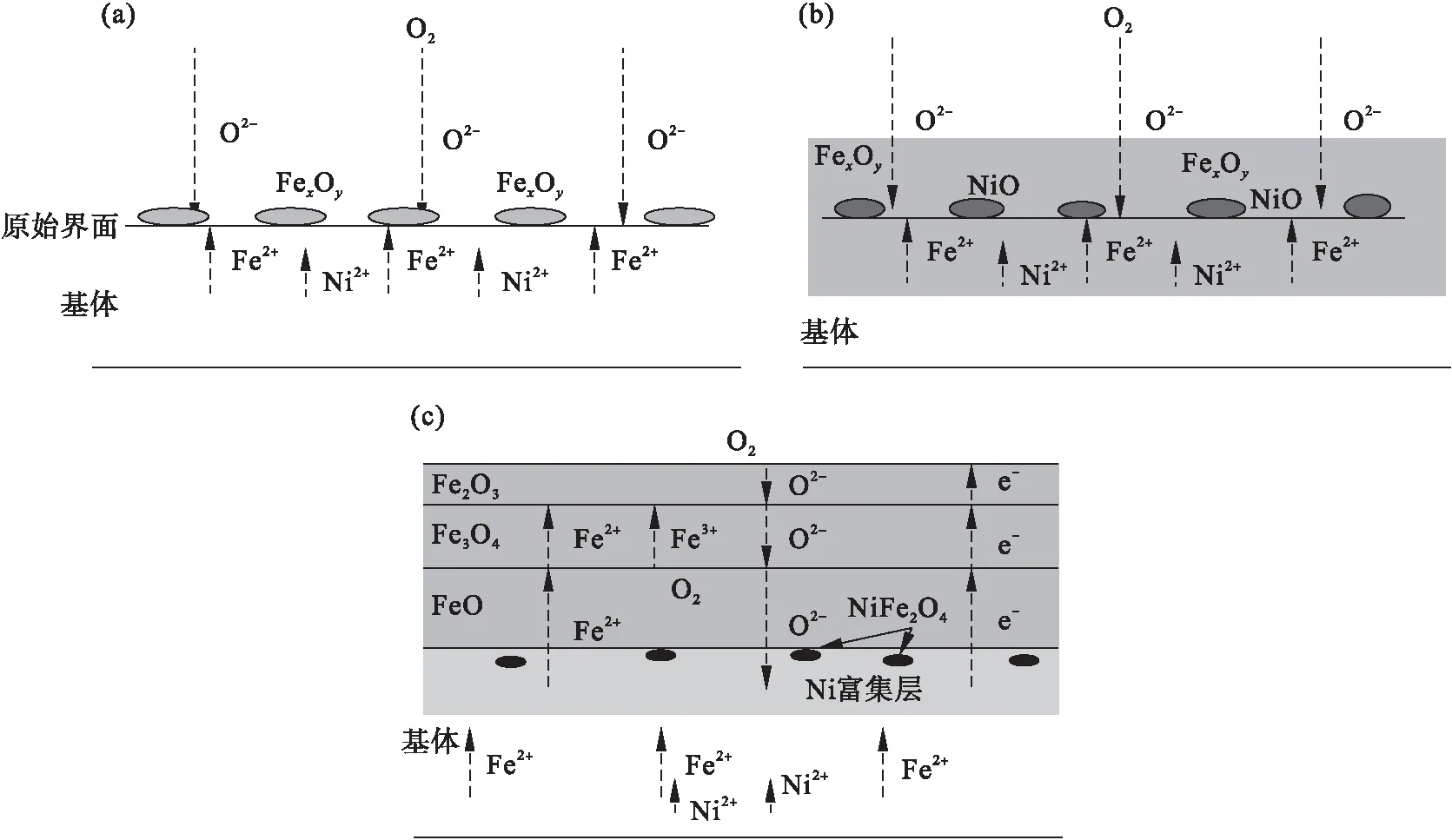
图14 Ni元素对氧化铁皮影响机理图
随着氧化时间的延长,铁氧化物逐渐增多、尺寸变大,覆盖在钢体积表面.此时向内扩散的氧离子与向外扩散的阳离子之间的化学反应依旧占据着主导作用.镍离子与氧气反应,生成少量NiO,其反应如式(8)所示.随着氧化反应的进行,含量较高、氧亲和力较强的铁元素反应较多,生成层状氧化层,将生成的少量NiO包裹在内侧.此过程如图14b所示.此时,直接接触的化学反应不再占据主导作用,元素的扩散成为了氧化物的主要来源,氧化速率逐渐降低.
2Ni+O2=2NiO .
(8)
随着氧化过程的继续,镍离子、铁离子向外扩散,氧离子向内扩散,氧化铁皮层的厚度逐级增加,镍富集层的厚度也随之增大.此时,一方面由基体内部扩散而来的铁与包裹在氧化层内部的NiO发生“吸氧反应”生成Fe2O3,如式(9)所示:
3NiO+2Fe=3Ni+Fe2O3.
(9)
另一方面,随着镍富集区厚度的增加,铁和镍的扩散路径变长,氧化铁皮内部形成“富氧贫铁区”,聚集在氧化层内的镍元素与氧离子反应生成的NiO的量逐渐变多,NiO进一步与Fe2O3反应生成尖晶石结构NiFe2O4,反应如式(10)所示.随着Ni质量分数增大,镍富集区的厚度进一步增大,形成的NiFe2O4的量增多,进而形成白色氧化物NiFe2O4薄带.
NiO+Fe2O3=NiFe2O4.
(10)
此外,由于氧化铁皮内的Fe3O4是FeO和Fe2O3的化合物,如式(11)所示,因此在氧化铁皮内的岛状Fe3O4附近、FeO与Fe3O4界面附近也可见弥散分布的白色氧化物NiFe2O4.
Fe3O4→FeO+Fe2O3.
(11)
如前所述,镍元素增多,氧化铁皮厚度略微减薄.这是由于镍元素本身与氧的亲和力差,不能先于铁氧化而形成保护性氧化膜;随着镍质量分数增大,在内侧形成的镍富集层相对变厚,铁离子和氧离子扩散的距离增大、时间变长;同时尖晶石状化合物NiFe2O4结构致密,进一步降低了铁离子的向外扩散,降低氧化速率,进而在一定程度上延缓了氧化反应.
3 结 论
1) 在相同氧化温度条件下,Fe-3.5Ni和Fe-9Ni 钢具有相似的氧化增重曲线规律,但Fe-9Ni钢的增重量低于Fe-3.5Ni钢.
2) 随着氧化温度升高时,试样表面依次出现团絮状、晶须状和不规则多边形状氧化物.随着温度进一步的升高,多边形Fe2O3晶粒尺寸逐渐增大.Ni含量越高,氧化铁皮的形成和生长更加均匀.
3) 随Ni含量的升高,外氧化层厚度降低,而内氧化层厚度增加.低于900 ℃时,温度对外氧化层的厚度影响较小;高于900 ℃时,外氧化层厚度明显增加.
4) 内氧化层由灰白色FeNi3和灰色氧化物(FeO+Fe3O4)组成,外氧化层由最外层的Fe2O3、中间层的Fe3O4和内层的FeO组成,且在较高温度下,岛状Fe3O4附近、FeO和Fe3O4界面处可生成化合物NiFe2O4,且Ni含量越高,越易生成NiFe2O4.

