碳硫质量比及碳源种类调控重力排水管道内甲烷及硫化氢排放特征
时 红, 郑杰荣
(太原理工大学环境科学与工程学院,太原 030024)
排水管网是城市公共设施的重要组成部分,其承担污水和雨水的收集与输送任务[1]。随着城镇化进程的不断加速,城镇排放的污水水量也随之增加。排水管网中特定的环境易富集众多微生物如产甲烷菌及硫酸盐还原菌,从而在污水在输送过程中产生甲烷及硫化氢(H2S)[2]。据报道,排水管网中甲烷排放量约占全球5%[3]。而H2S不仅属于恶臭气体,而且还能腐蚀混凝土管道,给城镇公共设施产生巨大危害。研究表明在澳洲,每年因治理H2S腐蚀混凝土管道费用约为10亿美元。因此有效控制排水管网中甲烷及H2S的产生已成为研究的热点[4]。
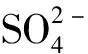
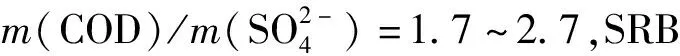
1 材料与方法
1.1 实验装置及运行
实验采用的装置为实验室搭建的聚氯乙烯(PVC)重力排水管道,两端设有总体积为30 L,有效体积为25 L的储水箱,中间采用排水管道连接,排水管道的长度为12.0 m,内径为60 mm,坡度约为5‰,在管道内部水面以下设有生物膜载体以便生物膜生长及形成。此外,通过回流蠕动泵将低水位贮水箱中的水再次回流至高水位水箱,排水管道内部水流速度约为0.6 m/s,排水管网内电子液压系统控制为-300~-350 mV,温度控制为35 ℃,pH通过高水位水箱内人工添加2.0 mol/L HCl或者NaOH维持在6.5~7.5。
1.2 污水水质
高水位水箱污水采用人工配水,以乙酸钠和丙酸钠(质量比为2:1)为混合碳源,进水化学需氧量(COD)的浓度约为600 mg/L。整个运行周期约为120 d,该时期平均分为四个阶段(阶段Ⅰ、Ⅱ、Ⅲ和Ⅳ),在阶段Ⅰ~Ⅳ中,控制进水硫酸盐(以Na2SO4计)的质量浓度,并保持m(C)/m(S)约为4、8、12和16。为了真实模拟实际污水,人工合成废水中还含有KCl 12.0 mg/L、NH4Cl 60 mg/L、CaCl210 mg/L,NaHCO360 mg/L。此外,每阶段进水中还包含100 mL的微量元素,微量元素的基本组成如下:1.5 g/L CuSO4、0.6 g/L H3BO3、FeCl3·6H2O、MnCl2·4H2O。此外还设置实验探究乙酸盐,丙酸盐为单独碳源及乙酸盐和丙酸盐混合碳源对H2S释放的影响。为了保证重力排水管网中厌氧环境,在实验开始前向管网内充入氮气以排净空气保证溶解氧低于0.1 mg/L。
1.3 分析方法
甲烷分析采用气相色谱法测定,气相色谱仪配有热导检测器(TCD)色谱柱型号选为TDX-1填充柱,载气为氮气,柱温为80 ℃,进样口温度为100 ℃,检测器温度为100 ℃。此外,污水中还可能含有溶解性甲烷,在实验过程中取50 mL污水,进行溶解性甲烷和COD含量测定,详细的测定方法见文献[4]。研究中污水pH基本维持在6.5~7.5,因此溶解性H2S可忽略不计[9]。在排水管网上端设有气体采集口,气体采集口处配有夹子及集气袋。微生物群落结构分析:完成测试后,取各种工况下生物膜进行微生物群落结构分析。微生物结构分析主要由环境样品DNA抽取,设计合成引物接头,PCR扩增,PCR产物定量与均一化,构建PE文库以及Illumina测序,详细的测定过程见文献[11]。
2 结果与讨论
2.1 m(C)/m(S)对甲烷、H2S产量及COD去除的影响分析
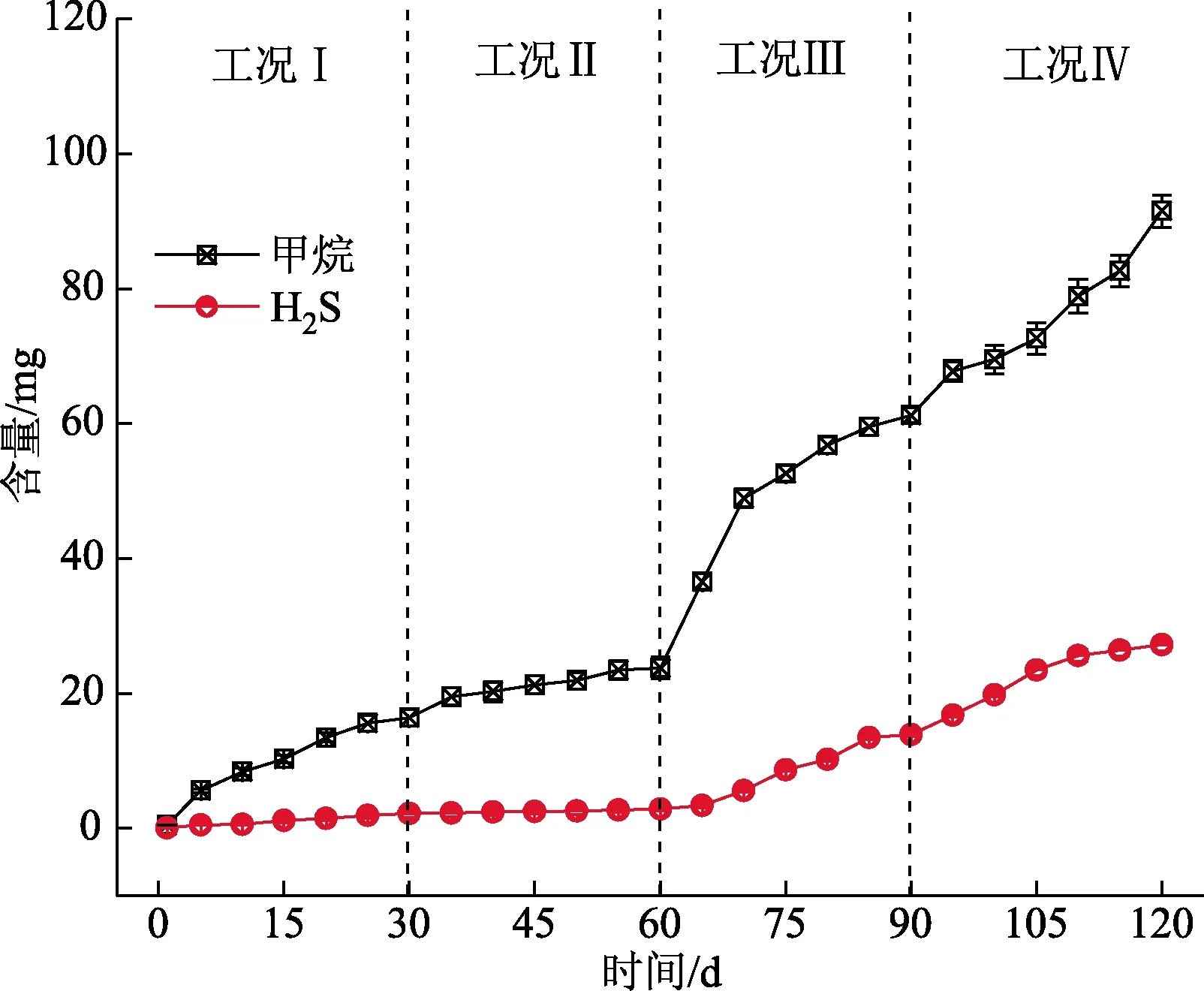
图1 各阶段下重力排水管中甲烷及H2S释放量比较
图1展示重力排水管长期运行中不同工况下甲烷及H2S的排放情况,可知,各工况下甲烷及H2S产生量随时间呈现出上升的趋势。在低m(C)/m(S)比(阶段I)时,甲烷产生量较低,甲烷产量随反应时间延长至30 d时,甲烷积累产量仅为15.9 g,H2S积累量为0.9 g。在反应时间为31~60 d,甲烷和H2S的积累量较缓慢,在阶段Ⅱ内,甲烷和H2S的积累量分别为7.4、0.3 g,分别时阶段Ⅰ的46.5%和33.3%,上述实验结果表明适当升高m(C)/m(S)有助于降低反应体系内甲烷和H2S的积累。在阶段Ⅲ中,m(C)/m(S)进一步升高至12,而此阶段内甲烷和H2S的积累分别升高至37.4、10.5 g,说明过量m(C)/m(S)能够促进甲烷和H2S的排放。当进入阶段Ⅳ时,m(C)/m(S)进一步升高至16,此阶段内甲烷和H2S量同阶段Ⅲ相似,甲烷和H2S释放量分别为35.9、9.8 g。上述实验结果表明过高m(C)/m(S)导致甲烷和H2S的释放与积累。
图2进一步展示了各阶段出水COD含量及其去除效率。由图2可知,m(C)/m(S)由4升高至8时,出水COD的含量由258 mg/L升高至280 mg/L,相应的去除效率由56.9%下降至53.2%。当m(C)/m(S)进一步升高至12和16时,出水COD的浓度呈现下降趋势并下降至214 mg/L和189 mg/L,相应的COD去除效率升高至64.2%和68.5%。m(C)/m(S)升高至12和16导致COD去除效率升高的原因可能在于模拟管道内异养微生物增多,且SRB代谢消耗所致。
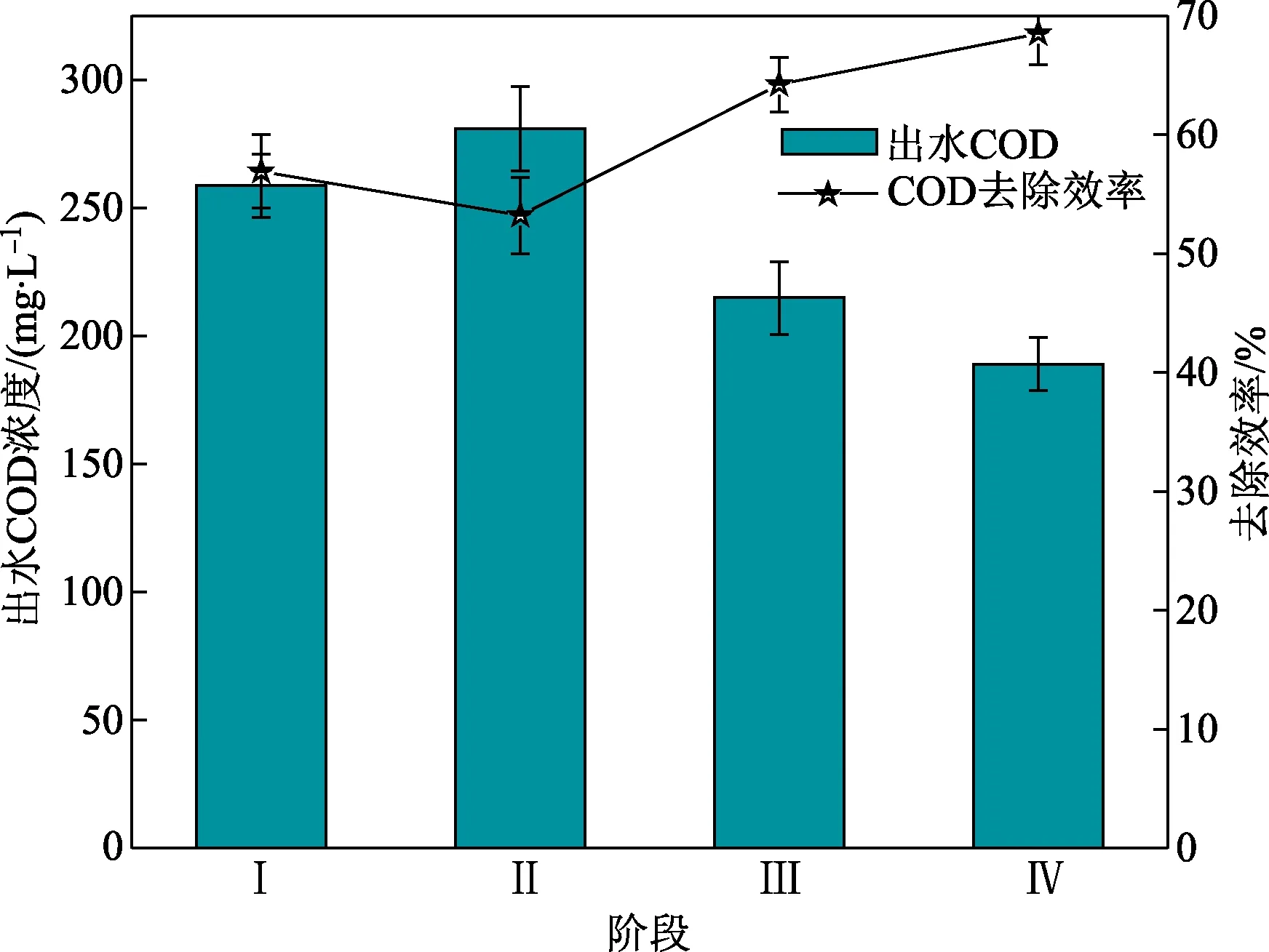
图2 各阶段出水COD及其去除效率
2.2 m(C)/m(S)对各阶段生物膜内产甲烷古菌及硫酸盐还原菌的影响
m(C)/m(S)是影响产甲烷古菌和硫酸盐还原菌竞争碳源的关键参数,因此,m(C)/m(S)对排水管网内壁生物膜种群群落结构至关重要[12]。细菌序列长度是微生物群落特征的一个重要参数,表1所示,m(C)/m(S)由4升高至8时,细菌序列长度由38 912降低至31 556,说明反应体系中细菌丰度下降。而m(C)/m(S)进一步升高至12和16时,细菌序列长度也随之升高至41 581和42 569,说明细菌丰度增加。

表1 m(C)/m(S)对重力排水管网中生物膜细菌序列长度的影响
图3进一步展示了各阶段稳定运行时期微生物群落特征。如图3所示,Methanobacterium,Terrestrial-Miscellaneous-Gp-TMEG和Methanothermobacter是产甲烷古菌的重要菌属,其能够充分利用水体中乙酸或者氢气合成甲烷。当m(C)/m(S)=4时,Methanobacterium、Terrestrial-Miscellaneous-Gp-TMEG和Methanothermobacter的占比分别为5.9%、10.3%和10.3%,而当m(C)/m(S)进一步升高至8时,上述关键均属相对丰度则下降至6.1%、10.4%和10.6%,说明m(C)/m(S)的升高提高了产甲烷古菌的相对丰富。而当m(C)/m(S)进一步提高至12时,Methanobacterium、Terrestrial-Miscellaneous-Gp-TMEG和Methanothermobacter的占比进一步提高至6.5%、11.2%和11.3%,该实验结果与甲烷产量相一致。Desulfonema作为硫酸盐还原菌中的绝对优势菌种在不同m(C)/m(S)条件下占比为 4.8%~5.6%,并且随着m(C)/m(S)升高,Desulfonema的相对丰度呈现上升趋势。Desulfotomaculum和Desulfovibrio同样是H2S生产的重要菌属,其生活习性是相似,在适宜的环境下(pH为6.8~7.5,温度30~35 ℃)都是利用苹果酸和磺酸盐产生硫化氢[13-14]。Desulfonema可以利用丙酸等小分子脂肪酸作用电子供体合成H2S,Desulfonema相对丰度的下降是m(C)/m(S)升高导致H2S释放量下降的原因之一。
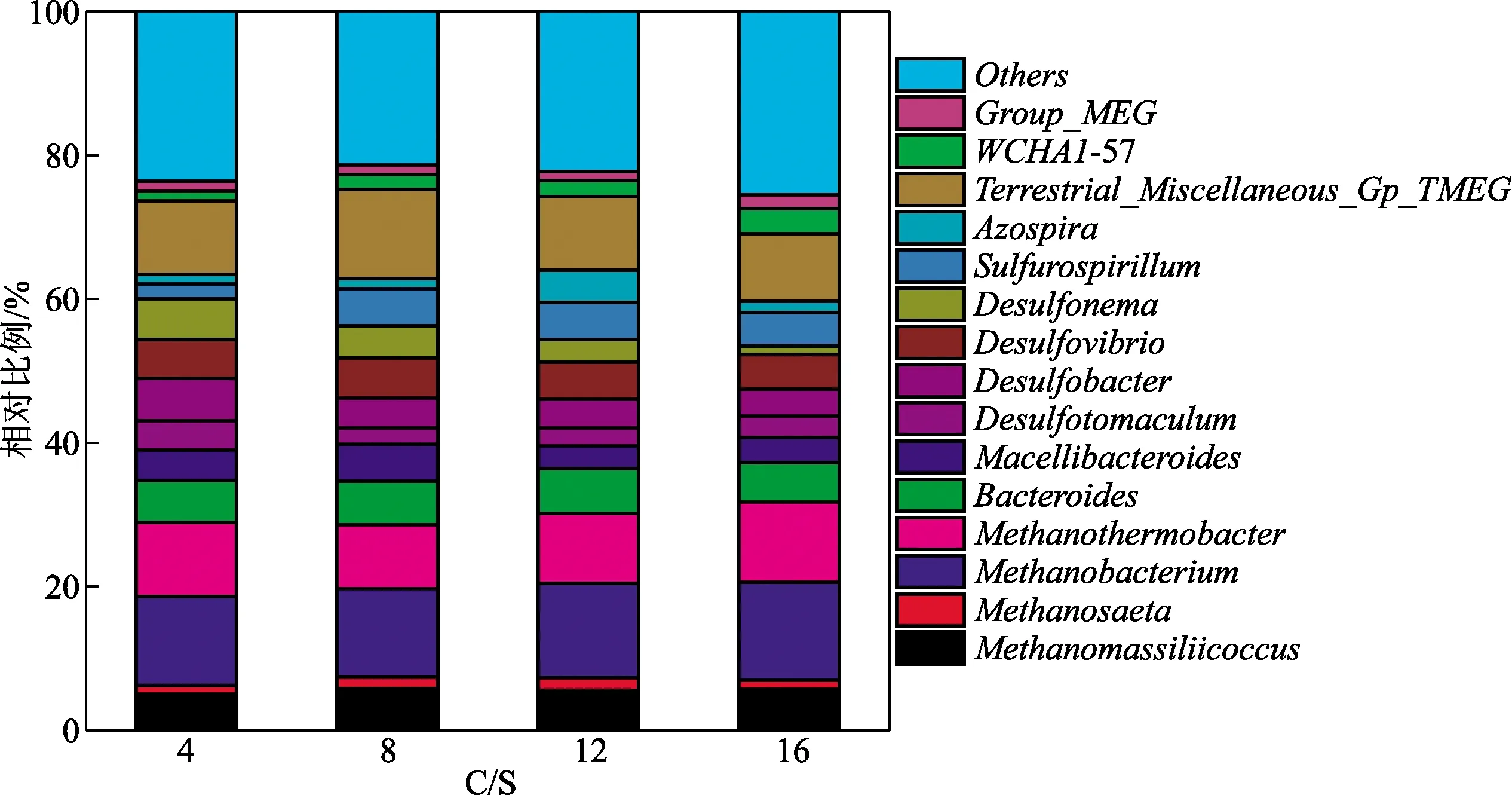
图3 m(C)/m(S)对重力排水管网生物膜微生物群落特征的影响
2.3 底物类型对产甲烷古菌和硫酸盐还原菌竞争的影响
氢气和乙酸是SRB与MA竞争的电子供体,污水管网中氢气含量较低,因此本研究重点探究SRB与MA对排水管网中VFA(主要为乙酸盐和丙酸盐)竞争的影响。图4为乙酸为碳源时,反应周期内乙酸盐的含量随时间呈现下降趋势,并且在15 d后乙酸盐的减少量逐渐变小,在25 d时,乙酸盐的含量为101 mg/L。与此同时,硫酸盐的含量同样呈现下降趋势,并且在时间为25 d时,硫酸盐的含量下降至50 mg/L。H2S含量由0增加至7.2 mg,需要注意的是H2S在前10 d内释放速率较快,释放速率约为0.56 mg/d,而在后期H2S的释放速率基本维持在0.11 mg/d。说明当乙酸盐为唯一碳源时,重力排水管网中H2S的产量较低,并且H2S的释放主要集中于前10 d。在图4(b)中展示丙酸盐为唯一碳源对H2S释放的影响。丙酸盐的含量随时间同样呈现下降的趋势,同样在前10 d,丙酸盐的含量迅速下降至198 mg/L,丙酸盐的降解速率约为19.8 mg/(L·d),与此对应的硫酸盐的含量同样迅速下降,并且在10 d下降至79 mg/L。SRB会利用碳源提供了电子将硫酸盐还原为H2S,H2S的产生量随时间呈现出先急剧上升后缓慢上升的趋势。H2S在前15 d内的产量约为8.7 mg,H2S的产生速率约为0.57 mg/d,与乙酸盐作为碳源前10 d H2S的释放速率相近。当以丙酸盐为碳源时,反应体系中检测到乙酸盐。乙酸盐的含量随时间呈现出先上升后下降的趋势,乙酸盐的含量最高值为72 mg/L,然后乙酸盐的含量逐渐降低。上述实验结果表明SRB首先利用反应体系内的丙酸盐还原硫酸盐产生H2S。此外,反应体系中还存在同型产乙酸菌,该类菌群利用丙酸盐合成乙酸,这也是导致丙酸盐含量下降的原因之一。在丙酸盐为碳源的系统中,H2S的最大产量为10.3 mg,显著高于以乙酸盐为电子供体的系统,说明相较于乙酸盐,SRB更能利用丙酸盐还原硫酸盐。
在实际废水中碳源多以乙酸盐和丙酸盐混合,图5进一步探究了m(C)/m(S)=4,初始pH=7.0 时,乙酸盐和丙酸盐混合(质量比为1:1)重力排水管网中碳源,硫酸盐及H2S含量的变化。如图5所示,初始乙酸盐和丙酸盐的含量均为250 mg/L,硫酸盐的含量为125 mg/L。随反应时间,乙酸盐和丙酸盐及硫酸盐的含量呈现下降趋势,在前15 d,乙酸盐的含量下降至165 mg/L,其利用率约为34%,而此时丙酸盐的含量则下降为102 mg/L,丙酸盐的利用率约为59.2%,显著高于乙酸盐。上述结果表明在乙酸盐和丙酸盐混合体系中,SRB对混合体系中丙酸的利用较高。硫酸盐的含量随时间逐渐下降,并且在15 d时下降至85 mg/L,该含量同样高于丙酸盐为单一碳源体系,说明在混合碳源体系中硫酸盐的还原率下降。在混合碳源体系中,H2S的最大产量为9.4 mg,处于乙酸盐和丙酸盐单一碳源之间。
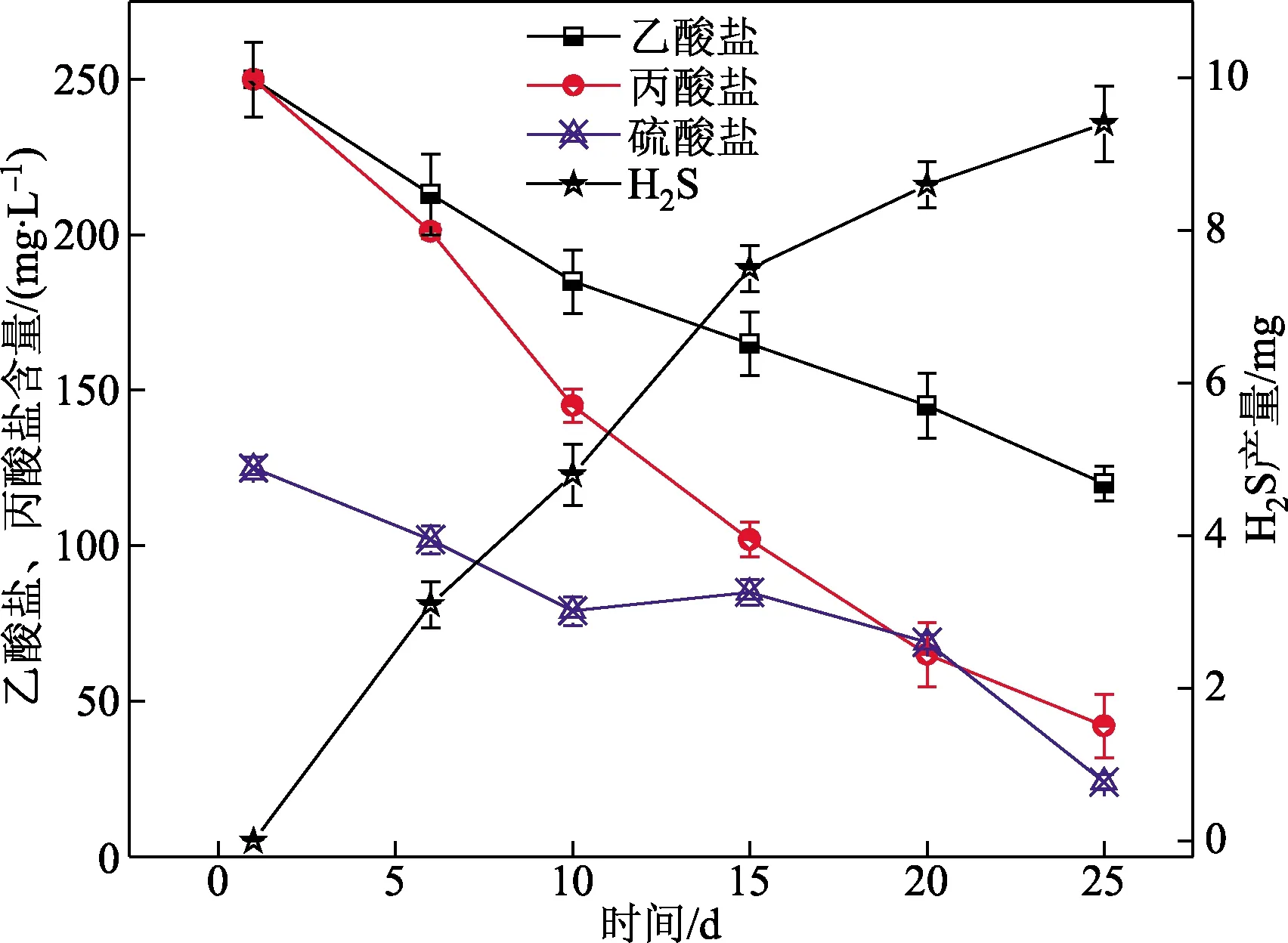
图5 乙酸盐和丙酸盐为混合碳源对H2S释放的影响
SRB中关键酶的活性对H2S的释放同样具有绝对性作用,表2展示了不同碳源情况下,SRB内多种功能酶细胞色素酶,红素还原酶,铁还原酶及过氧化氢酶的相对活性。当以丙酸盐为单一碳源时,细胞色素酶,红素还原酶,铁还原酶及过氧化氢酶的活性分别提高至124%、112%、135%和114%,说明丙酸为单一碳源较乙酸盐为单一碳源时SRB的活性高,这也是该条件下H2S释放量高的原因之一。当混合体系中碳源变为乙酸盐和丙酸盐混合时,上述关键酶的活性较单独乙酸盐作为碳源时高,但低于丙酸盐作为单一碳源组别,该结果进一步证实了SRB更偏爱丙酸盐作为电子供体。徐警卫[14]研究同样表明在不同初始pH下SRB利用丙酸盐的效率要高于乙酸盐。
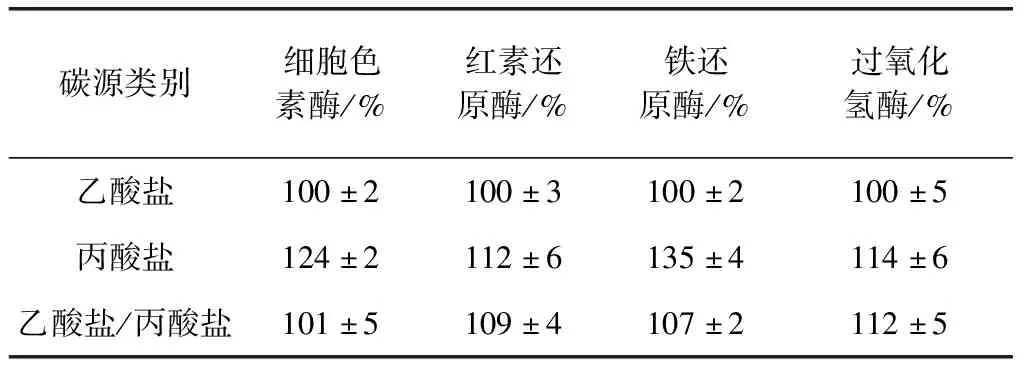
表2 不同碳源对SRB体内功能酶活性的影响
注:以乙酸盐为单一碳源时SRB体内各种关键酶活性定义为100%。
3 结论
(1)m(C)/m(S)对重力排水管网中甲烷及H2S的释放规律具有影响,且当m(C)/m(S)由4升高至8时,甲烷及H2S的释放量由15.9 g和0.9 g下降至7.4 g和0.3 g,然而进一步升高m(C)/m(S)至16时,甲烷和H2S的释放量显著提高。
(2)m(C)/m(S)升高促进了产甲烷菌的相对丰度,当m(C)/m(S)=4时,Methanobacterium、Terrestrial-Miscellaneous-Gp-TMEG和Methanothermobacter的占比分别为5.9%、10.3%和10.3%,而当m(C)/m(S)进一步升高至8时,上述关键均属相对丰度则下降至6.1%、10.4%和10.6%。此外,m(C)/m(S)升高,Desulfonema的相对丰度呈现上升趋势
(3)碳源对SRB活性影响表明相较于乙酸盐,SRB更易利用丙酸盐作为电子供体。丙酸盐作为电子供体时,重力排水管网中H2S的释放量增加。

