盐酸戊乙奎醚对高氧所致幼鼠脑损伤时Shh/Gli1信号通路的影响
颜莉丽 陈 燕 程 闪 董铁立 袁 峰
郑州大学第二附属医院,河南 郑州 450003
尽管目前在产科和新生儿重症监护方面取得了重大进展,但早产儿仍易遭受中枢神经功能障碍。由于内源性氧自由基清除系统的不成熟,早产儿和足月儿通常容易受到活性氧的伤害[1]。众所周知,在新生儿生长和发育的关键阶段接受高浓度氧会严重影响发育过程。近年来的研究表明,高氧还导致神经元和神经胶质细胞死亡,导致脑损伤[2-3]。在大脑成熟的关键阶段,高氧会改变发育过程,从而破坏神经的可塑性和影响髓鞘的形成[4]。但是,在新生儿重症监护室中常常不可避免的进行氧气治疗。因此,在需要接受高氧治疗的情况下,除了开发适当的监测系统外,还需要采取相关的保护策略。
研究表明,高氧所致脑损伤的诱导因素涉及氧化应激、炎症反应、细胞凋亡和神经血管再生等[5-6]。Shh/Gli1信号通路参与多种组织损伤的修复过程,对多种组织细胞的凋亡具有重要的调控作用。近期的研究表明,Shh信号通路与脑损伤后神经组织修复密切相关,可通过抗凋亡、抗氧化应激、保护血脑屏障以及促进神经血管再生等多种机制保护脑组织[7-8]。盐酸戊乙奎醚是一种新型的抗胆碱药物,目前在临床上已应用多年。近年来研究表明,盐酸戊乙奎醚除了具有抗胆碱能受体的作用,还可调节善微循环,减轻氧化应激,抑制炎症反应和抗细胞凋亡[9-10]。但盐酸戊乙奎醚在高氧所致脑损伤中的作用及其机制研究鲜有报道。本研究拟建立幼鼠高氧所致脑损伤模型,以盐酸戊乙奎醚进行预干预,阐述其对幼鼠高氧所致脑损伤时Shh/Gli1信号通路的影响。
1 材料与方法
1.1主要仪器及试剂有机玻璃氧箱(30 cm×20 cm×20 cm,自制),FO-1型测氧仪(无锡法斯达医学设备有限公司),Elx-808酶标仪(BIO-TEK公司,美国),Mini 垂直电转仪和电泳仪(BIO-RAD公司,美国),BA-200光学显微镜(Nicon公司,日本),共聚焦激光扫描显微镜(Olympus公司,日本),AL204电子称(METTLER TOLEDO公司,美国)。氧气(泉州市天星气体有限公司),盐酸戊乙奎醚注射液(生产批号:170922,成都力思特制药股份有限公司),原位细胞凋亡检测试剂盒(Promega公司,美国),抗Shh抗体和抗-Gli1抗体(Santa Cruz 公司,美国),二喹啉甲酸(BCA)蛋白浓度测定试剂盒(碧云天生物技术研究所),Shh一抗、/Gli1一抗和GAPDH一抗(CST公司,美国),二抗工作液(碧云天生物技术研究所)。
1.2实验动物及分组清洁级14日龄Sprague-Dawley(SD)幼鼠共30只,均为雄性,体质量40~50 g,购买于上海斯莱克实验动物有限公司。所有幼鼠均饲养于清洁剂环境中,保持室温22~25 ℃。实验前幼鼠禁食6 h,不禁饮。按照随机数字表法分为3组:对照组(C组)、高氧组(HO组)和高氧+盐酸戊乙奎醚组(HP组),每组10只。
1.3建立动物模型按照文献报道的方法建立幼鼠高氧所致脑损伤模型[11]:幼鼠被置于有机玻璃氧箱,以2~3 L/min的流量持续输注进入100%氧气。内置氧浓度仪持续监测室内氧浓度,保证氧浓度维持在(80.0±2.0)%,舱内放置生石灰粉末作为干燥剂,吸收水蒸气和多余的CO2。幼鼠自由进食及饮水。幼鼠共计吸氧7 d。HO组和HP组幼鼠均放置于有机玻璃氧箱中呼吸氧气,C组幼鼠放置于有机玻璃氧箱之外呼吸正常空气。
1.4药物干预从造模第一天起,HP组幼鼠均给予盐酸戊乙奎醚剂量为0.3 mg/kg,于每日同一时间点给药,共计7 d。C组和H组均于相同时间点给予等容量的生理盐水。
1.5神经功能缺损评分(NDS)实验结束后进行NDS评定。评分内容主要包括:意识状态、呼吸频率、颅脑神经反射、运动感觉功能和协调功能等。分值0~100分,其中0分为正常,100分为脑死亡[12]。NDS完成后采用安乐死法处死幼鼠,留取海马组织,做后续检测。
1.6测定幼鼠海马W/D比取海马,充分漂洗,晾干后称质量,记为湿质量(W);70 ℃ 24 h烘干,称质量,记为干质量(D)。W/D比=W÷D。
1.7光镜下观察幼鼠海马组织形态学改变2%戊巴比妥50 mg/kg,腹腔注射。先将100 mL生理盐水灌注入左心室-升主动脉,后以200 mL的4%多聚甲醛再次灌注,取出大脑,自视交叉后1 mm和4 mm处冠状切面切开,立即投入4%多聚甲醛。制作石蜡切片。于海马同一冠状水平切片行脱蜡、苏木精初染、伊红复染、脱水、封片,光镜下观察海马CA1区病理学改变。每个标本随机取3张切片,光镜下观察海马CA1区,每张切片观随机察3个不重叠的高倍视野(×400),取平均值为正常锥体细胞计数。
1.8TUNEL法检测幼鼠海马组织细胞凋亡指数(AI)依据试剂盒说明书进行检测。光镜下,细胞核中有棕褐色或黄色颗粒者为阳性细胞,正常细胞细胞核为蓝色。AI=凋亡细胞数÷总细胞数×100%。
1.9免疫组化法观察Shh和Gli1表达部位取石蜡切片,常规脱蜡、脱水,经抗原修复、灭活酶后加入Shh和Gli1一抗并于湿盒中孵育2 h,再加入辣根过氧化物酶(HRP)标记二抗进行孵育,30 min显色,苏木精复染,封固。每个标本随机选取3张切片,光镜下观察海马CA1区,每张切片随机取3个不重叠的高倍视野(×400),计数阳性细胞数,取3张切片的平均值以表示Shh和Gli1蛋白的活性。
1.10WesternBlot测定幼鼠海马组织Shh和Gli1蛋白表达水平取海马组织,按裂解液:蛋白组织:苯甲基磺酰氟(PMSF)=100∶10∶1比例加入,电动匀浆器至无组织残渣,4 ℃下12000 rpm/min 离心20 min,取上清液,采用考马斯亮蓝法测定蛋白浓度。煮沸至蛋白变性。取蛋白样品,于12%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)进行分离,湿转法转移至聚偏氟乙烯膜,用5%脱脂奶粉在37 ℃水浴中封闭2 h,加入Shh一抗(1∶1 000)、Gli1一抗(1∶1 000)和GAPDH一抗(1∶500),4 ℃摇床孵育过夜,漂洗后加入二抗于37 ℃摇床孵育2 h。加入电化学发光(ECL)液,用显影仪化学发光。采用Quantity One扫描分析系统软件分析目的条带灰度值。

2 结果
2.1各组幼鼠NDS、海马W/D、AI和海马CA1区正常锥体细胞计数的变化与C组比较HO组幼鼠NDS、海马W/D、AI均升高(P<0.05),海马CA1区正常锥体细胞计数减少(P<0.05)。HP组幼鼠NDS、海马W/D、AI均较HO组降低(P<0.05),海马CA1区正常锥体细胞计数较HO组增多(P<0.05)。见表1。
2.2各组幼鼠海马组织病理学的变化C组海马锥体细胞形态结构正常,排列整齐,基线清晰,细胞核形态正常,核仁明显、深染。HO组海马锥体细胞形态结构异常,排列紊乱,胞体缩小,胞核固缩,核碎裂甚至溶解。HP组海马锥体细胞形态结构较完整,排列尚整齐,细胞基线较清晰,核固缩细胞减少,正常锥体细胞增多。见图1。
表1 各组幼鼠NDS、海马W/D、AI和海马CA1区正常锥体细胞计数比较
注:与C组比较,aP<0.05;与HO组比较,bP<0.05
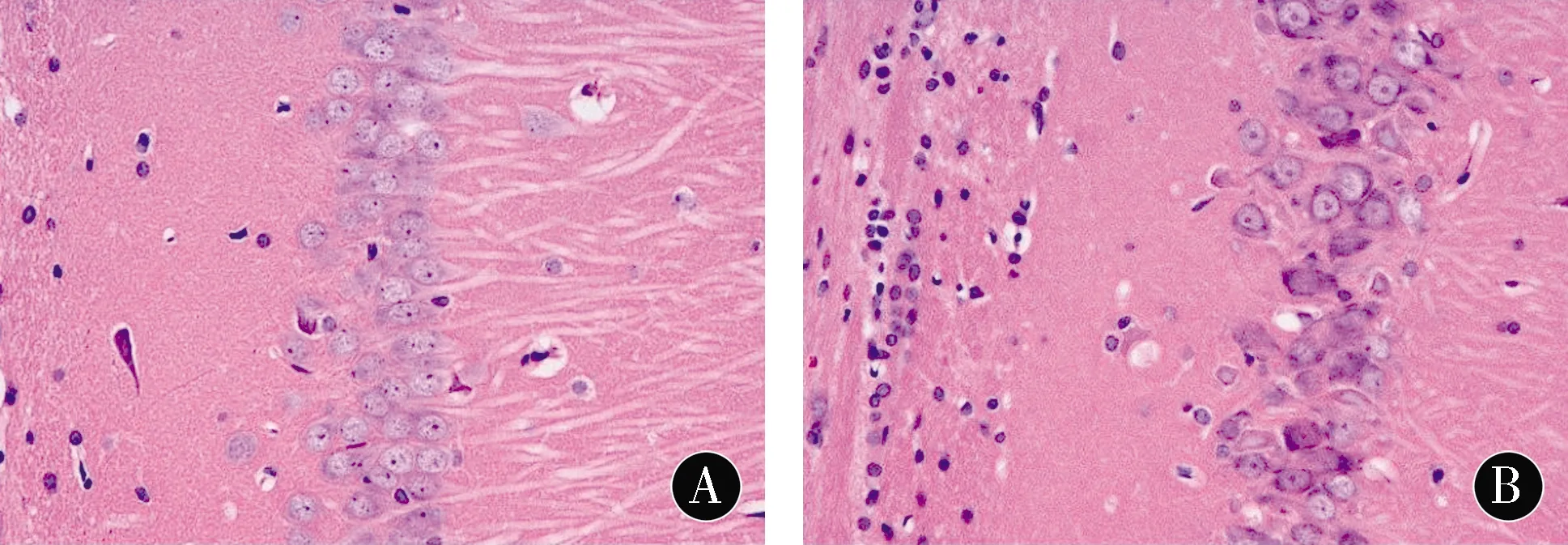
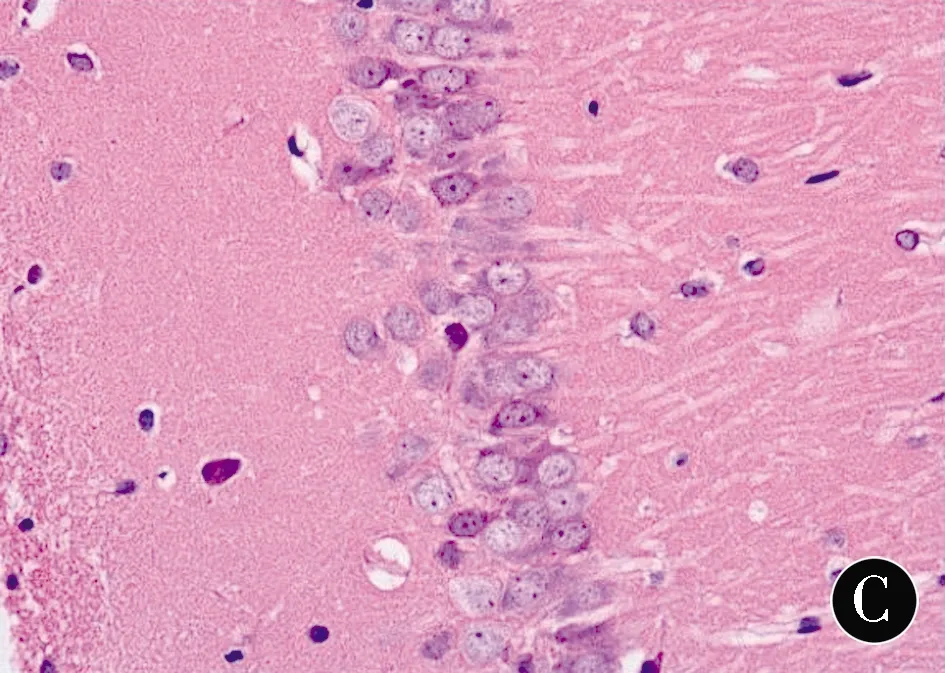
注:A:C组;B:HO组;C:HP组
图1各组幼鼠海马组织病理学的改变 (H&E,×400)Figure1Histopathological changes of the hippocampus of neonatal rats in each group (H&E,×400)
2.3各组幼鼠海马组织细胞凋亡的变化TUNEL法显示,C组幼鼠海马组织中几乎未见凋亡细胞。HO组幼鼠海马细胞发生明显凋亡,HP组幼鼠海马组织中凋亡的细胞明显减少。见图2。
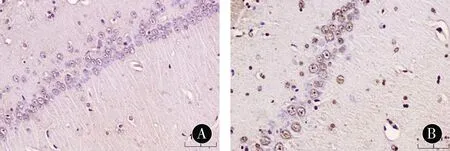
2.4各组幼鼠免疫组化法示海马组织Shh和Gli1表达情况的比较免疫组化法显示,Shh位于细胞膜和细胞质中,Gli1表达于细胞质和细胞核。见图3、图4。与C组比较,HO组海马Shh和Gli1的表达水平显着增加,Gli1部分转移至细胞核;与HO组比较,HP组海马Shh和Gli1的表达水平及Gli1的核移位进一步增加。见表2。
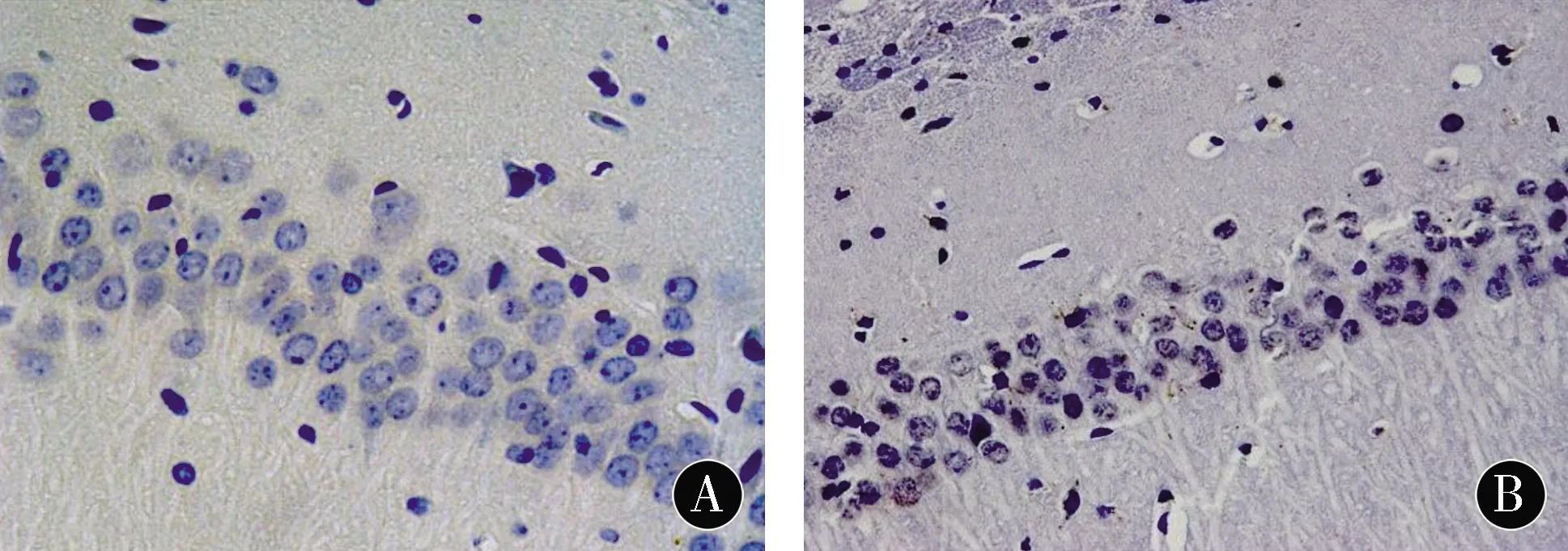
注:A:C组;B:HO组;C:HP组
图2各组幼鼠海马组织细胞凋亡的变化 (TUNEL,×200)
Figure2Changes of apoptosis of hippocampal tissues of neonatal rats in each group (TUNEL,×200)
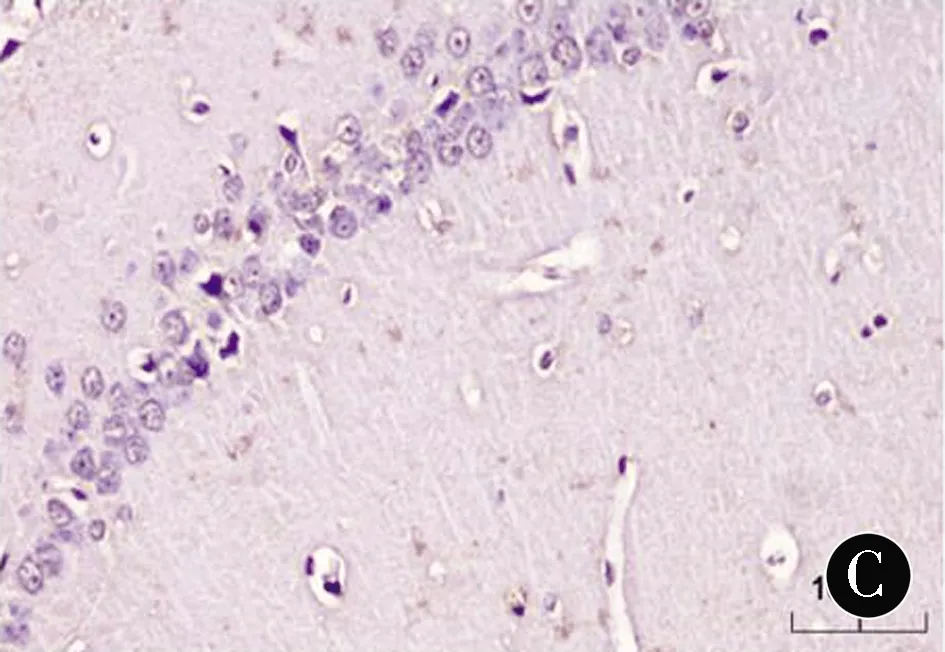
注:A:C组;B:HO组;C:HP组
图3各组幼鼠海马CA1区Shh免疫组化染色(DAB,×400)
Figure3Immunohistochemical staining of Shh in hippocampal CA1area of neonatal rats in each group (DAB,×400)
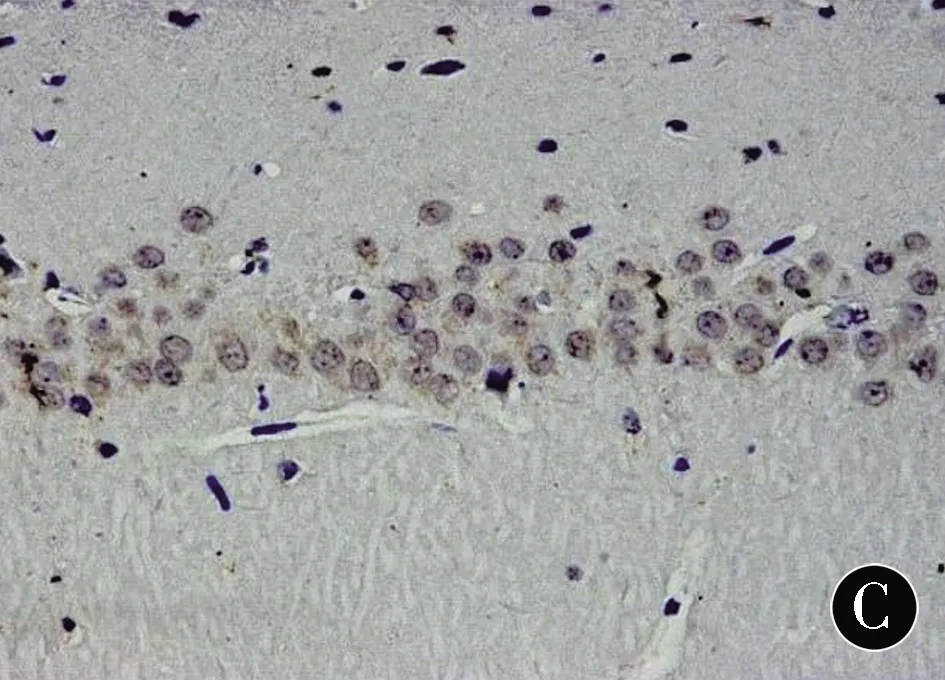
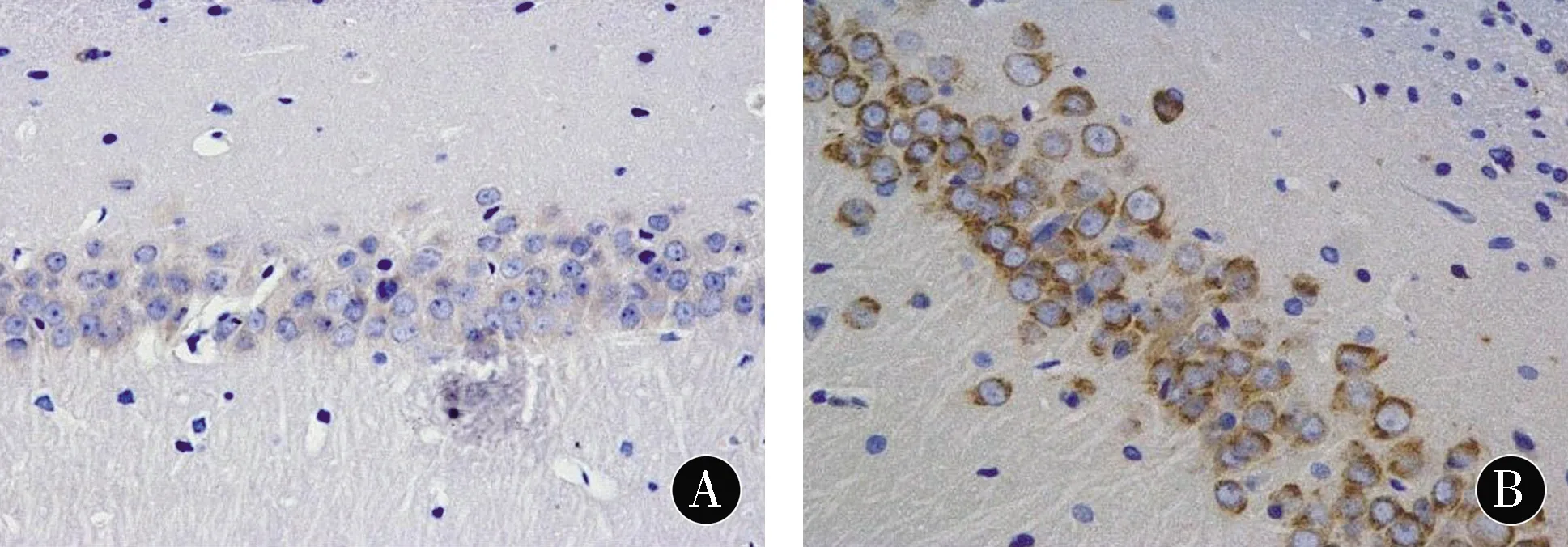
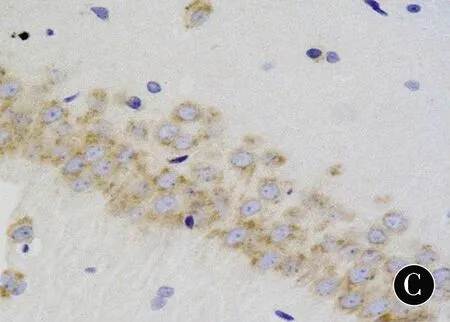
注:A:C组;B:HO组;C:HP组
图4各组幼鼠海马CA1区Gli1免疫组化染色(DAB,×400)
Figure4Immunohistochemical staining of Gli1in hippocampal CA1area of neonatal rats in each group (DAB,×400)
2.5各组幼鼠海马组织Shh和Gli1蛋白表达水平的变化与C组比较,HO组幼鼠海马组织Shh和Gli1表达水平均升高(P<0.05)。HP组幼鼠海马组织Shh和Gli1表达水平均较HO组均升高(P<0.05)。见表3、图5。
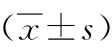
表2 各组幼鼠海马CA1区Shh和Gli1免疫组化阳性细胞计数比较
注:与C组比较,aP<0.05;与HO组比较,bP<0.05
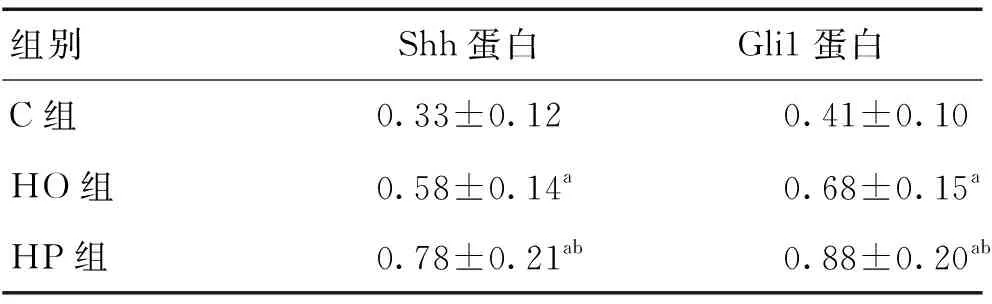
组别Shh蛋白Gli1蛋白C组0.33±0.120.41±0.10HO组0.58±0.14a0.68±0.15aHP组0.78±0.21ab0.88±0.20ab
注:与C组比较,aP<0.05;与HO组比较,bP<0.05
图5 各组幼鼠海马组织Shh和Gli1蛋白表达量分析 (Western blot)Figure 5 The analysis of the expression of Shh and Gli1 protein in hippocampus tissues of neonatal rats in different groups (Western blot)
3 讨论
研究证实,高氧在早产相关疾病如早产儿视网膜病变(ROP)和支气管肺发育不良(BPD)等的发病机制中具有重要作用[13-14]。新生儿时期过早地接触大量氧气可能会破坏大脑的成熟。有证据表明,高氧对未成熟的大脑具有损害作用[15]。早产儿长期暴露于超生理水平的高氧条件下可能引起大脑早熟并伴有囊性或弥漫性脑白质软化的脑病[16]。而正常分娩的足月儿若发生窒息复苏时接受高氧浓度的话则会显着增加病死率和发病率[17]。在啮齿动物中,高氧触发的细微神经变性与细胞凋亡、自噬、神经营养蛋白和生长因子表达变化、氧化有关压力、炎症以及与突触可塑性等有关[18-19]。因此,高氧所致脑损伤在新生儿或早产儿的防治中需要高度重视,对及发生机制也应积极去探索。
本实验按照文献报道的方法建立幼鼠高氧所致脑损伤模型[11],即幼鼠被置于有机玻璃氧箱,保证氧浓度维持在(80.0±2.0)%,共计吸氧7 d。本实验结果表明,长时间吸入高浓度氧后,幼鼠NDS、海马W/D比和AI均明显升高,海马CA1区正常锥体细胞计数明显减少。提示,长期暴露于高氧可促使幼鼠脑损伤的发生发展。同时,光镜下可见,HO组幼鼠海马锥体细胞形态结构异常,排列紊乱,胞体缩小,胞核固缩,核碎裂甚至溶解,TUNEL法显示,HO组幼鼠海马细胞发生明显凋亡,提示长时间吸入高浓度的氧可损伤幼鼠海马锥体细胞。因此,幼鼠高氧所致脑损伤模型复制成功。
本研究结合临床实际并参照文献报道[20]选取盐酸戊乙奎醚的给药剂量为0.3 mg/kg。结果显示,给予盐酸戊乙奎醚后,幼鼠NDS、海马W/D和AI均降低,海马CA1区正常锥体细胞计数增多,海马锥体细胞形态结构较为完整,细胞基线较清晰,核固缩细胞减少,正常锥体细胞增多,海马组织中凋亡细胞明显减少。提示盐酸戊乙奎醚可减轻高氧所致的脑损伤。基础研究表明,盐酸戊乙奎可减轻小鼠脑缺血再灌注损伤[21]。因此,盐酸戊乙奎醚的脑保护作用较为确切,而本研究结果再次印证了这一观点。
Shh蛋白是Hh蛋白家族成员之一,Shh信号通路是生物进化中最为保守的信号通路之一,参与了脊椎动物和非脊椎动物胚胎发育的多个过程,对神经系统的发育和器官的形成和构建至关重要。在经典的Shh信号传导中,Shh蛋白以自分泌或旁分泌方式与Patched受体结合,解除Patched对Smoothed受体的抑制作用,使Gli1、Gli2和Gli3进入细胞核并启动控制细胞生长、存活和分化的一系列靶基因的表达,从而完成各种生物学作用[22]。既往研究认为,Shh信号通路仅在胚胎发育阶段发挥作用,但近年来越来越多的研究表明,Shh信号通路还参与了出生后急性脑损伤、脊髓损伤、多发性硬化、脱髓鞘、帕金森病、阿尔茨海默病等多种脑和脊髓疾病的发生发展[23,24]。给予外源性重组Shh蛋白可显著改善脑缺血再灌注损伤大鼠的神经行为学评分、减少脑梗死体积、促进缺血周围组织的血管生成和神经干细胞的定植[25]。另外,Gli1蛋白的高水平表达是Shh信号通路激活的明确标志[26]。本研究结果表明,长时间吸入高浓度氧后,Shh和Gli1表达上调,表明高氧激活了海马组织中的Shh/Gli1信号通路;HP组Shh和Gli1的表达水平进一步上调,表明盐酸戊乙奎醚促进了Shh/Gli1信号通路的进一步激活,因此,盐酸戊乙奎醚的脑保护作用与Shh/Gli1信号通路的激活有关。但目前相关的研究较少,故需更深入的探究。
盐酸戊乙奎醚对高氧所致脑损伤发生的幼鼠脑组织具有较好的保护作用,其机制可能与激活Shh/Gli1信号通路有关。

