睡眠剥夺对小鼠脑组织超微结构和晚期糖基化终末产物受体表达的影响
王 修 赵 典 唐 伟 王 威
1)大连大学研究生院,辽宁 大连 116622 2)阜新市中心医院,辽宁 阜新 123000 3)大连大学附属新华医院,辽宁 大连 116021 4)大连大学附属中山医院,辽宁 大连 116001
越来越多的研究表明,睡眠剥夺(sleep deprivation,SD)似乎是阿尔茨海默病(Alzheimer’s disease,AD)的潜在环境风险因素之一。临床数据显示,约45%的AD患者有睡眠障碍[1]。在AD转基因动物模型中也发现了睡眠-觉醒周期的改变[2]。研究发现AD患者的快速眼动睡眠时间(REM)缩短[3]。睡眠剥夺会干扰学习和记忆,其中包括氧化应激[4],后者在与年龄相关的神经退化过程中也起着关键作用,β淀粉样蛋白(Aβ)是氧化损伤的关键诱因[5-6]。睡眠剥夺可以影响β-淀粉样前体蛋白(APP)的表达,促进Tau蛋白的磷酸化,导致Aβ的大量产生和沉积,最终导致AD[7]。
晚期糖基化终末产物受体(RAGE)是免疫球蛋白超家族的一种多配体跨膜受体,它不仅能结合晚期糖基化终末产物,还能结合Aβ、两性霉素、S100B钙结合蛋白和其他促炎症配体[8]。RAGE可介导Aβ通过血脑屏障(BBB)转运到脑内,诱导内皮细胞炎症和凋亡[9]。睡眠剥夺可使海马及大脑前额皮质细胞产生大量RAGE,促进了AD的发生。虽然越来越多的证据表明睡眠不足可能加速AD的进展,但其潜在的机制仍不清楚。本研究通过改良多平台水环境法(MMPM)建立小鼠睡眠剥夺模型,从神经行为学来探讨睡眠剥夺对小鼠认知功能的影响,透射电镜观察睡眠剥夺对小鼠脑组织超微结构的损害,免疫组化检测与Aβ转运相关的晚期糖基化终末产物受体的表达,深入探讨其可能的发生机制。
1 材料和方法
1.1实验动物与分组取30只3月龄健康昆明小鼠,体质量(24±2)g,购自大连医科大学动物实验中心(许可证号:辽实劳动质字[2000]028号)。随机分为3组:睡眠剥夺组(SD组)、平台对照组(TC)和空白对照组(BC),每组10只。
1.2动物模型制作选择改良多平台水环境法(MMPM)诱导SD。准备一个水箱(60 cm×35 cm×20 cm),水箱里装满约在平台下0.2 cm深的水。SD组水箱内放置22个圆形平台(直径3.5 cm,底部高4.5 cm,平台间的直径间距5.5 cm),以确保小鼠能在平台上躺下。小鼠可以在平台上自由地喝水和运动。在快速动眼睡眠期间,小鼠腹部肌肉肌张力程度降低时会导致小鼠落入水中或接触水面醒来,造成小鼠睡眠时间剥夺[10]。为了测试环境压力的潜在影响,设置了TC组:在水箱里放置6个大平台(直径12 cm,高4.5 cm,平台间的直径间距15 cm),允许老鼠睡觉而不落入水中。小鼠可以自由接触到水箱顶部的食物颗粒和水瓶。饲养环境:12 h/12 h的明暗循环,光照从08:00开始,恒温(22±2)℃,在整个SD期间,水箱中的水每天都会更换。BC组放在正常笼子里。为了减轻应激,要求每只小鼠熟悉环境3 d后再开展实验。小鼠每天剥夺睡眠20 h,维持30 d,每天12:00至次日08:00为睡眠剥夺时间,一天余下的时间里,将每组小鼠都转移到笼子里休息。
1.3神经行为学测试无应激刺激物体识别试验(object recognition test,ORT)检测小鼠的学习和记忆能力。设备:准备一个白色塑料箱(40 cm×30 cm×20 cm),2个相同的白色塑料箱物体A和物体B(3 cm×2 cm×5 cm),黑色塑料箱物体C(4 cm×3 cm×6.5 cm)。测试环境要求为安静且光照充足(防止阴影干扰小鼠的探索行为)。测试前每只小鼠有5 min的适应环境时间。熟悉期:A、B两物体间距为20 cm,放在箱壁两端7 cm处。在测试过程中,将小鼠置于A、B中间,记录两个物体的探索时间,时间5 min。识别期:熟悉期结束后10 min,用物体C代替物体B,再次记录物体A、C的探索时间,时间5 min。每只小鼠在每次实验结束时用75%酒精清洗物品[11]。动物头部接触物体、嗅闻物体、小鼠鼻子到物体的距离<2 cm,均被认为是对物体的探索。攀登、绕过或坐在物体上不计算在内。
1.4海马及前额皮质组织超微结构电镜观察实验结束后,断头取脑,于冰上分离海马体和前额叶皮质。灌注3%戊二醛,在1%锇酸中4 ℃快速固定2~4 h,组织按分级乙醇系列脱水,包埋Epon812后过夜。利用超薄切片机将材料切成50 nm厚,用醋酸铀和枸橼酸铅双染色,然后在1220型透射电子显微镜下观察并拍照。
1.5小鼠海马CA1区和前额叶皮质RAGE蛋白测定石蜡块切片,厚度为5 μm,常规脱蜡脱水,依次滴入兔抗鼠RAGE抗体(1∶100)、二抗辣根过氧化物酶标记羊抗兔多聚体、DAB溶液,按试剂盒说明书步骤依次进行免疫组化试验,出现阳性检测结果后立即终止反应。脱水、透明、封片,最后使用光学显微镜观察并拍照。

2 结果
2.1神经行为学检测结果熟悉期各组间物体探索时间差异无统计学意义(P>0.05)。识别期TC、BC组小鼠探索新物体C时间明显多于探索旧物体A(P<0.01),SD组小鼠对新物体C的探索时间较TC、BC组下降明显(P<0.05)。见表1、图1。
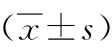
表1 各组小鼠ORT结果比较
注:与熟悉期A物体比较,1)P>0.05);与识别期A物体比较,2)P<0.01;与BC组C物体比较,3)P<0.05
注:A熟悉期各组小鼠探索物体A、B时间比较,B识别期各组小鼠探索物体A、C时间比较图1 各组小鼠探索时间比较Figure 1 Comparison of exploration time of mice in each group
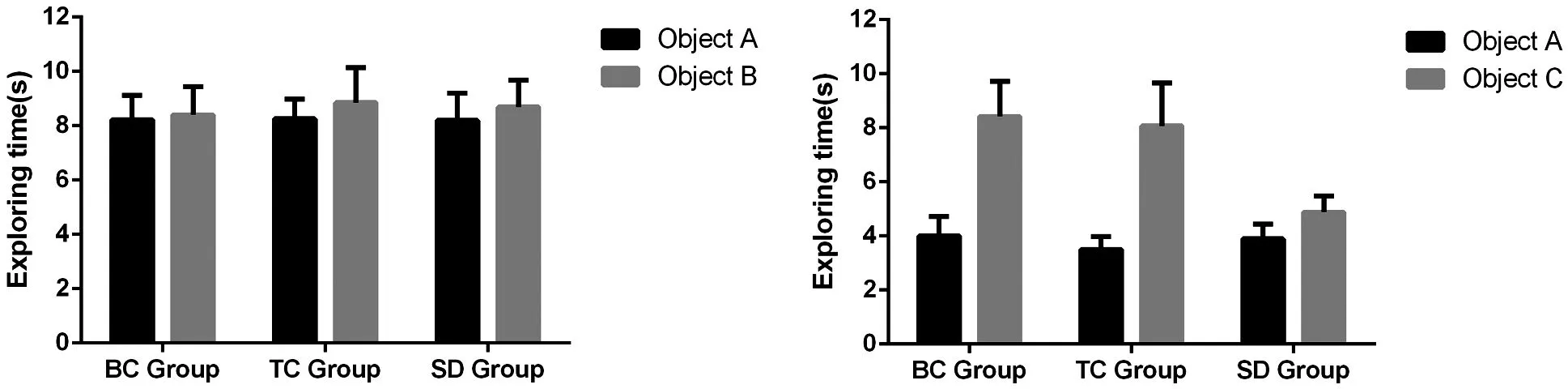
2.2海马CA1区及前额皮质组织超微结构电镜结果TC、BC组中海马和前额叶皮质的神经元排列规整,核仁清晰,轴突形状规则,髓鞘均匀,边界清楚,排列整齐致密,线粒体数目多。SD组中海马和前额叶皮质神经元排列松散,核仁皱缩,轴突水肿,部分轴索膜和髓鞘溶解、断裂,细胞周围界线不清,线粒体数量明显减少,部分表现为空泡样变,触囊泡不规则、稀疏。见图2。
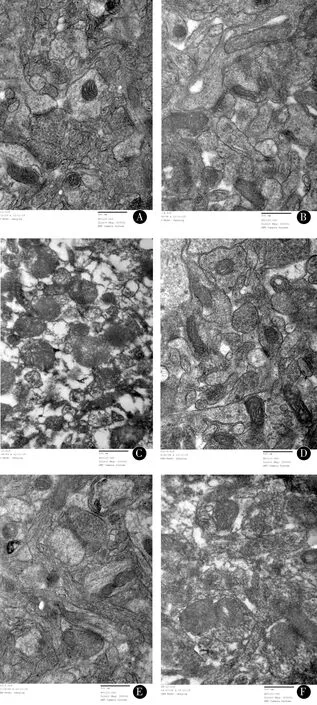
2.3小鼠海马CA1区和前额皮质RAGE蛋白表达与TC、BC组比较,SD组海马CA1区和前额叶皮质RAGE蛋白免疫组化染色阳性(呈棕褐色颗粒)细胞数明显增加(P<0.05)。TC、BC组阳性细胞表达数相对较少,2组间差异无统计学意义(P>0.05)。见图3、4。
注:A:BC组海马CA1区;B:TC组海马CA1区;C:SD组海马CA1区;D:BC组前额皮质;E:TC组前额皮质;F:SD组前额皮质图2 海马CA1区和前额皮质超微结构电镜结果(×50 000)Figure 2 Ultrastructural electron microscope results in the CA1 area of the hippocampus and prefrontal cortex(×50 000)
注:A:BC组海马CA1区;B:TC组海马CA1区;C:SD组海马CA1区;D:BC组前额皮质;E:TC组前额皮质;F:SD组前额皮质图3 海马CA1区及前额皮质RAGE蛋白表达(×100)Figure 3 RAGE protein expression in the CA1 area of the hippocampus and prefrontal cortex(×100)
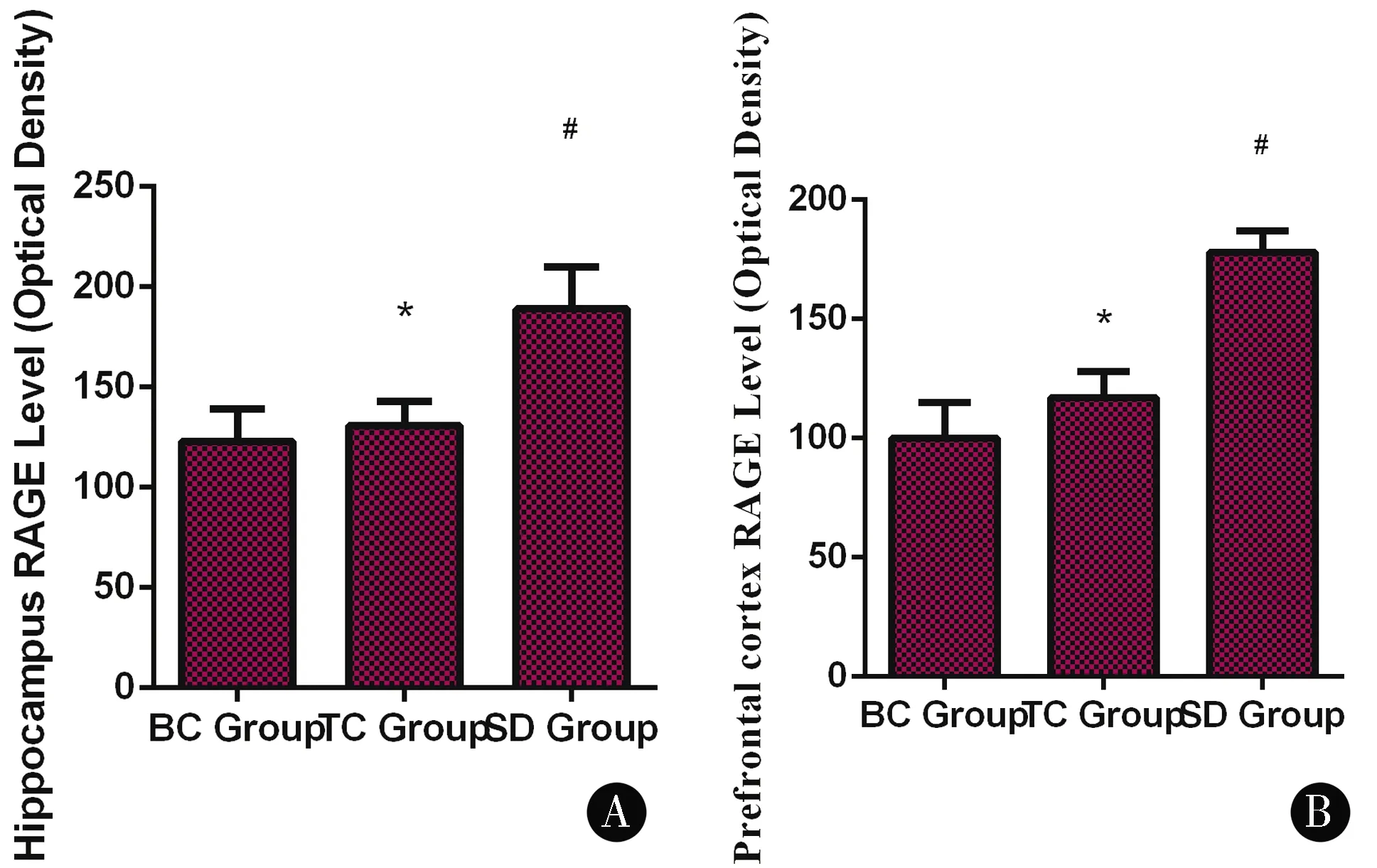
注:A海马CA1区RAGE蛋白表达平均光密度值比较,B前额皮质RAGE蛋白表达平均光密度值比较图4 海马CA1区和前额皮质RAGE蛋白表达平均光密度值比较Figure 4 Comparison of average optical density of RAGE protein expression in hippocampal CA1 region and prefrontal cortex
3 讨论
睡眠在正常的生物功能中起关键作用。研究证实,剥夺睡眠的小鼠大脑会表现出各种形态、神经行为学以及认知功能的改变[12]。睡眠剥夺对中枢神经系统的功能有不利影响,尤其是其损害了保存信息的能力,破坏了记忆的巩固[13-14]。本文实验选择改良多平台水环境法(MMPM)建立小鼠睡眠剥夺模型,该模型依赖于快速眼动睡眠期间肌张力的丧失。与其他睡眠剥夺模型相比,MMPM具有明显的优势。这一模型允许小鼠作为一个群体一起被剥夺睡眠,并可以最小化单一平台相关的压力的混杂效应,如运动限制[15]。本实验表明,熟悉期各组间物体探索时间差异无统计学意义(P>0.05),表明各组小鼠的视觉认知能力无差异。识别期TC、BC组小鼠探索新物体C时间明显多于探索旧物体A(P<0.01),表明TC、BC组小鼠仍保留对旧物体有较好的记忆,学习和记忆能力没有受损。SD组小鼠对新物体C的探索时间与探索A物体比较无明显差异,而与TC、BC组比较下降明显(P<0.05),表明睡眠剥夺组小鼠对旧物体有记忆的障碍,提示睡眠剥夺可能损害保存信息的能力,影响了记忆的巩固,导致学习和记忆障碍。
要充分了解睡眠剥夺对大脑有害的原因,一种有效的方法是检查其对脑细胞超微结构的影响。透射电子显微镜主要用于观察细胞内<0.2 μm的亚显微或超微结构,具有较高分辨率。透射电镜观察结果发现,SD组中海马和前额叶皮质神经元排列松散,核仁皱缩,轴突水肿,部分轴索膜和髓鞘溶解、断裂,细胞周围界线不清,线粒体数量明显减少,部分表现为空泡样变,触囊泡不规则、稀疏,表明睡眠剥夺可导致小鼠大脑海马和前额叶皮质神经元的严重损伤,甚至坏死,影响小鼠大脑海马突触的可塑性,损害学习和记忆能力。这与AD的主要病理变化特征一致,表明睡眠剥夺可能对小鼠海马区CA1区和前额叶皮质脑组织超微结构造成损害。
阿尔茨海默病(AD)的主要神经病理特征包括Aβ斑块聚集、由过度磷酸化的tau蛋白组成的神经纤维缠结、突触丢失和广泛的脑萎缩。Aβ的过度聚集最终导致淀粉样蛋白沉积和老年斑的形成,这是AD的标志,并导致神经毒性和认知记忆功能受损。除记忆力丧失外,AD患者通常还会出现重要的非认知、神经精神症状,其中包括睡眠-觉醒周期的紊乱[16-18]。最近来自人类和转基因动物的研究表明,Aβ沉积和Tau聚集可以直接导致睡眠障碍[19]。在阿尔茨海默病果蝇模型中,长期睡眠剥夺导致Aβ积聚增加[20]。啮齿类动物在急性或慢性睡眠限制后Aβ水平更高[21-22]。强迫睡眠剥夺导致转基因小鼠的Aβ斑块负荷显著增加,并随着年龄而增长。相反,用食欲素拮抗剂治疗可以增加睡眠,减少斑块负担。在健康人中,成像研究揭示了睡眠时间短或睡眠质量差的自我报告与大脑中较高的Aβ负荷之间的联系,这是AD的一个风险因素[23]。这种联系被认为是双向的,因Aβ负荷增加也可能导致睡眠障碍[24]。这些研究表明,睡眠障碍可能预示着未来大脑Aβ沉积,甚至发展为痴呆症。RAGE可介导Aβ通过血脑屏障向脑血管管腔内流,在阻止Aβ清除方面起重要作用[25]。研究发现AD和非痴呆对照组的海马、额叶下部皮质和小脑中RAGE的表达[9]。与非痴呆对照组的相同区域相比,AD患者病理富集区(海马和额叶下部)的总RAGE水平显著升高。此外,先前的一项研究发现,降低RAGE活性可以抑制Aβ在大脑中聚集,并防止Aβ的神经毒性[26]。本实验检测了与Aβ转运相关的RAGE,探讨其可能的发生机制。本研究提示,与TC、BC组比较,SD组海马CA1区和前额叶皮质RAGE蛋白免疫组化染色阳性细胞数明显增加(P<0.05),提示小鼠睡眠的剥夺可以导致大量的RAGE表达,RAGE在小鼠脑组织中的过度表达加速了Aβ在大脑的转运,破坏了血脑屏障,诱导内皮细胞炎症反应和凋亡,导致神经毒性和炎症反应的发生。
睡眠剥夺可损害小鼠的认知功能,可能对小鼠海马CA1区及前额叶皮质脑组织超微结构造成损害,可能增加小鼠海马CA1区及前额叶皮质RAGE的表达,致小鼠神经行为学改变。因此,在AD病理发展之前,及早治疗睡眠觉醒和昼夜节律紊乱,可能会阻止或减缓随后的病理和后来痴呆症的发展。

