马铃薯早熟品种与晚熟品种对马铃薯Y病毒(PVY)和马铃薯卷叶病毒(PLRV)的生理反应
张 武,吴雁斌,高彦萍,梁宏杰,吕和平*
(1.甘肃省农业科学院马铃薯研究所,甘肃 兰州 730070;2.甘肃省马铃薯脱毒种薯(种苗)病毒检测及安全性评价工程中心,甘肃 兰州 730070)
据研究,有40多种病毒和2种类病毒可以感染马铃薯,其中9种病毒和1种类病毒对马铃薯生长的影响最为严重[1-3]。马铃薯Y 病毒(Potato virus Y,PVY)和马铃薯卷叶病毒(Potato leaf roll virus,PLRV)是世界范围内影响农业生产的2种主要的马铃薯病毒病原体[4]。如果马铃薯被PVY 或PLRV 感染,一个生长季节的总产量会减少80%,导致块茎质量不合格,给农业生产造成巨大的经济损失[5]。多年来,马铃薯病毒的研究主要集中在马铃薯病毒的茎尖脱毒和检测分析[6-8]。人们对植物抗逆性生理与酶活性的关系进行了大量的研究,并解释了逆境环境下植物酶活性的变化[9,10]。Fridovich[11]的自由基理论认为,植物存在一种膜保护系统,可以清除植物体内多余的自由基。逆境条件下,膜保护系统实际上是一种抗氧化系统,由超氧化物歧化酶(Superoxide dismutase, SOD)、 过氧化物酶(Peroxidase,POD)、过氧化氢酶(Catalase,CAT)等组成,试验表明,植物受到虫害威胁后,SOD、POD、CAT活性增加。与此同时,有学者发现,受病原菌侵染的植株光合速率明显降低,叶绿体结构被破坏,叶绿素含量下降[12]。本试验通过测定和分析马铃薯中早熟品种‘LK99’和晚熟品种‘陇薯3号’感染PVY 和PLRV 后叶片SOD 活性、POD 活性、CAT 活性、丙二醛(Malondialdehyde,MDA)含量、叶绿素含量的变化,旨在进一步明确和比较所选两个品种分别在2种病毒胁迫下的生理变化。
1 材料与方法
1.1 试验地概况
试验于2016 年在甘肃省定西市渭源县会川镇甘肃省农业科学院马铃薯研究所试验基地进行,试验地土壤为黑麻土,土壤pH 7.6,有机质含量18.0 g/kg,全氮0.84 g/kg,碱解氮78 mg/kg,速效磷7.6 mg/kg,速效钾109.7 mg/kg。温带大陆性气候,马铃薯生育期均降水量300 mm,平均气温18 ℃。
1.2 试验材料
试验材料为甘肃省农业科学院马铃薯研究所育成马铃薯晚熟品种‘陇薯3 号’(生育期出苗至成熟110 d左右),以下简称L3和中早熟品种‘LK99’(生育期85 d左右)的一级种薯。马铃薯播种期为4月26日,出苗期后田间目测、结合免疫试纸条法[安德珍(Adgen)公司试剂盒]田间检测,选取正常和分别感PVY和PLRV植株叶片,经ELISA病毒检测,确定只含PVY或PLRV的植株,并分别用防虫网和小拱棚对此植株进行隔离,以防蚜虫等传毒媒介传染其他病毒,从而影响试验结果。并于6 月14 日(苗期)、7 月2 日(块茎形成期)、7 月24 日(块茎膨大期)、8月17日(淀粉积累期)选取正常叶和感病植株(花叶、卷叶明显),每株取上中部3片复叶进行相关指标测定,首次取样用免疫试纸条法[安德珍(Adgen)公司试剂盒]结合ELISA病毒检测确定,后期取样只用免疫试纸条法[安德珍(Adgen)公司试剂盒]确认,在块茎膨大期测定株高、茎粗、地上鲜重,成熟后测产。
1.3 试验方法
1.3.1 酶液的制备
取0.2 g 新鲜马铃薯叶片于冰浴研钵中,加少许石英砂和5 mL预冷的酶提取液(用pH 7.8的磷酸缓冲液配制,内含5 mmol/L EDTA,2 mmol/L AsA,2%PVP),迅速匀浆,4 ℃,4 000 r/min离心15 min,取上清液备用。上清液中包含POD、SOD和CAT[13]。
1.3.2 POD活性的测定
0.3%愈创木酚法[13]。以470 nm吸光值每分钟增加1为一个酶活性单位(U)。
1.3.3 SOD活性的测定
NBT光还原法[14],以抑制氮蓝四唑(NBT)在光照下被还原到50%的酶量为一个酶活性单位(U)。
1.3.4 CAT活性的测定
240 nm比色法[14],以240 nm吸光值每分钟减小0.1为一个酶活性单位(U)计算CAT活性。
1.3.5 MDA含量的测定
双组分分光光度计法[15],称取0.3 g 马铃薯叶片和嫩茎,加入5 mL 三氯乙酸(TCA),研磨后在4 000 r/min 离心15 min,吸取2 mL 上清液再加入2 mL 0.6%硫代巴比妥酸(TBA)溶液,沸水浴15 min,迅速冷却,测定450,532和600 nm处吸光值。
1.3.6 叶绿素含量的测定
无水乙醇与丙酮(1∶1,v/v)混合液浸泡法[16],0.1 g样品加10 mL提取液(无水乙醇∶丙酮=1∶1),封口,遮光,24 h后测定470,649和665 nm处吸光值。
1.4 数据分析
受到PVY、PLRV 侵染的马铃薯叶片中POD、SOD和CAT酶活及MDA含量、叶绿素含量相对增量(减量)按以下公式计算:
酶活相对增量(%)=[处理组酶活(含量)-对照组酶活(含量)]/[对照组酶活(含量)]×100
酶活相对减量(%)=[对照组酶活(含量)-处理组酶活(含量)]/[对照组酶活(含量)]×100
使用Microsoft Excel 2007 软件作图,SPSS 17.0软件进行单因素随机区组方差分析(P<0.05)。
2 结果与分析
2.1 病毒侵染对马铃薯生长及产量的影响
晚熟马铃薯品种‘陇薯3 号’和中早熟品种‘LK99’感病植株与正常植株相比,感病植株株高较正常植株株高降低4.7~12.1 cm;植株茎粗2个品种均表现为正常植株>感染PLRV植株>感染PVY植株,但差异不显著;同时表现为植株单株鲜重和单株薯重急剧降低,感染PVY 的‘陇薯3 号’和‘LK99’植株单株鲜重分别减少79 和38 g、单株薯重分别减少257 和145 g,感染PLRV 的‘陇薯3 号’和‘LK99’植株单株鲜重分别减少44 和19 g、单株薯重分别减少126和104 g(表1)。
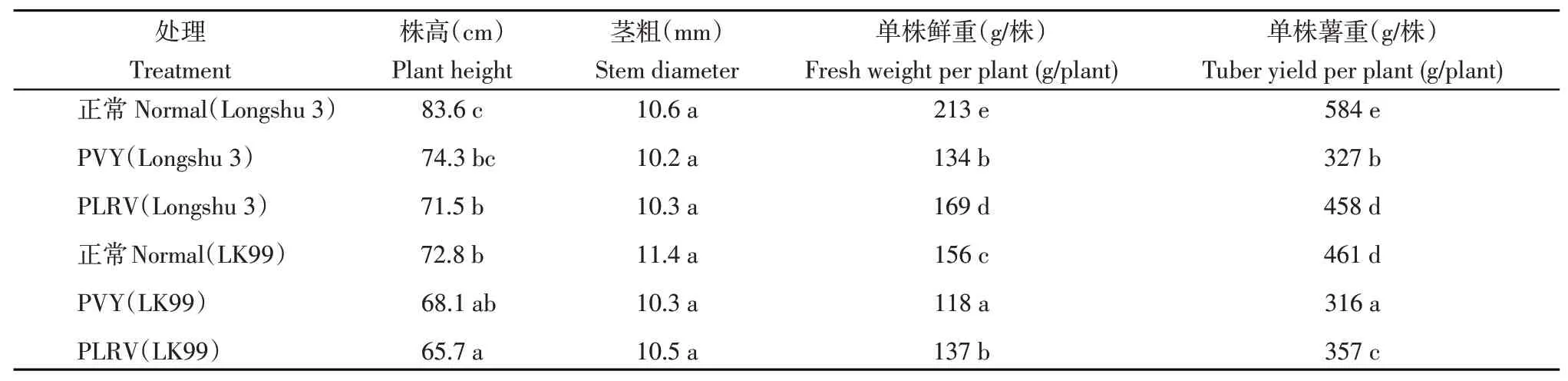
表1 病毒侵染对马铃薯农艺性状的影响Table 1 Effect of virus infection on agronomic traits of potato
从2种病毒对植株的影响分析,株高方面感染PLRV的植株损伤明显重于感染PVY的植株,而茎粗、单株鲜重、单株薯重则表现为感染PLRV的植株损伤明显轻于感染PVY的植株。从2个不同马铃薯品种对病毒的响应分析,感染PVY后‘LK99’在株高、单株鲜重、单株薯重方面均表现为受损程度显著低于‘陇薯3号’植株;当感染PLRV后‘LK99’在株高、单株鲜重方面表现与感染PVY 后的情况一致,但是植株分别感染2种病毒后茎粗表现呈现相反的情况(表2)。这可能表明PVY对马铃薯的危害程度较PLRV更为严重,PVY和PLRV对‘陇薯3号’的损伤程度较‘LK99’严重。
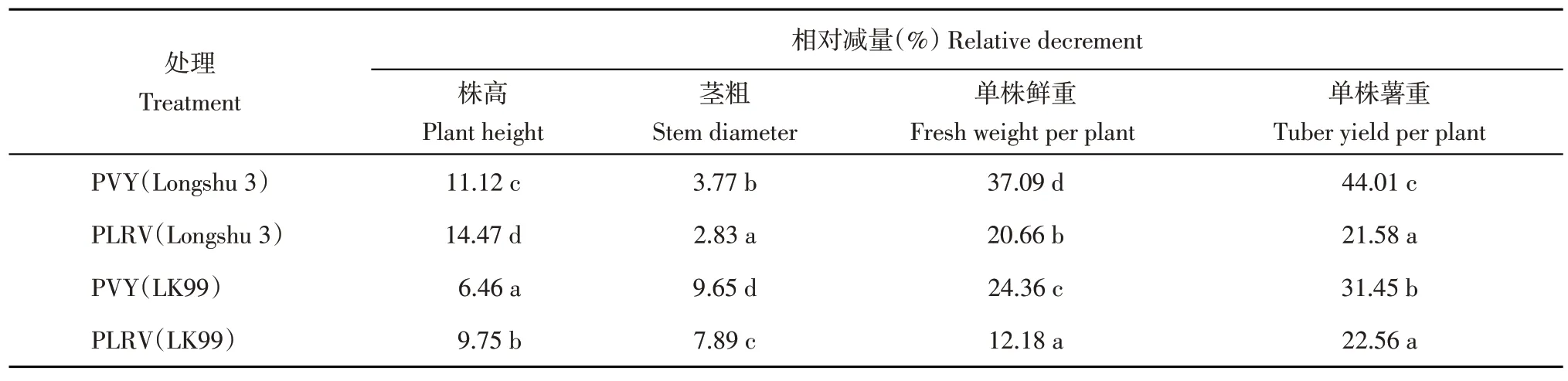
表2 病毒侵染后马铃薯农艺性状的相对减量Table 2 Relative decrement of potato agronomic traits after virus infection
2.2 病毒侵染对马铃薯细胞保护酶活性的影响
2.2.1 超氧化物歧化酶(SOD)活性的变化
无论是正常马铃薯植株,还是分别感染PVY、PLRV的马铃薯植株,SOD活性随着生育期进程的推进均呈明显上升趋势,到块茎膨大期达到最高值,至淀粉积累期开始下降;‘陇薯3号’及‘LK99’植株分别感染PVY、PLRV 后,各生育阶段植株叶片的SOD活性相对于未感病植株均显著增强(图1)。
从品种方面分析,在4 个生育期内分别感染PVY 和PLRV 的‘陇薯3 号’植株叶片SOD 活性相对增量显著高于分别感染PVY 和PLRV 的‘LK99’(淀粉积累期PVY 除外)。从两种病毒的危害程度方面分析,感染PVY 后‘陇薯3 号’植株叶片SOD 活性相对增量显著低于感染PLRV 的‘陇薯3 号’植株,除淀粉积累期以外,‘LK99’也具有相似的表现(表3)。
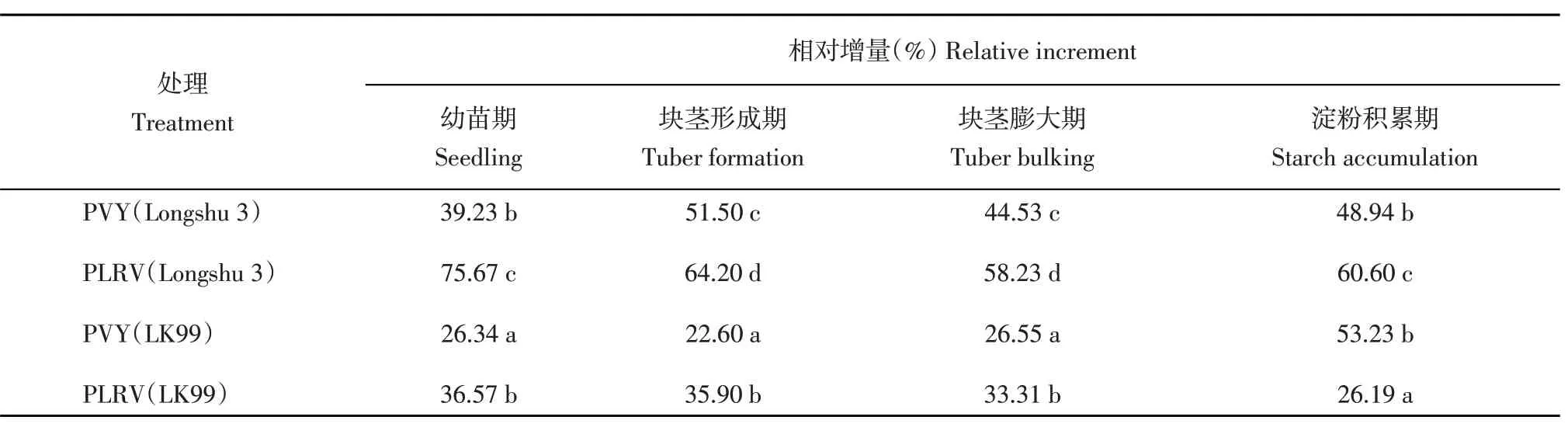
表3 病毒侵染后马铃薯叶片SOD活性相对增量Table 3 Relative increment of SOD activity in potato leaves after virus infection
2.2.2 过氧化物酶(POD)活性的变化
感染了PVY 的2 个品种植株各生育时期叶片POD活性均显著高于正常植株叶片POD活性,感染PLRV的两个品种植株除淀粉积累期外叶片POD活性均显著高于正常植株叶片POD活性。其总体趋势表现为幼苗期POD 活性值较低(16.73~36.28 U/g),到块茎形成期急剧升高,达到最大值(29.80~71.21 U/g),到块茎膨大期急剧下降(21.64~35.77 U/g,和幼苗期POD酶活性值相近),到淀粉积累期下降到最低点(14.17~21.37 U/g)(图2)。
从品种方面分析,在4个生育期内感染PLRV的‘陇薯3号’植株叶片POD活性相对增量显著高于感染PLRV的‘LK99’;感染PVY的‘陇薯3号’植株叶片POD活性相对增量在幼苗期和淀粉积累期内显著高于感染PVY的‘LK99’,而在块茎形成期和块茎膨大期感染PVY的‘陇薯3号’植株叶片POD活性相对增量显著低于感染PVY的‘LK99’。从两种病毒的危害程度方面分析,感染PVY后‘陇薯3号’植株叶片POD活性相对增量在幼苗期、块茎形成期、块茎膨大期显著低于感染PLRV的‘陇薯3号’,在淀粉积累期却相反;感染PVY后‘LK99’植株叶片POD活性相对增量在幼苗期、块茎形成期显著低于感染PLRV的‘LK99’,而在块茎膨大期、淀粉积累期却相反(表4)。

表4 病毒侵染后马铃薯叶片POD活性相对增量Table 4 Relative increment of POD activity in potato leaves after virus infection
2.2.3 过氧化氢酶(CAT)活性的变化
无论是未感染病毒的马铃薯品种,还是已被PVY、PLRV 感染的马铃薯品种,其植株体内CAT活性的变化随着生育期进程的推进呈线性升高趋势,到淀粉积累期植株体内CAT活性值上升到最高点。并且同一品种内,除感染了PLRV的‘陇薯3号’在幼苗期与未感病的‘陇薯3 号’没有显著差异之外,其他生育期内感染了PVY或PLRV的两个马铃薯品种植株叶片的CAT活性均显著高于未感病植株叶片的CAT活性,且差异显著(图3)。
从品种方面分析,在4个生育期内感染了PVY的‘陇薯3号’植株叶片CAT活性相对增量均高于感染PVY了的‘LK99’,但是只在幼苗期和淀粉积累期差异显著;感染了PLRV的‘陇薯3号’植株叶片CAT活性相对增量在块茎形成期和淀粉积累期内显著高于感染了PLRV的‘LK99’,而在幼苗期和块茎膨大期差异不显著。从2 种病毒的危害程度方面分析,感染了PVY的‘陇薯3号’和‘LK99’植株叶片CAT活性相对增量在4个生育期内均显著高于感染了PLRV的‘陇薯3号’和‘LK99’(表5)。
2.3 丙二醛(MDA)含量的变化
无论是未感染病毒的马铃薯品种,还是已被PVY、PLRV 病毒感染的马铃薯品种,其植株体内MDA 含量的变化随着生育期进程的推进呈上升趋势,到淀粉积累期达到最高,这可能与植株的老化进程有关。从两个品种整体而言,植株体内MDA含量均表现为感染了PLRV的植株>感染了PVY的植株>未感染病毒植株,这可能表明PLRV对植株细胞膜的破坏程度较PVY严重(图4)。
从品种方面分析,在4个生育期内感染了PVY的‘陇薯3号’植株叶片MDA含量相对增量均显著高于感染了PVY的‘LK99’;感染了PLRV的‘陇薯3号’植株叶片MDA含量相对增量在幼苗期、块茎形成期和淀粉积累期内显著高于感染了PLRV的‘LK99’,而在块茎膨大期表现相反。从两种病毒的危害程度方面分析,感染了PVY的‘陇薯3号’和‘LK99’植株叶片MDA含量相对增量在4个生育期内均显著低于感染了PLRV的‘陇薯3号’和‘LK99’(表6)。
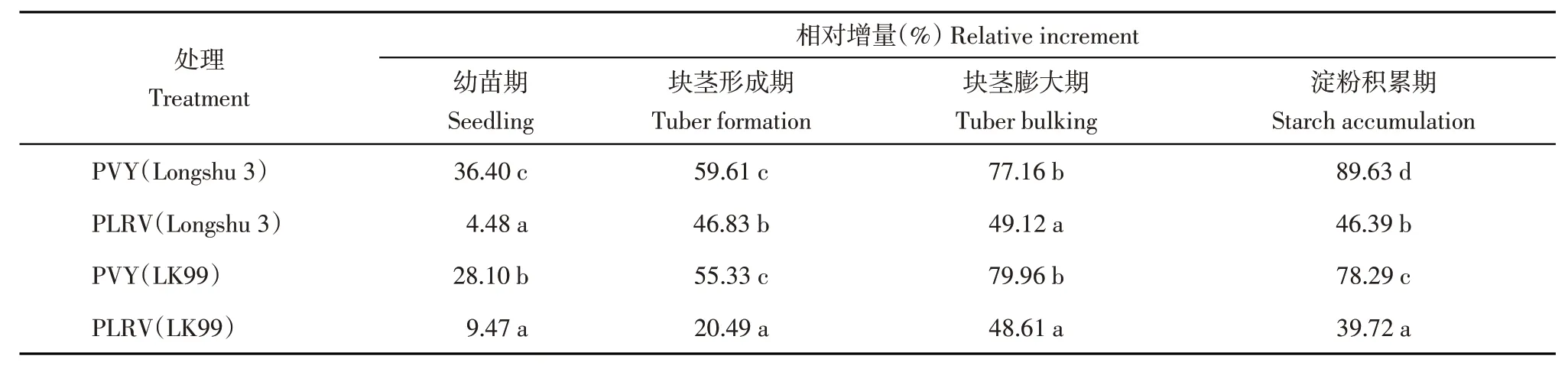
表5 病毒侵染后马铃薯叶片CAT活性相对增量Table 5 Relative increment of CAT activity in potato leaves after virus infection
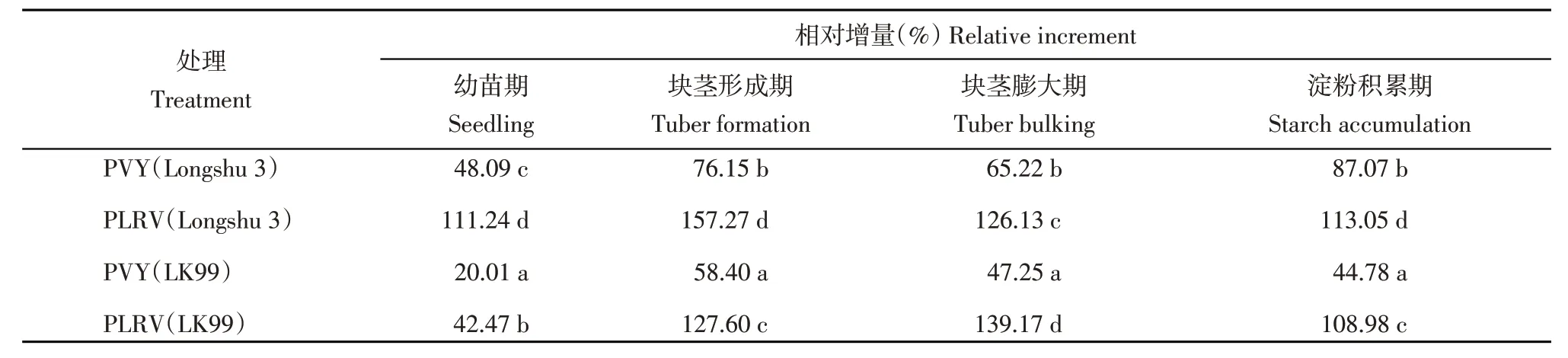
表6 病毒侵染后马铃薯叶片MDA含量相对增量Table 6 Relative increment of MDA content in potato leaves after virus infection
2.4 病毒侵染对马铃薯植株叶片叶绿素含量的影响
2个品种正常植株叶片中总叶绿素含量均显著高于感病植株,且‘LK99’植株叶片中总叶绿素含量显著低于‘陇薯3号’,感染了PVY植株的叶片叶绿素含量显著高于感染了PLRV的植株;同时,两个正常品种植株随着生育进程的推进,叶片中总叶绿素含量逐步升高,在块茎膨大期达到最大值,为幼苗期的119.7%~158.0%,然后叶片中总叶绿素含量开始降低到低于幼苗期总叶绿素含量;感染PVY或PLRV植株叶片中总叶绿素含量到块茎形成期达到最高,然后开始下降,到淀粉积累期下降到幼苗期的7.7%~20.6%(图5)。可能说明马铃薯植株感染PVY或PLRV 后,叶绿体结构和功能受到破坏或干扰,使体内叶绿素的合成受阻,也可能是病毒导致叶绿素分解酶活性上升,从而使叶绿素含量下降。
从品种方面分析,在幼苗期两个品种总叶绿素含量相对减量无显著差异,在其他3 个生育期内分别感染了PVY 和PLRV 的‘陇薯3 号’植株叶片总叶绿素含量相对减量均显著高于分别感染了PVY 和PLRV 的‘LK99’。从2 种病毒的危害程度方面分析,感染了PVY 的‘陇薯3 号’和‘LK99’植株叶片总叶绿素含量相对减量在4 个生育期内均低于感染了PLRV 的‘陇薯3 号’和‘LK99’,但是只有在块茎形成期的‘陇薯3 号’和幼苗期、块茎膨大期的‘LK99’植株叶片总叶绿素含量相对减量差异显著(表7)。

表7 病毒侵染后马铃薯叶片叶绿素含量相对减量Table 7 Relative decrement of chlorophyll content in potato leaves after virus infection
3 讨 论
本研究测定了马铃薯植株农艺性状以及马铃薯叶片的一些生理生化指标,在一定程度上解释了马铃薯植株感染马铃薯Y病毒(PVY)和马铃薯卷叶病毒(PLRV)后的植株变化。植株的株高、茎粗、单株鲜重、单株薯重都是评价马铃薯农学特性的重要指标,研究中马铃薯植株感染病毒后,株高、茎粗、单株鲜重、单株薯重都不同程度的表现为降低的趋势,这与理论上的预期是相符的,植株感病后细胞受到病毒的伤害,细胞的正常生理生化受到影响,进而影响了细胞的物质合成,最终导致植株的部分农艺特性降低,例如株高变矮、鲜重及薯重降低(表1)。本试验显示PLRV对植株株高的影响显著大于PVY,而在茎粗、鲜重、薯重方面PVY的影响更为显著;数据也显示了PVY对‘陇薯3号’的影响显著大于‘LK99’,PLRV对‘陇薯3号’的影响也显著大于‘LK99’(表2)。综合以上结果可能说明在农艺性状方面PVY对植株的损伤程度较PLRV严重,晚熟品种‘陇薯3号’对PVY或PLRV的反应比中早熟品种‘LK99’敏感。
活性氧的变化可以作为植物生理生化变动的指标[17,18],病毒病是影响植物正常生理生化代谢以及导致植物过早衰老的重要因素,当植株受到病原物侵染后植株体内活性氧含量将会增加,此时SOD、POD、CAT 等重要的内源性活性氧清除剂会被启动,并产生一系列不同程度的生化反应[19,20]。有研究发现葡萄花叶病毒会导致葡萄活性氧的积累,当番茄和黄瓜受到病毒侵染后叶片中SOD 活性明显升高[21,22],本试验研究结果也显示植株感病后SOD、POD、CAT活性明显增强,可能说明在病毒胁迫下植株体内产生了更多的活性氧自由基,植株需要启动并增强活性氧自由基的清除能力,以保证植株自身的正常生长(图1、2、3)。同时,试验结果也表明晚熟品种‘陇薯3号’感染PVY或PLRV后植株SOD、CAT活性相对增量高于中早熟品种‘LK99’,而2个品种的POD活性在不同生育期表现并不一致;以SOD、POD活性相对增量分析两个品种都表现为对PLRV 的应激反应比对PVY 强烈,因为植株感染PLRV后SOD、POD活性相对增量比感染PVY后的要高,而以CAT活性分析结果呈现相反趋势,综合分析可能说明晚熟品种‘陇薯3 号’对PVY 或PLRV的反应比中早熟品种‘LK99’敏感,植株对PLRV的应激反应比对PVY强烈(表3、4、5)。
MDA是植株细胞膜脂质过氧化作用的重要指示物,可以用来反应细胞膜脂质过氧化程度和植株抗应激反应的强度,MDA在植株的浓度可以表示植株细胞膜受到破坏的程度[23]。MDA含量表现为受到病毒感染的植株>正常植株,可能表明马铃薯植株细胞膜受到了PVY或PLRV的破坏(图4);感染了PVY或PLRV的‘陇薯3号’植株叶片MDA含量相对增量明显高于感染了PVY 或PLRV 的‘LK99’,感染了PLRV的‘陇薯3号’和‘LK99’植株叶片MDA含量相对增量均显著高于感染了PVY 的‘陇薯3 号’和‘LK99’,这可能说明PVY 或PLRV 对晚熟品种‘陇薯3 号’细胞膜的破坏较中早熟品种‘LK99’严重,PLRV 对植株细胞膜的破坏比PVY 严重(表6)。在感染PVX 和烟草花叶病毒(TMV)的番茄植株中,也有叶绿素含量降低的报道[24,25]。黄瓜花叶病毒和番茄黄曲叶病毒,以及在许多其他被不同病毒感染的寄主植株中,叶绿素含量都表现出降低的趋势[23,26-30]。叶绿素含量的变化是植株在渗透胁迫下的重要特征之一,Barutçular 等[31]认为叶绿素的变化是一个很好的指示植株渗透压力的指标。PVY或PLRV 感染马铃薯植株后,马铃薯植株叶片的叶绿体被破坏,叶绿素含量会明显下降[32]。本研究也显示了相同的趋势(图5);感染了PVY和PLRV的‘陇薯3号’植株叶片总叶绿素含量相对减量均显著高于分别感染了PVY 和PLRV 的‘LK99’,感染了PLRV的‘陇薯3号’和‘LK99’植株叶片总叶绿素含量相对减量均高于感染了PVY的‘陇薯3号’和‘LK99’(表7),试验结果可能说明PVY或PLRV对晚熟品种‘陇薯3号’的影响较中早熟品种‘LK99’严重,PLRV对植株的破坏比PVY严重。综上所述,本研究结果可能表明感染了PVY或PLRV的马铃薯植株衰老速度明显快于正常植株,PVY或PLRV均能够显著影响马铃薯植株的一些正常生理功能,从而导致马铃薯植株生长受到抑制,产量降低。从块茎产量降低、有关保护酶(SOD、POD、CAT)活性增强、丙二醛含量升高、总叶绿素含量减少的情况分析,晚熟品种‘陇薯3号’对PVY或PLRV的反应比中早熟品种‘LK99’敏感,受到病毒的损害程度也比中早熟品种‘LK99’严重;同时以块茎产量作为评价标准,也表明PVY对植株的损伤程度较PLRV严重。

