白蛋白结合型紫杉醇治疗晚期非脑转移乳腺癌患者的疗效分析
王春燕
包头市肿瘤医院淋巴乳腺肿瘤内科,内蒙古包头 014000
乳腺癌为目前临床上常见的一种发生在乳腺腺上皮组织的恶性肿瘤,具有非常高的发病率和致死率[1]。目前临床对于该病的治疗方式主要有手术、化疗、分子靶向、放疗、内分泌治疗等,为提高患者保乳率,化疗在乳腺癌治疗中发挥了很大作用。紫杉醇一直被广泛应用于乳腺癌治疗,但传统紫杉醇水溶性差,使用时需应用助溶剂,导致不良反应明显增多,且在晚期癌症患者中治疗效果不佳,白蛋白结合型紫杉醇可更好地发挥抗肿瘤活性成分作用,近年来临床应用较多[2]。基于此,该研究回顾性分析该院于2018年5月—2019年4月收治的37例接受白蛋白结合型紫杉醇治疗的晚期非脑转移乳腺癌患者的临床资料,旨在探讨白蛋白结合型紫杉醇的临床应用效果及安全性,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析该院收治的37例晚期非脑转移乳腺癌患者的临床资料,所选病例均经过该院医学伦理委员会批准。患者年龄 33~63 岁,平均年龄(48.96±3.43)岁;其中,一线化疗22例,二线化疗15例;身体质量指数17.8~24.8 kg/m2,平均身体质量指数(21.53±1.49)kg/m2,既往用药包括蒽环类、紫衫醇等,经患者同意采用白蛋白结合型紫杉醇治疗。
1.2 入选标准
(1)纳入标准:①均经过病理学或细胞学检测确诊,符合《中国抗癌协会乳腺癌诊治指南与规范(2015版)》[3]中乳腺癌诊断标准者;②美国东部肿瘤协作组(ECOG)活动状态评分0~2分者;③预计生存时间≥3个月者;④可测量病灶≥1个 (磁共振成像或螺旋CT测量病灶直径≥10 mm);⑤卡氏评分(KPS)≥60分;⑥外周血中性粒细胞数>1 500 mm3。(2)排除标准:①精神疾病者;②存在药物过敏使者;③肝肾等器官功能衰竭,存在化疗禁忌证者。
1.3 方法
所有患者均采用白蛋白结合型紫杉醇治疗:白蛋白结合型紫杉醇(国药准字H20183044),剂量为260 mg/m2,静脉滴注时间控制在30 min内,滴注中密切观察滴注部位,警惕血管渗漏情况,给药3周/次。以3周为1个化疗周期,治疗6个周期。
1.4 评价指标
①治疗6个周期后,评估临床疗效。疗效标准[4]:完全缓解(CR):所有目标病灶消失;部分缓解(PR):基线病灶长径总和缩小≥30%;疾病进展(PD):基线病灶长径总和增加1 cm超过20%或出现新病灶;疾病稳定(SD):基线病灶长径总和出现缩小但未达部分缓解或病灶出现增加但未达疾病进展;客观缓解率(ORR)=(CR例数+PR例数)/总例数×100%。②观察患者治疗期间不良反应,包括白细胞减少、血小板减低、中细粒细胞减少、乏力、谷草转氨酶(AST)/谷丙转氨酶(ALT)升高、恶心呕吐、肌肉关节痛、感觉神经毒性、手足综合征,分级标准[4]:1级:仅有轻度反应,为临床或诊断所见,不需治疗干预;2级:中度反应,需要给予局部或非侵入性治疗,与同龄人相比有一定日常生活活动受限;3级:有严重不良反应,但尚未危及生命,可导致治疗时间延长,甚至致残;4级:不良反应极为严重,危及生命,需给予紧急治疗。
2 结果
2.1 客观缓解率
采用白蛋白结合型紫杉醇治疗患者中3例CR(8.11%),17 例 PR(45.95%),5 例 PD(13.51%),12 例 SD(32.43%),ORR 为 54.05%。
2.2 不良反应
采用白蛋白结合型紫杉醇治疗整体不良反应情况良好,其中,中细粒细胞减少、乏力、恶心呕吐、感觉神经毒性是较为常见的不良反应,较为强烈的不良反应(≥3级)包括白细胞减少、血小板减低、中细粒细胞减少、乏力。患者具体不良反应情况见表1。
3 讨论
近年来乳腺癌发病率逐年升高,临床统计发现,我国乳腺癌发病率远高于国际发病率,约占女性患者的16%,已居于女性各种恶性肿瘤发病率首位。但随着医学技术的日益进步以及学者对乳腺癌筛查工作的不断开展与深入,该病患者预后普遍得以改善[5]。临床对晚期非脑转移乳腺癌患者的治疗原则主要为缓解患者疼痛、控制癌细胞扩散、抑制病情进一步发展,进而改善患者生存质量,增大其存活率以及延长生存时间。化疗作为目前治疗癌症最有效的手段之一,对一些存在全身散播倾向的肿瘤和已经转移的中晚期肿瘤均有较好的治疗作用,化疗因可消除晚期乳腺癌患者转移病灶、提高其保乳率而被临床广泛应用于晚期非脑转移乳腺癌患者的治疗[6]。
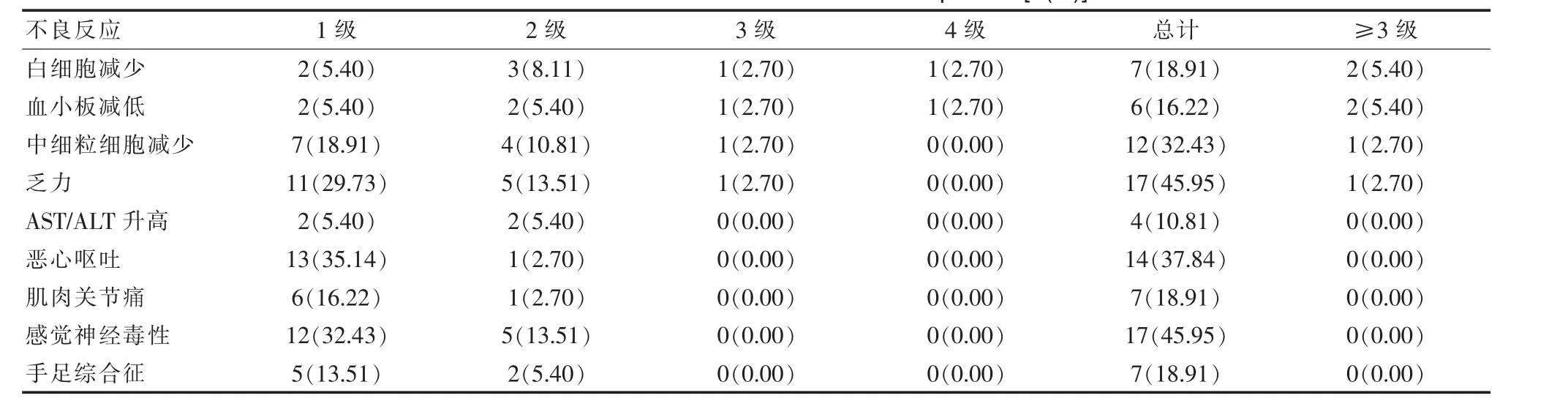
表1 患者不良反应发生情况[n(%)]Table 1 The incidence of adverse reactions in patients[n(%)]
紫杉醇是目前已发现的最有效的天然抗肿瘤药物,从红豆杉的树皮中分离纯化得到,因天然来源有限且分离难度较大,所以目前多以合成药物为主。作为一种具有抗癌活性的二萜生物碱类化合物,因紫杉醇具有全新独特的作用机制以及广泛而显著的生物活性等特点而受到了学者的极大青睐。紫杉醇通过作用于微管系统,促进微管蛋白聚合,抑制其解聚,阻碍微管的动态重组,从而使有丝分裂的纺锤体失去正常功能,染色体分裂异常或停止分裂,细胞停留在分裂间期,最终阻碍肿瘤细胞的活跃分裂,使其周期停止直至死亡[7]。此外,紫杉醇还可以通过作用于巨噬细胞上的肿瘤坏死因子受体,促进细胞因子的释放,起到发挥免疫调节功能,杀伤肿瘤细胞[8]。进一步研究发现,该药引起的手足综合征等不良反应明显,且水溶性极差,易溶于甲醇、乙腈、氯仿、丙酮等有机溶剂,使用时需使用有毒性的助溶剂,加大不良反应发生率,增加毒性反应,且助溶剂会在一定程度上阻断胞吞作用,限制了紫杉醇发挥出最佳治疗效果[9]。因此,临床对于不具有助溶剂型紫杉醇的毒性反应、能够增加肿瘤内部药物摄取而非正常细胞对药物特异性的优先摄取,可增加抗肿瘤活性以及提高治疗效果的新型紫杉类药物迫切需要。白蛋白结合型紫杉醇是通过纳米技术将紫杉醇与人体血清白蛋白结合,无需使用助溶剂,利用了白蛋白独特的转运功能,可对肿瘤细胞进行靶向给药,静脉滴注后,微粒中的药物可迅速释放,提高肿瘤细胞内的药物浓度,增加紫杉醇的针对性,使给药量得以减小,缩短给药时间,极大提高了单位浓度紫杉醇治疗的有效率,且能够减少手足综合症的发生,提高了该药治疗的安全性。此外,该药使用前无需进行预处理,使用方便。该研究结果显示,采用白蛋白结合型紫杉醇治疗晚期非脑转移乳腺癌患者后,CR 有 3例(8.11%),PR 有 17例(45.95%),PD 有 5例(13.51%),SD 有 12例(32.43%),ORR 为 54.05%,而范丽萍等[10]的研究结果显示,采用白蛋白结合型紫杉醇治疗转移性乳腺癌后,36例患者中无 CR病例,PR有 17例(47.22%),SD 有 14例 (38.89%),PD 有 5例 (13.89%),ORR为47.22%,这与该研究结果相近,但范丽萍等研究中的ORR比该研究低,可能是因为所选病例中存在预后较差的肿瘤远端转移患者。此外,该研究中,不良反应状况为白细胞减少 7例 (18.91%),血小板减低 6例(16.22%)、中细粒细胞减少12例 (32.43%)、乏力17例(45.95%)、谷草转氨酶(AST)/谷丙转氨酶(ALT)升高 4 例(10.81%)、肌肉关节痛 7例(18.91%)、感觉神经毒性17例(45.95%)、手足综合征7例(18.91%),而范丽萍等的研究显示应用白蛋白结合型紫杉醇后,患者主要不良反应为乏力6例(16.67%),骨髓抑制4例(11.11%),周围神经毒性3例(8.33%),其他不良反应较少,这与该研究有一定差异,但该研究中患者的不良反应大多较为轻微,提示白蛋白结合型紫杉醇的安全性较高。
综上所述,白蛋白结合型紫杉醇对晚期非脑转移乳腺癌患者具有较好的临床治疗效果,不良反应较少,安全性较高。

