系统性红斑狼疮相关上气道梗阻一例
彭琳一, 高俊义, 赵久良, 赵丽丹, 费允云, 张文, 曾小峰, 张奉春
作者单位:100730 北京,中国医学科学院 北京协和医学院 北京协和医院风湿免疫科,风湿免疫病学教育部重点实验室,国家皮肤与免疫疾病临床医学研究中心(彭琳一、赵久良、赵丽丹、费允云、张文、曾小峰、张奉春);基本外科(高俊义)
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种好发于育龄期女性自身免疫性炎症性结缔组织病,临床上可出现各个系统和脏器损伤的表现。喉部受累所致上气道梗阻是该病的罕见表现,因存在窒息风险,需要积极与耳鼻喉科协作,鉴别其他喉部疾病,尽早加强免疫抑制治疗。现报道一例以喉部受累、呼吸困难为主要表现的SLE,以提高临床医生对SLE这一特殊临床表现的认识。
1 病例报告
患者女,36岁。因“面部红斑、关节痛10年,呼吸困难6月”于2017年1月12日入住北京协和医院。2006年患者因双颊部皮疹、多关节肿痛,在当地医院查抗核抗体、抗双链DNA抗体均(+),诊断“SLE”,予泼尼松40 mg 每日一次、羟氯喹0.1 g每日两次、甲氨蝶呤10 mg 每周一次治疗,症状好转,后泼尼松规律减量为5 mg每日一次、甲氨蝶呤1年后停用、羟氯喹0.1 g 每日两次维持治疗。2016年6月患者自觉活动后气短,伴喉部紧缩感,不伴发热、咳嗽、声嘶、胸痛,未就诊。2016年9月再发面部红斑及多关节痛,查:C3 0.703 g/L(0.73~1.46 g/L),C4 0.076 g/L(0.1~0.4 g/L)。抗双链DNA抗体免疫荧光法(IF)(+)1∶10/酶联免疫吸附(ELISA)277 IU/mL。羟氯喹加量至0.2 g每日二次后皮疹、关节痛症状有所好转,但呼吸困难逐渐加重,上2层楼自觉气短。2017年1月9日就诊本院,查肺功能:大气道梗阻表现,可逆试验阴性,无弥散功能障碍。胸部CT+气道重建:气管平胸骨凹水平右侧壁、隆突前壁略厚。遂收入风湿免疫科进一步诊治。既往曾双侧扁桃体切除术;甲状腺结节史;无哮喘、慢性支气管炎、慢性阻塞性肺疾病病史,无食物、药物过敏史。否认免疫病家族史。入院查体:体温37 ℃,心率89次/min,呼吸频率20次/min,血压120/71 mmHg,指氧饱和度99%(不吸氧状态下)。双颧部红斑,凸出皮肤平面。气管居中,胸廓外形正常。吸气时可见三凹征;耳廓及鼻梁无红肿畸形,胸廓无压痛,双侧触觉语颤对称,未及胸膜摩擦感;双肺呼吸音低,未闻及干湿啰音及胸膜摩擦音。关节无红肿、压痛,活动可。心、腹及神经系统查体未见明显异常。辅助检查:血常规、肝肾功能正常。尿常规+流式尿沉渣分析:蛋白(白蛋白)0.3 g/L,红细胞(潜血)25 cells/μL;24 h尿蛋白 0.59 g。血沉 30 mm/h,超敏C反应蛋白2.92 mg/L。免疫球蛋白正常。抗核抗体(+)均质型1∶640,抗双链DNA抗体 IF(+)1∶10/ELISA 225 IU/mL,抗Sm抗体(-),抗核糖体核糖核蛋白抗体(+++)。抗心磷脂抗体、抗β2糖蛋白1抗体、狼疮抗凝物、抗中性粒细胞胞浆抗体(ANCA)谱均为阴性。感染方面筛查结核感染T细胞斑点实验(T.SPOT-TB)阴性,β-D葡萄聚糖检测(G试验)、半乳糖甘露醇聚糖抗原检测(GM试验)阴性。血清免疫固定电泳、尿免疫固定电泳均阴性,血尿轻链在正常范围,肺癌标记物筛查阴性。全身骨显像:左侧腕关节、右侧膝关节异常,考虑炎性病变。超声心动图:左室射血分数66%,肺动脉收缩压28 mmHg。喉薄扫CT(图1A):右侧声带增厚,声门腔狭窄。完善颈部软组织动态增强MRI(图1B):喉腔两侧壁不同程度增厚,局部呈结节样突向喉腔内,以右侧声带增厚及环状软骨左侧较明显,多考虑为系统性疾病累及所致。电子喉镜(图1C):声门下组织环形增厚,堵塞气道,左右最大间隙约4~5 mm,考虑声门下狭窄。诊疗经过:患者SLE明确,目前系统性红斑狼疮疾病活动度评分(SLEDAI评分)14分(蛋白尿4分,镜下血尿4分,补体减低2分,抗dsDNA 2分,皮疹2分),提示病情中度活动,考虑喉部病变为SLE气道受累表现。遂予甲泼尼龙80 mg 每日一次静脉输液,14 d后序贯为泼尼松60 mg 每日一次,加用环磷酰胺0.4 g 每周一次静脉注射,羟氯喹0.2 g每日两次口服,辅以布地奈德雾化吸入对症支持治疗。患者症状逐渐缓解,治疗第5天时复查电子喉镜:声门下组织环形增厚大致同前,堵塞气道,左右最大间隙约5~6 mm。正气道上段左侧肿物较前缩小,气管环结构清晰。治疗第16天时,患者呼吸困难症状完全缓解,面部红斑消退。复查电子喉镜(图1D):声门下组织环形增厚较前有所减轻,左右最大间隙约10 mm,正气道上段左侧肿物较前缩小,气管环结构清晰。肺功能:最大肺活量(FVC)100%,一秒用力呼气容积(FEV1)94.8%,FEV1/FVC 97.2%。患者病情平稳出院。出院后,患者激素规律减量,口服泼尼松5 mg 隔日一次,环磷酰胺累计至9 g后改为口服来氟米特20 mg每日一次,羟氯喹0.2 g 每日两次。目前随访2年余,病情稳定,未再发作呼吸困难等不适,出院8个月及1年时复查电子喉镜,均未见明显异常。
2 讨论
SLE是一种病因不明的慢性炎症性疾病,其临床表现多样,可累及几乎所有器官,不同患者表现迥异。常见的受累器官或系统包括皮肤、肌肉与骨骼、肾脏、血液系统、肺脏、消化系统及神经系统等[1-3]。约4%~10%的SLE患者以呼吸系统受累为起病的首要表现,其中胸腔积液、狼疮肺炎、肺高压、肺泡出血及肺间质病较为常见,而喉部受累所致大气道梗阻十分罕见[4-5]。本例患者为青年女性,慢性病程,主要表现为颊部红斑、关节痛,近半年出现活动后气短。实验室检查提示补体减低、抗核抗体、抗双链DNA阳性,SLE诊断明确。在小剂量激素和羟氯喹维持治疗过程中出现病情反复,表现为逐渐加重的呼吸困难伴皮疹、关节痛的复发,新出现的镜下血尿、蛋白尿,提示病情活动。影像学和喉镜检查提示声门下软组织肿胀导致声门狭窄和大气道梗阻。根据患者出现气道梗阻表现与SLE疾病活动的平行性,临床首先考虑SLE气道受累的表现,但需要和以下病因进行鉴别诊断:感染性疾病如结核、真菌感染;自身免疫性疾病:抗中性粒细胞胞浆抗体(ANCA)相关血管炎、复发性多软骨炎、IgG4相关疾病;肿瘤性疾病包括淀粉样变性、淋巴增殖性疾病、喉部实体肿瘤等。感染方面,患者无发热、盗汗及系统感染的临床表现,炎症指标正常,筛查T.SPOT-TB阴性,G实验、GM实验阴性,喉镜下无脓肿、白斑等为不支持点。患者缺乏耳鼻症状,ANCA阴性,不支持并发ANCA相关血管炎及复发性多软骨炎。由于该部位穿刺出血风险极高,未进行穿刺活检。但镜下无溃疡,血免疫固定电泳阴性,影像检查无全身网状内皮系统增生表现,无消耗症状,暂不支持恶性疾病,在排查了感染的基础上,通过治疗患者病情快速缓解,随访2年余,病情持续稳定,进一步除外了恶性疾病可能,证实喉部肿物与SLE相关。
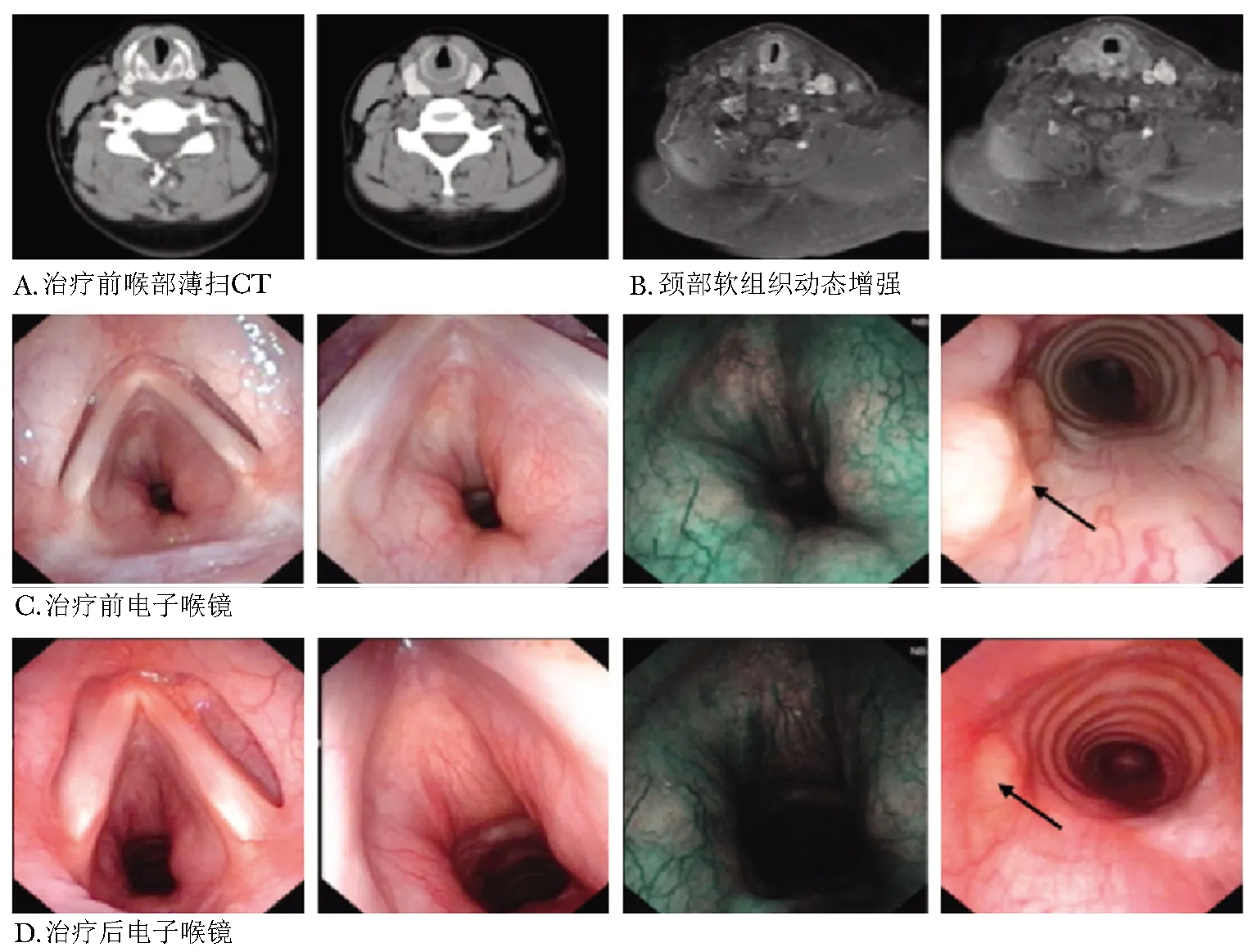
图 1治疗前影像学表现及治疗前后电子喉镜检查
A:治疗前,喉薄扫CT示右侧声带增厚,声门腔狭窄;B:治疗前,颈部软组织动态增强MRI示喉腔两侧壁不同程度增厚,局部呈结节样突向喉腔内,以右侧声带增厚及环状软骨左侧较明显;C:治疗前,电子喉镜示声门下组织环形增厚,左右最大间隙约4~5 mm,正气道上段左侧可见肿物(黑色箭头);D:甲泼尼龙治疗第16天,电子喉镜示声门下组织环形增厚较前有所减轻,左右最大间隙约10 mm,正气道上段左侧肿物较前缩小(黑色箭头)
SLE患者喉部病变轻重不一,临床差异非常大,从无症状到危及生命的上气道梗阻,文献报道发生率迥异,0.3%~30%不等[6-8]。轻者仅表现为轻微黏膜炎症,重者可出现声带麻痹,环杓关节炎,严重的炎症水肿可导致上气道梗阻[6,8]。病变部位可累及前庭会厌、声门下、声带或弥漫性喉水肿[6]。临床症状通常由病变部位和程度决定,包括咽痛、咳嗽、呼吸困难、吞咽困难、声音嘶哑和喘鸣[8-9]。
通过检索PubMed、CNKI及万方数据库,提示SLE喉部受累出现上气道梗阻仅有多例个案报道,为SLE的罕见临床表现。1959年Scarpelli等[10]最早报道了一例SLE累及喉部所致上气道梗阻的病例,该21岁男性患者最终因严重的急性喉部水肿而死亡,尸检病理提示喉部明显水肿,黏膜下组织增厚,组化染色提示黏膜固有层及肌纤维中组织细胞、淋巴细胞、浆细胞、肥大细胞浸润,偶可见血管周围淋巴细胞浸润。1978年Smith等[13]报道了一例多年未经治疗的SLE喉部受累、声门狭窄的病例,由于未及时治疗,最终导致瘢痕形成,需要气管切开术减轻气道阻塞。2002年Karim等[9]报道了一例SLE有Jaccord关节病变的患者出现环杓关节炎、声带麻痹、大气道梗阻,对大剂量激素反应欠佳,后通过气管切开术缓解症状。
SLE累及喉部的病理生理机制尚不明确,但免疫复合物的组织沉积与补体的激活可能是其原因[9]。有学者提出是由于抗原抗体复合物在喉部软骨处沉积,引起软骨细胞溶酶体释放大量炎性介质,最终导致了局部炎症反应的发生[11]。在急性阶段,表现为黏膜溃疡、水肿,黏膜下血肿,浆膜炎,环杓关节炎, 此时积极应用糖皮质激素,效果较好。在慢性阶段,表现为声带炎症、肿物、黏膜增厚以及喉部瘢痕狭窄[8],可能危及患者生命,必要时可行气管切开术[6,8]。因此对于SLE出现喉部临床症状时,应尽早进行评估,开展治疗。
本例患者电子喉镜提示声门下组织环形增厚,正气道上段左侧肿物。给予糖皮质激素及免疫抑制剂治疗第8天,患者呼吸困难症状明显缓解。治疗第16天,呼吸困难等症状基本完全消失;复查电子喉镜示声门下组织环形增厚较前减轻。由此可见,病程中患者气道肿物的大小变化与SLE面部红斑、血清学指标变化等全身活动征象呈现时空上的一致性,予激素及免疫抑制剂治疗后,患者面部红斑逐渐消退,同时气道肿物亦明显缩小,气道梗阻解除。综合排除性检查结果以及药物治疗效果,基本可以判断该患者气道肿物系SLE累及气道所致。治疗方面,张杏书等[12]报道了两例治疗SLE咽喉综合征的成功的案例,两例患者分别在大剂量激素治疗后的第5天及第8天出现症状缓解、咽喉部水肿消退。该类患者的治疗视病情轻重可给予中-大剂量糖质激素或者冲击剂量的激素治疗,联合免疫抑制剂,如环磷酰胺、硫唑嘌呤等,重症呼吸困难时可考虑气管切开术[11,13]。
综上所述,尽管SLE累及喉部出现大气道梗阻的发生率较低,但是该类并发症存在窒息等致命风险,临床医师应提高对该并发症的认识及重视程度。值得一提的是,包括类风湿关节炎、干燥综合征、复发性多软骨炎等在内的多种自身免疫性疾病也可出现类似的喉部受累病变。因此,当临床上遇到呼吸困难且具有自身免疫疾性病基础的患者,应谨慎判断病情,对可能存在的喉部受累情况做出完善的评估。然而,由于该类并发症的发生率较低,加之免疫科医师普遍对喉部检查方法(如喉镜等)的熟悉度较低,使得首诊的免疫科医师很容易出现漏诊;另一方面,耳鼻喉科医师对SLE等结缔组织病的认识程度往往也存在欠缺,难以对结缔组织疾病累及喉部的病情做出准确判断,因此,需要免疫科、耳鼻喉科医师积极合作,才能最大程度上保证相关患者及时得到正确的疾病评估与治疗。

