利格列汀对2 型糖尿病合并帕金森病患者运动功能影响的临床研究
管雅文,金水平,陈建华,金 涵,马 刚,潘 娜
帕金森病(Parkinson′s disease,PD)是以黑质纹状体变性和与之相关的脑内多巴胺的合成减少为主要病理特征的慢性进行性脑神经变性疾病,表现为逐渐进展的运动症状如静止性震颤、肌强直、运动迟缓、姿势步态异常及非运动症状如吞咽困难、便秘、抑郁状态、思维迟钝、视幻觉等[1-2]。 帕金森病的病因尚未完全阐明,多数学者认为可能与环境、免疫学异常、线粒体功能障碍、氧化应激、年龄老化、细胞凋亡等因素有关。 目前已经明确,黑质致密部(substantia nigra compact,SNC)多巴胺能神经元变性缺失及纹状体多巴胺水平降低是诱导帕金森病的起始因素[1]。 目前,帕金森病的治疗以改善症状为主,并不能阻止疾病进展,而且所用相关药物均存在不良反应[3]。
糖尿病与帕金森病有许多共同的病理生理机制,如胰岛素抵抗、线粒体功能障碍、内质网应激、炎症和细胞凋亡等。 尤其炎症对胰岛细胞的损伤及黑质多巴胺能神经元的破坏起至关重要的作用[4]。 因此,2 型糖尿病和帕金森病之间关系密切。 改善2 型糖尿病合并帕金森病患者的运动功能是目前临床研究的热点。
近年来,胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)类似物艾塞那肽在帕金森病的基础研究及临床试验中均显示出良好的神经保护特性,尤其是可改善帕金森病患者的运动功能,为帕金森病患者的治疗迎来新的曙光[3,5]。 而二肽基肽酶4(dipeptidyl peptidse 4,DPP4)抑制剂能够抑制体内内源性GLP-1 及葡萄糖依赖性促胰岛素分泌多肽(glucose-dependent insulinotropic polypeptide,GIP)的灭活,使内源性GLP-1 升高2 ~3 倍[6],具有重要的临床价值。 目前,已有利格列汀、沙格列汀、维格列汀等DPP4 抑制剂在帕金森病的基础研究中提示具有神经保护特性,但尚无临床研究报道[6-9]。 笔者通过对2 型糖尿病合并帕金森病患者进行相关研究,探讨其临床作用机制及意义。
1 资料与方法
1.1 一般资料 选取2018 年2 月至5 月湖北省武汉市东湖医院内分泌科门诊及住院2 型糖尿病合并帕金森病患者60 例(糖化血红蛋白HbA1c≤7.5%,年龄范围55 ~80 岁)作为研究对象,依照随机数字表法分为观察组和对照组。 观察组30 例,男19 例,女11 例,年龄(65.8 ±8.5)岁,在原治疗方案基础上给予利格列汀(勃林格殷格翰,B17012)5 mg,口服,1 次/d。 对照组30 例,男性18 例,女性12 例,年龄(64.6 ±9.1)岁,在患者原治疗方案基础上给予安慰剂(勃林格殷格翰,U04-1767)。 2 组平均年龄、性别构成、血糖水平等一般资料差异无统计学意义(P >0.05),有可比性。 患者原治疗方案见表1、2。 患者2 型糖尿病均符合1999 年世界卫生组织糖尿病诊断标准,帕金森病参照2014 年英国帕金森病诊断标准。为保证患者的配合度,本研究患者帕金森病Hoehn-Yahr 分级多在1 ~3 级[10]。 所有研究对象知情同意并签署知情同意书,且经过本院伦理委员会批准。
(1)纳入标准:运动迟缓(随意运动、进行性言语和重复动作幅度降低),至少符合下列表现之一:①肌强直;②4 ~6 Hz 静止性震颤;③姿势不稳(非视觉、前庭功能、小脑或本体觉障碍引起)。 (2)排除标准:①反复卒中史,帕金森样症状阶梯性加重;②反复头部外伤史;③明确脑炎病史;④症状出现时有镇静药物治疗史;⑤症状持续缓解;⑥3 年后仍表现为严格单侧症状;⑦核上性麻痹;⑧小脑症状;⑨早期严重的自主神经功能障碍;⑩早期严重的痴呆、记忆、语言和行为异常;○1Babinski 征阳性;○12CT 检查发现有小脑肿瘤或交通性脑积水;○13大剂量左旋多巴(L-dopa)治疗无反应(排除吸收不良);○141-甲基-4-苯基-1,2,3,6-四氢吡啶(1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine, MPTP)接触史。

表1 2 组患者糖尿病原治疗方案(例,每组n=30)

表2 2 组患者帕金森病原治疗方案(例,每组n=30)
1.2 方法 临床资料收集:所有研究对象均由专人测量身高、体质量,并计算体质量指数(body mass index,BMI),具体测量、计算方法如下:(1)身高、体质量:空腹、脱鞋,仅穿内衣由专人用统一工具测量;(2)BMI =体质量(kg)/身高的平方(m2)。 所有研究对象均于隔夜空腹12 h 后采肘静脉血5 ml 分离血清,以罗氏罗康全卓越型血糖仪测定空腹血浆葡萄糖(fasting blood glucose,FBG),美国伯乐公司D-10 测定仪高效液相色谱法测定HbA1c,西门子ADVIA 2400 仪器化学发光法检测空腹胰岛素及白细胞介素-6(interleukin-6,IL-6)水平。 根据FBG 及空腹血胰岛素水平,计算胰岛素抵抗指数(homeostasis model assessment of insulin resistance,HOMA-IR)。
1.3 观察指标 采用Webster 量表和UPDRSPART3 量表比较2 组患者治疗前、治疗12 周、24 周及停用利格列汀和安慰剂12 周(治疗第36 周)后运动功能情况变化,同时比较2 组患者相同时间节点FBG、HbA1c、HOMA-IR、IL-6 水平变化。 观察2 组患者治疗期间有无低血糖、低血压、摔倒等不良事件的发生。
1.4 统计学处理 采用SPSS 21.0 软件对数据进行统计学处理,所有数据以均数±标准差表示,并经正态检验及方差齐性检验,非正态分布计量资料经正态转换后再分析。 组间比较采用t 检验。 P <0.05 表示差异有统计学意义。
2 结果
2.1 治疗效果 2 组患者经过12 周治疗后UPDRS-PART3 和Webster 量表评分以及BMI、FBG、HbA1c、HOMA-IR、IL-6 水平较治疗前差异无统计学意义(P >0.05);24 周后观察组UPDRS-PART3 和Webster 量表评分及HOMA-IR、IL-6 水平较治疗前及对照组均明显降低,差异具有统计学意义(P <0.05);停用利格列汀12 周(治疗第36 周)后,观察组UPDRS-PART3 和Webster 量表评分及HOMAIR、IL-6 水平仍显著低于治疗前及对照组,差异具有统计学意义(P <0.05)。 结果见表3 和表4。
表3 2 组患者治疗前后BMI、FBG、HbA1c、HOMA-IR、IL-6 水平比较(

表3 2 组患者治疗前后BMI、FBG、HbA1c、HOMA-IR、IL-6 水平比较(
注:BMI 为体质量指数,FBG 为空腹血糖,HbA1c 为糖化血红蛋白,HOMA-IR 为胰岛素抵抗指数,IL-6 为白细胞介素-6;与治疗前相比aP <0.05;与对照组相比bP <0.05
指标 例数观察组对照组治疗前 12 周 24 周 36 周 治疗前 12 周 24 周 36 周BMI 30 25.4 ±2.5 25.3 ±2.6 25.1 ±2.4 25.2 ±2.3 25.6 ±2.8 25.5 ±2.9 25.7 ±3.0 25.4 ±3.8 FBG(mmol/l) 30 7.5 ±1.6 7.2 ±1.4 6.9 ±0.8a 7.0 ±0.4a 7.6 ±1.4 7.5 ±3.4 7.6 ±2.6 7.4 ±1.5 HbA1C(%) 30 7.1 ±0.3 6.9 ±0.5 6.8 ±0.3 7.0 ±0.2 7.3 ±0.2 7.3 ±1.3 7.4 ±0.5 7.3 ±0.8 HOMA-IR 30 3.3 ±0.6 2.9 ±0.8 2.8 ±0.7ab 2.8 ±0.6ab 3.4 ±0.4 3.2 ±0.5 3.5 ±1.6 3.6 ±0.6 IL-6(pg/ml) 30 6.8 ±1.2 6.4 ±1.5 4.0 ±0.9ab 4.5 ±0.6a 6.6 ±1.9 7.0 ±1.7 6.7 ±2.0 7.1 ±2.2
表4 2 组治疗前后UPDRS-PART3 和Webster 量表评分情况比较
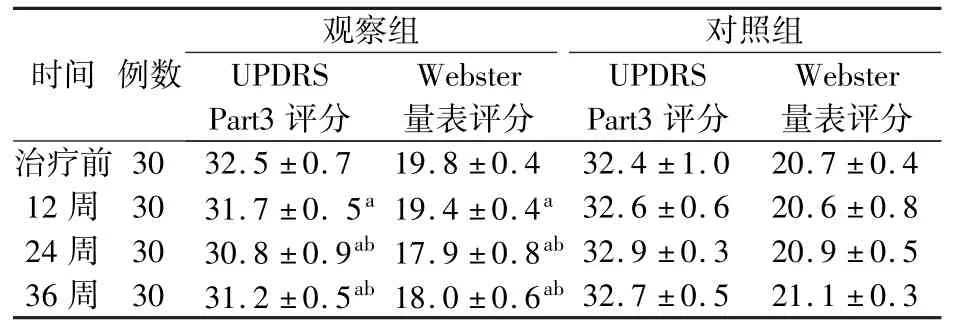
表4 2 组治疗前后UPDRS-PART3 和Webster 量表评分情况比较
注:与治疗前相比aP <0.05;与对照组相比bP <0.05
观察组对照组时间 例数UPDRS Part3 评分Webster量表评分UPDRS Part3 评分Webster量表评分治疗前30 32.5 ±0.7 19.8 ±0.4 32.4 ±1.0 20.7 ±0.4 12 周 30 31.7 ±0. 5a 19.4 ±0.4a 32.6 ±0.6 20.6 ±0.8 24 周 30 30.8 ±0.9ab 17.9 ±0.8ab 32.9 ±0.3 20.9 ±0.5 36 周 30 31.2 ±0.5ab 18.0 ±0.6ab 32.7 ±0.5 21.1 ±0.3
2.2 不良反应 2 组患者中均出现2 次低血糖现象,但未出现严重低血糖事件,未因此而停止研究;未发生严重体位性低血压及平衡失调而摔倒等事件而退出研究病例。
3 讨论
本研究对DPP4 抑制剂利格列汀能否改善2 型糖尿病患者合并帕金森病患者的运动功能进行观察研究,结果提示经过12 周的治疗后运动功能没有明显改善,直至经过24 周的治疗后,运动功能明显改善。 经分析数据发现,经过12 周停用利格列汀的“洗脱期”,相关改善作用继续维持,但程度有所下降。 观察组HOMA-IR 及IL-6 水平相比对照组明显改善,提示胰岛素抵抗及慢性炎症可能是糖尿病与帕金森病共同的病理生理机制。
GLP-1 的受体在体内分布广泛,除胰腺外,肾脏、肺部、心脏、血管内皮细胞、下丘脑、海马、神经元、星型胶质细胞及小胶质细胞均有分布。 作为一种神经营养物质,GLP-1 可透过血脑屏障,除发挥稳定血糖、抑制胰腺β 细胞凋亡作用外,其对神经系统也发挥重要作用[11]。
目前国内外基础及临床研究显示,GLP-1 受体激动剂能改善帕金森病大鼠及小样本量临床患者的运动功能[3,10,12]。 在多个由6-羟基多巴胺(6-OHDA)或MPTP 诱导的帕金森病体外实验模型中发现,Exendin-4 给药后,由PD 导致的动物旋转行为也明显减少[11-12]。 GLP-1 受体激动剂对中枢神经系统有保护功能,可能的机制如下:(1)减轻脑神经元尤其是黑质纹状体的多巴胺能神经元的慢性炎症,增加了在黑质及纹状体中突触的数量,同时可降低外周血清及中脑SNC 脑组织中相关炎性因子白细胞介素-1(interleukin-1,IL-1)水平[11],本研究中亦得到观察组患者外周血清IL-6 水平下降的结果。 (2)缓解黑质多巴胺能神经元的损伤,增加多巴胺合成相关酶的表达,尤其是修复酪氨酸酶在纹状体的表达,促进了多巴胺的释放和传递[11]。 (3)增加纹状体内脑源性神经营养因子(brain derived neurotrophic factor,BDNF)的水平,从而增加多巴胺能神经元的数量,逆转突触的丢失[12]。 (4)改善中枢神经系统的胰岛素抵抗,恢复其胰岛素敏感性,同时改善大脑胰岛素信号的传递[4,13]。 (5)通过提升Bcl-2 蛋白的水平,抑制线粒体凋亡,改善线粒体氧化损伤,增强线粒体功能,提高突触可塑性[14]。 (6)通过抑制激活的星型胶质细胞,保护海马区的突触不受损伤,抑制神经元的凋亡。 (7)GLP-1 受体激动剂可以保护神经细胞抵御氧化应激及兴奋毒性导致的损伤,减少细胞凋亡。 现有研究表明,GLP-1 和Exendin-4 可以保护海马神经元由谷氨酸、Fe2+和缺氧引起的细胞坏死。 GLP-1 受体通路介导激活的cAMP、MAPK等分子也与细胞的增殖分化、生成修复功能息息相关。 DPP4 抑制剂如沙格列汀、维格列汀、利格列汀等在多项基础研究中被证实有对中枢神经系统的神经保护作用[15]。 DPP4 抑制剂除了升高内源性GLP-1 的水平外,还可提升内源性GIP 水平,而后者亦在最新研究中证实有类似GLP-1 的神经保护功能[11]。本研究最后有12 周的“洗脱期”,该阶段观察组HOMA-IR、IL-6 水平与对照组相比仍明显降低,提示利格列汀是通过改善中枢神经系统胰岛素抵抗及慢性炎症而达到持续的疗效。
DPP4 抑制剂利格列汀诱发低血糖的风险极低,因此适合同时用于高血糖及血糖正常状态下的神经性疾病防治。 本研究以观察运动症状为主,而帕金森病患者还兼有许多非运动症状如精神障碍、认知功能障碍等,可进一步进行观察。 本研究尚未观察在运动改善的基础上,能否减少部分患者应用左旋多巴的剂量。 为了患者能更好的配合研究,本研究选择的糖尿病合并帕金森病患者Hoehn-Yahr 分级多在1 ~3 级[10],而DPP4 抑制剂对于糖尿病合并帕金森病Hoehn-Yahr 分级更高、病情及并发症更严重的患者疗效如何,有待进一步研究。

