参附注射液对低温水浴浸泡小鼠肺损伤及生化指标的影响
王 欢,王丽娜,顾 伟
海军作为保卫我国海洋权益的武装力量是当前我军发展的重中之重,渡海作战是海军军事训练的重要内容,训练中意外落水,长时间浸泡海水后发生低体温症的复温救治一直是亟待解决的问题。 在新时期提高海上救治能力无疑是卫勤保障工作的重点,而海上遇险人员中约2/3 遇难者是由于冷海水浸泡导致的体温过低所致[1]。
体温过低可引起严重的心血管功能紊乱及肺水肿等情况,其特点是体温下降、血压下降、心率减慢、肺泡出血、水肿、炎性细胞浸润、肺泡结构破坏、存活率下降等。 若落水官兵得不到及时的复温及抗休克治疗,死亡率可达30% ~80%。 因此,复温是海战落水导致体温过低伤员救治的重要环节。 复温的方法分2 种,主动复温和被动复温,其中被动复温如提高周围环境温度和主动复温中的加热毯法、应用复温装置、热水浴等体表复温方法较适用于轻中度低体温症。 然而对于重度体温过低症伤员,传统的心血管活性药和除颤技术使用受限是复温救治失败的主要原因[2-3]。 针对重度体温过低症的抗休克治疗,目前尚缺乏有效的药物及技术方案。 因此发现一种对低体温症患者敏感的、能有效提高心肌兴奋性,改善肺组织损伤情况的抗休克药物对于海战落水伤员的成功复温救治具有重要的意义。
体温过低症的临床表现与祖国传统医学的“脱证”、“厥证”相一致,传统中医中药对于此类疾病的救治历史悠久,人参、附子等回阳救逆的传统中药已经在临床中广泛应用[4]。 参附注射液源于古方,具有回阳救逆、益气固脱功效,药理实验证实其主要有效成分为人参皂甙和乌头类生物碱。 临床研究表明参附注射液有改善心脏功能,增强心肌细胞对缺血、缺氧的耐受性,强心、升压、稳压,缓解支气管平滑肌痉挛,保护损伤肺组织细胞,调节机体免疫功能等作用[5-8]。 临床广泛应用于休克、心衰、心律失常等疾病,也有用于休克后低体温的复温治疗[9]。
1 材料与方法
1.1 实验动物与器材 健康成年雄性ICR 小鼠50只,体质量为18 ~22 g,购于浙江维通利华实验动物技术有限公司。 参附注射液(雅安三九、国药准字Z51020664、10 ml ×5)、动物体温仪(型号FT3400,南京卡尔文生物科技有限公司生产)、自制悬吊式小鼠水浴固定器(高10 cm,直径2. 5 cm,专利已受理)、泡沫水浴箱[用碎冰将水温控制在(15 ±1)℃]、水温温度计1 支,计时器1 个。
1.2 动物分组与实验方法 取上述ICR 小鼠50只, 按照随机数字编号分为3 组, 即空白对照组(BLANK,n=10)、 生理盐水组(NS,n =20)、参附注射液组(SF,n =20)。 BLANK 组不做处理;SF 组给予参附注射液15 ml/kg,腹腔注射,每日1 次,连续给药3 d,第3 天于水浴浸泡前30 min 给药;NS 组小鼠同样方法给予相同剂量的生理盐水。 水浴浸泡前小鼠禁食12 h,自由饮水,室温为(24 ±1) ℃,将2 组小鼠分别放入自制悬吊式小鼠水浴固定器中,上端由铁丝固定悬挂,直立放置,鼠笼高10 cm,直径2.5 cm,浸泡在15 ℃的水中,水位达锁骨水平,头露在水面以上。 水浴浸泡6 h 后取出小鼠,擦干身体放于鼠笼中被动复温,待肛温达到水浴前肛温水平时视为复温成功。 实验过程中,NS 组和SF 组存活的小鼠,均随机分为2 组,分别于被动复温(水浴后取出约6 h)后6 h 和12 h 麻醉,眼眶取血而后处死。
1.3 观测指标 实验过程中,密切观察实验小鼠的生命体征,记录各组小鼠的死亡时间,计算各组的生存率,绘制小鼠生存曲线;水浴前后分别测量各组小鼠的肛温,如果实验过程中小鼠死亡,则立即取出并测量肛温;实验结束后,分别于复温后6 h 和12 h 用1%戊巴比妥钠腹腔注射麻醉各组存活小鼠,眼眶取血,3 000 r/min 离心10 min,离心半径10 cm,分离血清检测丙氨酸转氨酶(ALT)、天门冬氨酸转氨酶(AST)、乳酸脱氢酶(LDH)水平;取血后解剖小鼠,取肺脏组织用生理盐水洗净,置于10%福尔马林溶液中固定,脱水,石蜡包埋,制片,HE 染色后,在光学显微镜下观察各组小鼠肺组织的病理变化。 肺损伤评分:按照Smith 评分体系[10],依据肺水肿、肺泡及间质炎症细胞浸润、肺泡及间质出血、肺不张和透明膜的形成等5 项指标分别进行肺损伤严重程度评分。 肺血管、肺泡、间质及支气管均正常,为0 分;病变范围小于整个视野面积的25%为1 分;病变范围为整个视野面积的25% ~50%为2 分;病变范围为整个视野面积的50% ~75%为3 分;病变范围大于整个视野面积的75%为4 分;总的肺部损伤评分为上述各项之和。
1.4 统计学处理 采用SPSS 21.0 统计软件对数据进行分析,计量资料采用均值±标准差()表示, 多组间比较采用单因素方差分析(ANOVA),组间两两比较采用LSD-t 检验。 P <0.05 表示差异有统计学意义。
2 结果
2.1 小鼠的生存率 NS 组和SF 组小鼠水浴过程中均出现动物死亡。 NS 组小鼠发生死亡时间较SF组早,15 ℃水浴浸泡6 h 后,NS 组和SF 组的生存率分别是50%和75%(P <0.05),说明参附注射液明显提高低温水浴小鼠的生存率。 见图1。
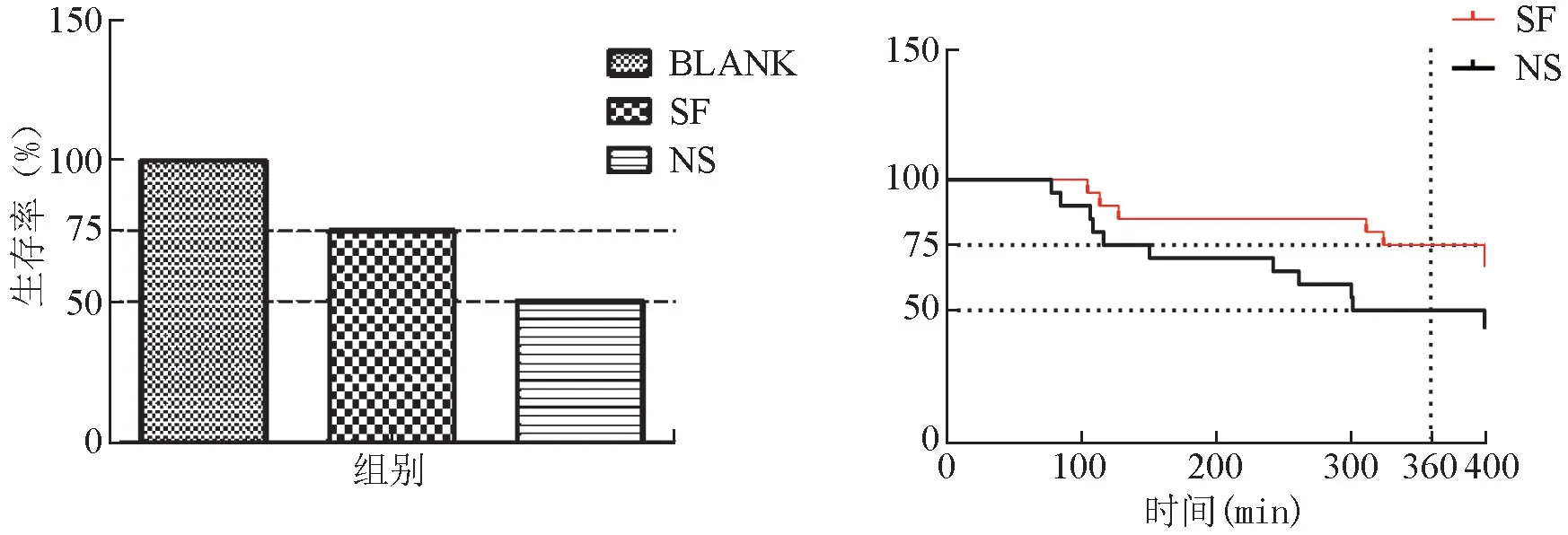
注:BLANK 为空白对照组,NS 为生理盐水组,SF 为参附注射液组
2.2 小鼠水浴前后肛温的比较 NS 组和SF 组小鼠水浴后肛温与水浴前比较,均明显降低(P <0.05)。 水浴后SF 组肛温高于NS 组(P <0.05),说明与NS 组相比,参附注射液能够改善水浴浸泡对小鼠肛温的降低程度。 见表1。
表1 水浴前后各组小鼠肛温的变化比较

表1 水浴前后各组小鼠肛温的变化比较
注:与BLANK 组比aP <0. 05;与NS 组同期相比bP <0. 05。BLANK 为空白对照组,NS 为生理盐水组,SF 为参附注射液组
组别 鼠数 体温(℃)BLANK 组 10 38.64 ±0.46 NS 组水浴前 20 38.68 ±0.50 SF 组水浴前 20 38.74 ±0.49 NS 组水浴后 20 18.89 ±1.32a SF 组水浴后 20 19.87 ±0.80ab
2.3 小鼠血液生化指标的变化 复温6 h 后,NS 组和SF 组血清ALT 水平均明显高于空白对照组(P <0.05)。复温后12 h,2 组血清ALT 水平均下降,与BLANK 组比较,NS 组高于BLANK 组(P <0.05),SF 组略高于BLANK 组(P >0.05);与NS 组比较,SF 组ALT 水平降低更明显(P <0.05),说明SF 组小鼠血液ALT 水平恢复更快。 复温后6 h 和12 h,NS 组和SF 组小鼠血液AST 水平均高于BLANK 组(P <0.05);SF 组AST 水平在复温后6 h和12 h 均低于NS 组(P <0.05);复温后12 h,SF 组AST 水平略高于BLANK 组(P >0.05)。 说明SF 组AST 水平恢复更快。 复温后6 h 和12 h,NS 组和SF组血液LDH 水平均显著高于BLANK 组(P <0.05),SF 组血液LDH 水平均低于NS 组(P <0.05),说明SF 组血液LDH 水平恢复情况较NS 组快。 综上,在复温后6 h 和12 h,小鼠血液生化指标ALT、AST、LDH的恢复情况,SF 组均优于NS 组。 见表2。
2.4 肺组织病理变化及病理评分 BLANK 组小鼠肺组织支气管上皮结构完整,上皮细胞形态结构正常、排列紧密。 水浴浸泡后小鼠肺脏组织均可见肺泡壁增厚,并有淋巴细胞与中性粒细胞浸润,局部血管周围可见水肿,静脉与毛细血管淤血扩张,局部可见出血,肺泡结构破坏。 与NS 组相比,SF 组小鼠肺泡出血、水肿较轻,炎性细胞浸润较少,肺泡结构较少破坏。 复温后12 h,2 组小鼠肺泡组织炎性细胞浸润和出血均减少,肺组织损伤逐渐恢复,其中SF组基本恢复至正常状态,而NS 组尚未恢复正常。 见图2。 与BLANK 组相比,NS 组和SF 组肺组织病理评分均明显增加(P <0.05)。 复温后6 h 和12 h,SF组小鼠肺病理评分均显著低于相应时间点NS 组(P <0.05)。 说明参附注射液较生理盐水能够显著改善低水浴浸泡引起的小鼠肺组织损伤情况。 见表3。
表2 各组小鼠血液生化指标的的变化
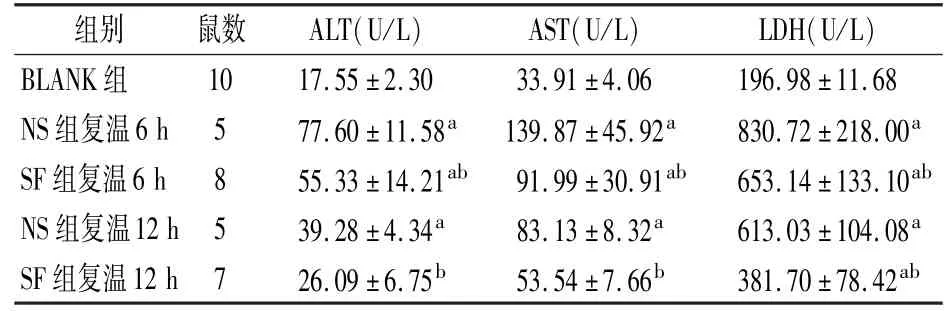
表2 各组小鼠血液生化指标的的变化
注:与BLANK 组比aP <0.05;与NS 组同期相比bP <0.05。 BLANK 为空白对照组,NS为生理盐水组,SF 为参附注射液组;ALT 为丙氨酸转氨酶,AST 为天门冬氨酸转氨酶,LDH为乳酸脱氢酶
组别 鼠数 ALT(U/L) AST(U/L) LDH(U/L)BLANK 组 10 17.55±2.30 33.91±4.06 196.98±11.68 NS 组复温6 h 5 77.60±11.58a 139.87±45.92a 830.72±218.00a SF 组复温6 h 8 55.33±14.21ab 91.99±30.91ab 653.14±133.10ab NS 组复温12 h 5 39.28±4.34a 83.13±8.32a 613.03±104.08a SF 组复温12 h 7 26.09±6.75b 53.54±7.66b 381.70±78.42ab
表3 水浴前后各组小鼠肺病理评分比较(分

表3 水浴前后各组小鼠肺病理评分比较(分
注:与BLANK 组比aP <0. 05;与NS 组同期相比bP <0.05。BLANK 为空白对照组,NS 为生理盐水组,SF 为参附注射液组
组别 鼠数 肺病理评分BLANK 组 10 2.40 ±0.70 NS 组复温6 h 5 14.40 ±1.4a SF 组复温6 h 8 11.38 ±1.06ab NS 组复温12 h 5 10.00 ±0.70a SF 组复温12 h 7 7.14 ±0.69ab
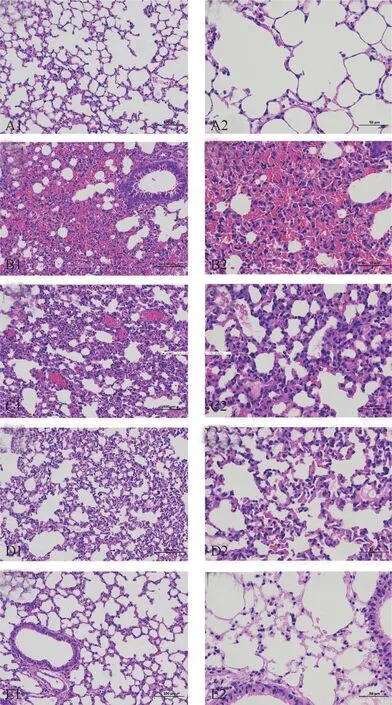
图2 各组小鼠肺脏组织病理形态学(A1 ~E1:HE 染色×200;A2 ~E2:HE 染色 ×400)
3 讨论
回阳救逆是运用具有温热作用的药物,针对阴寒内盛危重症的治法,属于中医温法之一,适用于阳气极度衰疲,寒邪深入少阴的危重证候。 参附注射液源于古方参附汤,方中人参甘温大补元气;附子大辛大热,温壮元阳。 二药相配,共奏回阳周脱之功。《删补名医方论》云:“补后天之气,无如人参;补先天之气,无如附子,此参附汤之所由立也……二药相须,用之得当,则能瞬息化气于乌有之乡,顷刻生阳于命门之内,方之最神捷者也”。 现代临床上,其主要用于治疗急性心力衰竭、心源性猝死以及休克等疾病。
ALT 和AST 是一组催化氨基转移反应的酶类,被用于肝脏疾病检查。 ALT 广泛存在于机体组织细胞内,但以肝脏细胞含量最多;在肝细胞中ALT 则主要存在于肝细胞质中,少量存在于线粒体内[11]。LDH 是一种糖酵解酶,广泛存在于人体组织内,以心肌、骨骼肌和肾脏含量最丰富,其次为肝、脾、肺和肿瘤组织,红细胞内含量极丰富。 当心肌及肺组织等损伤时,LDH 可释放入血,使血中LDH 活性升高。低温水浴环境中,小鼠周身血管收缩从而使全身有效血循环量减少,各脏器或多或少出现缺血损伤情况,尤其是肝脏组织和肺组织更明显,有研究表明体温过低动物被动复温过程中可能通过激活氧化应激和炎症反应增加肺脏损伤[12]。
本研究参附注射液为临床上常规用量,为更能体现药物作用,提前3 d 用药。 生存率及生存曲线结果显示,参附注射液能够显著提高低温水浴浸泡小鼠的生存率,可能与参附注射液发挥回阳救逆的作用有关,可提升小鼠对低温的耐受,从而使其存活。 水浴后肛温的变化结果说明参附注射液能够保护低温水浴浸泡小鼠的基础体温,可能与增加机体自身产热有关,具体机制有待进一步研究。 ALT、AST、LDH 等指标显示,参附注射液能够显著提升小鼠生化指标的恢复速度。 有研究表明,参附注射液能够减少LDH 的释放,发挥心脏保护作用[13]。 可能是在低温状态下,参附注射液发挥了对肝功能缺血性损伤的保护作用有关[14]。 肺脏病理组织形态学及病理评分结果说明,低温水浴浸泡后的小鼠,无论是肺组织的损伤程度,还是肺组织损伤后的恢复状态,SF 组均明显比NS 组有优势,可能是参附注射液通过自身温阳益气的作用提高机体免疫力,拮抗了低温浸泡时的阴寒凝滞,从而减轻肺组织损伤。有研究表明,参附方可以降低亚低温治疗颅脑损伤大鼠时并发肺水肿的发生率和严重程度[15]。 临床研究发现,参附注射液能够明显改善慢性心力衰竭患者肺水肿的临床疗效[16]。
综上所述,参附注射液源于古方,在现代领域多个疾病中广泛应用。 本课题探究参附注射液对低温水浴浸泡小鼠影响,结果显示其能够显著提高低温水浴浸泡小鼠的生存率,改善小鼠血液生化指标情况,减轻小鼠肺组织损伤程度。 进一步对其具体作用机制的研究,将有助于推进其在低体温症领域的临床应用,从而更好地提高我国海军重要作战能力。

