miR-135b-3p调控XAF1表达影响甲状腺癌细胞的迁移、侵袭和放射增敏性
曹邓晗,陈奎生
(1.郑州市第一人民医院 内分泌科, 河南 郑州 450004; 2.郑州大学第一附属医院 病理科, 河南 郑州 450052)
甲状腺癌(thyroid cancer)是常见的内分泌系统肿瘤,具有较高的发病率、病死率以及较差的预后[1]。甲状腺癌的治疗以手术为主,术后放疗对于分化差、不能手术以及术后残余癌细胞具有一定的作用[2]。放疗抵抗是肿瘤放疗失败的主要原因[3],增强肿瘤细胞的放射敏感性可提高放疗疗效。探索甲状腺癌细胞的生物学特性及其放疗敏感性对于甲状腺癌的治疗具有重要的意义。微小RNA(micro RNA,miRNA)是一类内源性的小分子非编码RNA,由18~25个核苷酸构成。miRNA在真核生物体内广泛存在,具有多种生物学功能[4],其参与肿瘤的发生和发展过程,可用作肿瘤诊断的生物学标志物和治疗靶点[5]。研究显示,miR-135b-3p在乳腺癌、肺癌等肿瘤中异常表达,参与肿瘤细胞的增殖、凋亡等恶性生物学行为[6-7]。但miR-135b-3p对甲状腺癌细胞迁移和侵袭以及放射敏感性的影响还未见报道。本研究主要探讨了miR-135b-3p对甲状腺癌细胞迁移和侵袭以及放射敏感性的影响,以及可能的调控机制,以期为甲状腺癌的治疗提供新的作用靶点。
1 材料与方法
1.1 细胞和主要试剂
正常甲状腺细胞系Nthy-ori 3-1、甲状腺癌细胞系K1和TPC-1(上海慧颖生物科技有限公司); 胎牛血清(FBS,浙江天杭生物科技股份有限公司);DMEM培养基(北京索莱宝有限公司);LipofectamineTM2000试剂盒(上海瓦兰生物科技有限公司);双荧光素酶报告基因检测试剂盒(Promega公司);miR-135b-3p抑制剂、miR-135b-3p mimics等转染相关试剂(Lifetechonology公司,设计并合成);Trizol试剂(Invitrogen公司);反转录试剂盒(Santa Cruz公司);实时定量PCR试剂盒SYBRGreen real-time PCR master mix plus QPK212(TOYOBO公司);引物序列(上海生工生物技术有限公司设计并合成);RIPA试剂和BCA蛋白测定试剂盒(上海碧云天生物技术有限公司);E-cadherin和MMP-2抗体(Cell Sigaling Technology公司);X染色体连锁凋亡抑制蛋白相关因子1(XAF1)和GAPDH抗体(Abcam公司);辣根过氧化酶标记的二抗(武汉博士德生物工程有限公司)。
1.2 方法
1.2.1 细胞的培养及分组处理:复苏正常甲状腺细胞Nthy-ori 3-1、甲状腺癌细胞K1和TPC-1,加入含10 %FBS的DMEM培养基,置于常规培养基中培养。每2~3 d换液1次。待细胞汇合至80%~90%时,胰蛋白酶消化,进行传代或后续实验。取对数增殖期的TPC-1细胞接种于6孔板中,以不含FBS的DMEM培养基孵育后,参照lipofectamineTM2000试剂盒操作说明书,分别转染miR-135b-3p抑制剂(anti-miR-135b-3p组)及抑制剂阴性对照(anti-miR-NC组)、miR-135b-3p mimics(miR-135b-3p组)及模拟阴性对照组(miR-NC组)、共转染miR-135b-3p抑制剂与XAF1的小干扰RNA(anti-miR-135b-3p+si-XAF1组)、共转染miR-135b-3p抑制剂与乱序无意义阴性序列(anti-miR-135b-3p+si-NC组)、共转染XAF1野生型(WT-XAF1)质粒与miR-135b-3p mimics(miR-135b-3p+WT-XAF1组)、WT-XAF1质粒与模拟阴性对照(miR-NC+WT-XAF1组)、XAF1突变型(MUT-XAF1)质粒与miR-135b-3p mimics(miR-135b-3p+MUT-XAF1组)及MUT-XAF1与模拟阴性对照(miR-NC+MUT-XAF1组)至TPC-1细胞。转染后培养6 h,更换含10% FBS的DMEM培养基继续培养至48 h,收集各组细胞用于后续实验。
1.2.2 RT-qPCR检测miR-135b-3p和XAF1 mRNA表达:参照Trizol试剂操作说明提取细胞中总RNA,然后将RNA反转录为cDNA。使用PCR试剂盒进行扩增。PCR扩增条件为95 ℃预变性5 min,95 ℃变性10 s,60 ℃退火30 s,共进行45个循环。miR-135b-3p以U6为内参,XAF1以GAPDH为内参,采用2-△△Ct法计算miR-135b-3p和XAF1 mRNA相对表达水平。
1.2.3 Western blot检测相关蛋白表达:RIPA试剂提取各组细胞中总蛋白,参照BCA蛋白试剂盒操作说明测定蛋白浓度后进行SDS-PAGE电泳。电泳后,转移至PVDF膜,使用5%脱脂牛奶在室温环境中封闭1 h。TBST洗膜后,加入一抗,4 ℃孵育12 h。TBST洗膜,加入辣根过氧化酶标记的二抗,室温孵育1 h。TBST洗膜后加入ECL化学发光试剂,避光条件下显影,凝胶成像系统曝光拍照。利用Image Pro Plus 6.0分析蛋白条带的吸光度值。以GAPDH为内参,目的蛋白与GAPDH蛋白条带吸光度值的比值表示目的蛋白的相对表达水平。
1.2.4 双荧光素酶实验验证miR-135b-3p与XAF1靶向关系:参照双荧光素酶报告基因检测试剂盒说明书,检测细胞荧光素酶活性。各组细胞的荧光强度用萤火虫荧光素酶活性与海肾荧光素酶活性的比值表示。
1.2.5 Transwell检测细胞迁移和侵袭,细胞迁移:使用不含FBS的DMEM培养基将转染后的各组TPC-1细胞重悬,以5×104个/孔直接加入至Transwell小室的上室,下室加入500 μL含10% FBS的DMEM培养基,置于培养箱中孵育24 h。取出上室,加入4%多聚聚甲醛固定15 min,然后加入0.2%的结晶紫染色15 min。使用棉签擦去上室边缘细胞,使用PBS清洗3次至PBS无色。置于显微镜下观察,随机选取5个视野对迁移细胞进行计数。细胞侵袭:使用不含FBS的DMEM培养基将液态基质胶原液稀释8倍,取50 μL加入到Transwell小室的上室,37 ℃凝固30 min。然后将TPC-1细胞悬液加入至铺有基质胶的上室中,其他操作步骤与细胞迁移实验相同。
1.2.6 克隆形成实验检测细胞放射敏感性:将转染后的TPC-1细胞接种于6孔板中,分别采用0、2、4、6和8 Gy的6MV X线照射细胞,继续培养10~14 d,待细胞出现集落后终止培养。甲醛固定10 min,0.05%结晶紫染色30 min,倒置显微镜观察,计算超过50个细胞集落的克隆。依据单击多靶模型存活分数(survival fraction,SF)=1-(1-e-D/D0) N,得出K和N值,计算2Gy照射后的存活分数SF2、平均致死剂量D0以及准域剂量Dq,并计算放射增敏比(sensitization enhancement ratio,SER)。
1.3 统计学分析
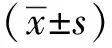
2 结果
2.1 Nthy-ori 3-1、K1和TPC-1细胞中miR-135b-3p和XAF1表达
与Nthy-ori 3-1细胞比较,K1和TPC-1细胞中miR-135b-3p表达水平显著升高(P<0.05),XAF1蛋白表达水平显著降低(P<0.05)(图1,表1)。
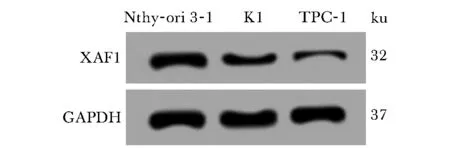
图1 Nthy-ori 3-1、K1和TPC-1细胞中XAF1蛋白的表达Fig 1 Expression of XAF1 protein in Nthy-ori 3-1,K1 and TPC-1 cells
表1 miR-135b-3p、XAF1在Nthy-ori 3-1、K1和TPC-1细胞中的表达
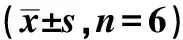

groupmiR-135b-3pXAF1 proteinNthy-ori 3-10.24±0.020.57±0.05K10.46±0.04∗0.35±0.03∗TPC-10.73±0.07∗0.18±0.02∗
*P<0.05 compared with Nthy-ori 3-1 group.
2.2 抑制miR-135b-3p表达对甲状腺癌细胞TPC-1迁移、侵袭的影响
与anti-miR-NC组比,anti-miR-135b-3p组TPC-1细胞中miR-135b-3p表达水平降低(P<0.05)、细胞迁移和侵袭数明显减少(P<0.05)、 E-cadherin蛋白表达显著升高(P<0.05),MMP-2蛋白表达显著降低(P<0.05)(图2,表2)。
2.3 抑制miR-135b-3p表达对甲状腺癌细胞TPC-1放射敏感性的影响
随着放疗剂量的增加,anti-miR-NC组、anti-miR-135-3p组TPC-1细胞的存活分数均降低;同一放疗剂量下,anti-miR-135-3p组TPC-1细胞的存活分数显著低于anti-miR-NC组(P<0.05)(图3)。与anti-miR-NC组比,anti-miR-135-3p组SER为1.718(表3)。
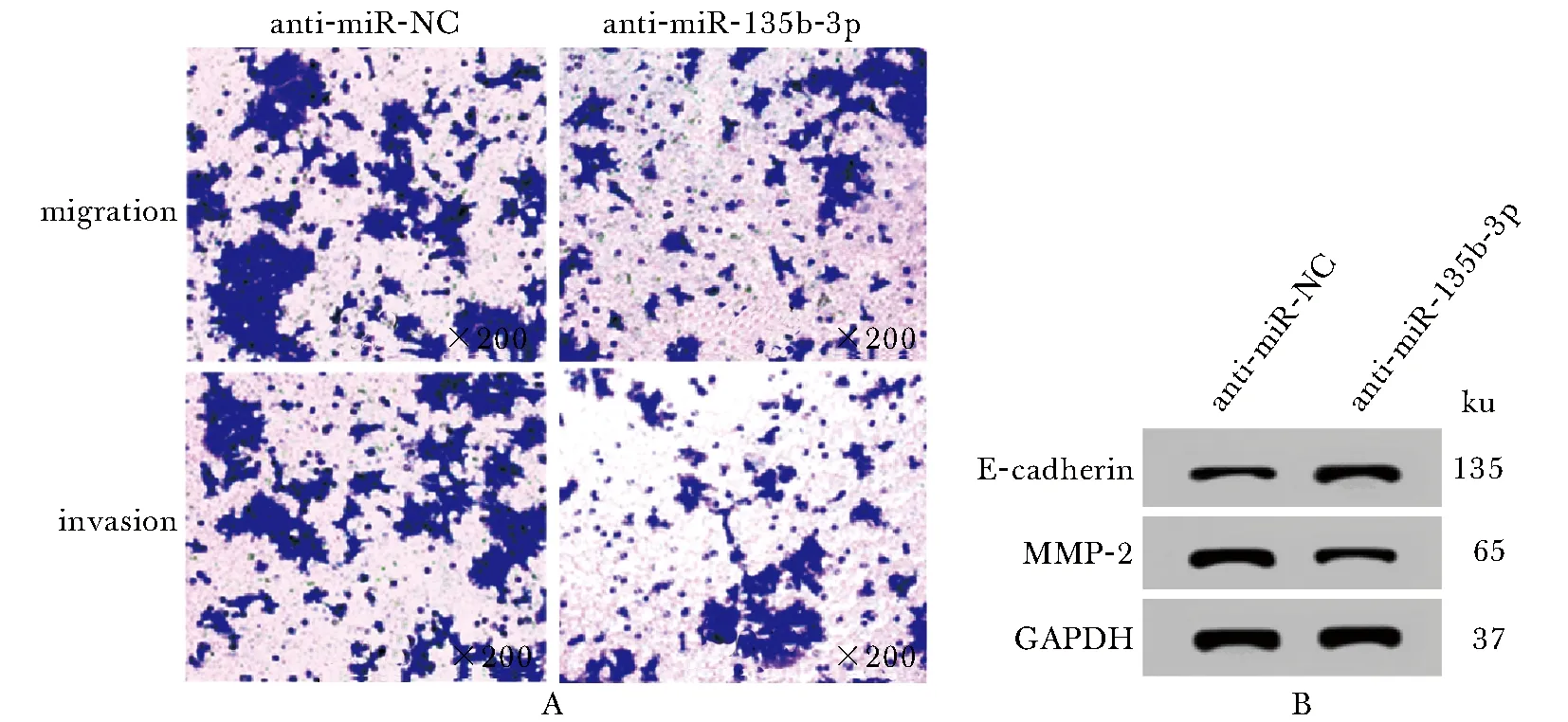
A.observation of migration and invasion of TPC-1 cells; B.E-cadherin and MMP-2 proteins expression bands图2 抑制miR-135b-3p表达对TPC-1细胞迁移、侵袭的影响Fig 2 Effects of inhibiting the expression of miR-135b-3p on the migration and invasion of TPC-1 cells

表2 抑制miR-135b-3p表达对TPC-1细胞迁移和侵袭的影响Table 2 Effects of inhibiting the expression of miR-135b-3p on the migration and invasion of TPC-1
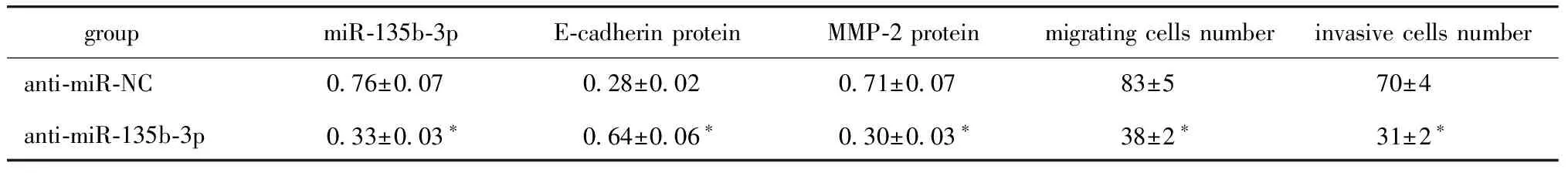
groupmiR-135b-3pE-cadherin protein MMP-2 protein migrating cells numberinvasive cells numberanti-miR-NC0.76±0.070.28±0.020.71±0.0783±570±4anti-miR-135b-3p0.33±0.03∗0.64±0.06∗0.30±0.03∗38±2∗31±2∗
*P<0.05 compared with anti-miR-NC group.
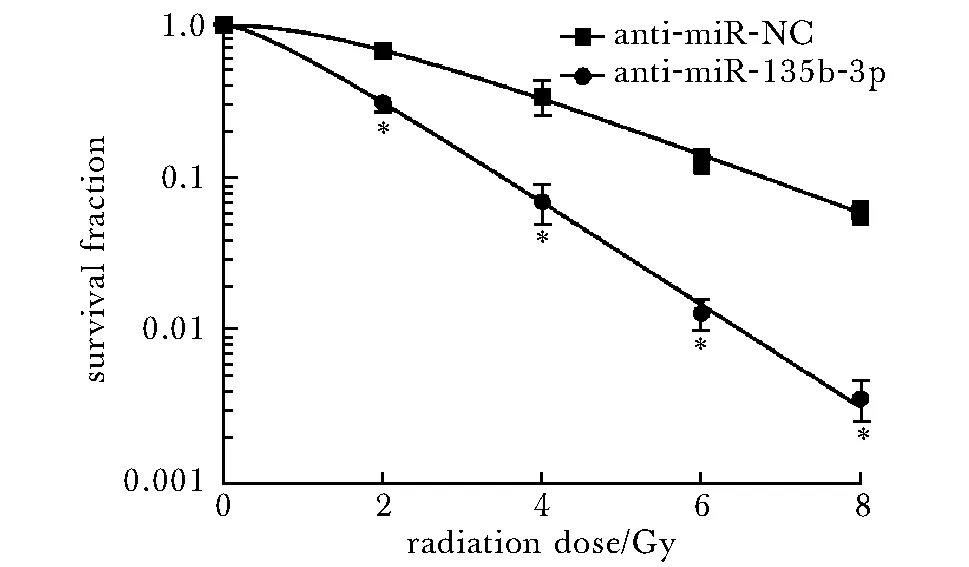
*P<0.05 compared with anti-miR-NC group图3 抑制miR-135b-3p表达对TPC-1细胞放射敏感性的影响Fig 3 Effects of inhibiting the expression of miR-135b-3p on radiosensitivity of TPC-1
2.4 miR-135b-3p靶向调控XAF1的表达
miRNA靶基因生物预测软件发现,XAF1的3′UTR含有miR-135b-3p的互补序列(图4A)。miR-135b-3p可抑制WT-XAF1荧光素酶活性(P<0.05)(表4)。miR-135b-3p组TPC-1细胞中XAF1 mRNA和蛋白表达水平显著低于miR-NC组(P<0.05),anti-miR-135b-3p组TPC-1细胞中XAF1 mRNA和蛋白表达水平显著高于anti-miR-NC组(P<0.05)(图4B,表5)。
2.5 抑制XAF1表达降低miR-135b对甲状腺癌细胞TPC-1迁移、侵袭及放射敏感性的影响
与anti-miR-135b-3p+si-NC组比,anti-miR-135b-3p+si-XAF1组TPC-1细胞迁移和侵袭数明显增多(P<0.05),TPC-1细胞中XAF1和E-cadherin蛋白表达显著降低(P<0.05),MMP-2蛋白表达显著升高(P<0.05)(图5A,表6)。随着放疗剂量的增加,anti-miR-135b-3p+si-NC组、anti-miR-135b-3p+si-XAF组TPC-1细胞的存活分数均降低;同一放疗剂量下,anti-miR-135b-3p+si-XAF组TPC-1细胞的存活分数显著低于anti-miR-135b-3p+si-NC组(图5B)。与anti-miR-135b-3p+si-NC组比,anti-miR-135b-3p+si-XAF组SER为0.712(表7)。

表3 抑制miR-135b-3p表达对TPC-1细胞单击多靶模型参数的影响
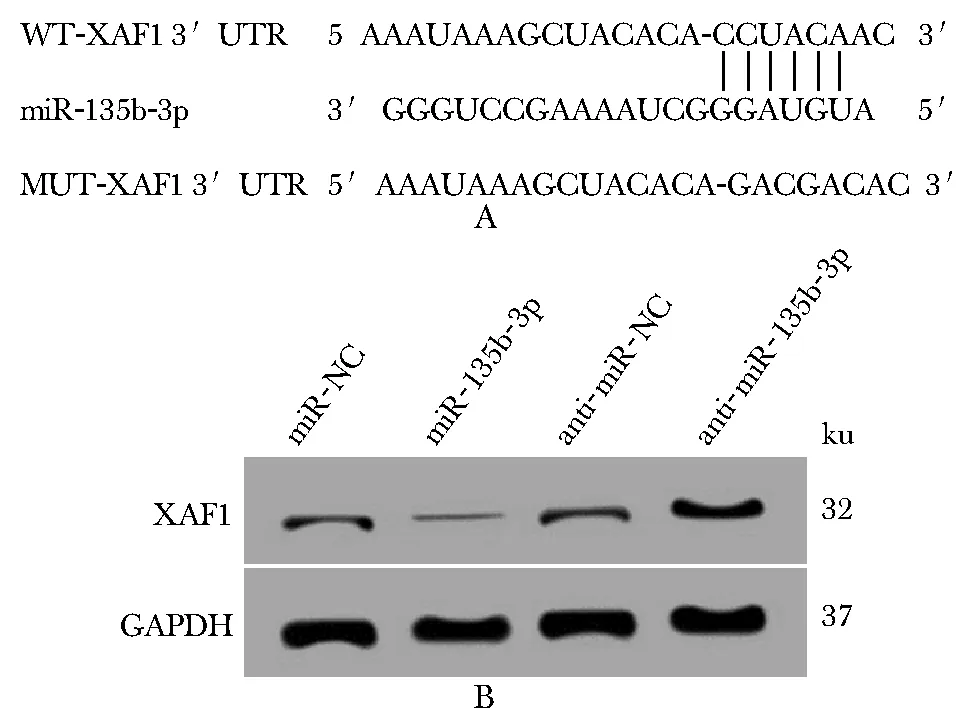
A.the 3′UTR of XAF1 contained complementary sequences of miR-135b-3p;B.regulation of XAF1 expression by miR-135b-3p图4 miR-135b-3p靶向调控XAF1的表达Fig 4 miR-135b-3p targeted and regulated XAF1 expression
表4 双荧光素酶报告实验
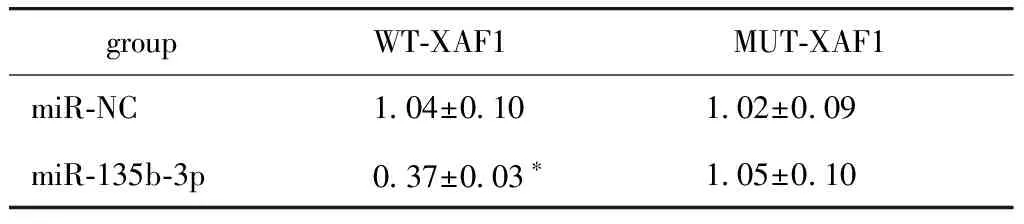
groupWT-XAF1MUT-XAF1miR-NC 1.04±0.10 1.02±0.09miR-135b-3p 0.37±0.03∗ 1.05±0.10
*P<0.05 compared with miR-NC group.
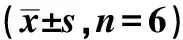
表5 miR-135b-3p调控XAF1的表达
*P<0.05 compared with miR-NC group;#P<0.05 compared with anti-miR-NC group.
3 讨论
miRNA可通过与靶mRNA基因的3′或5′端UTR区结合,抑制mRNA翻译或裂解mRNA,在转录后水平调控基因的表达。miRNA的异常表达与肿瘤的发生发展密切相关[8]。探讨肿瘤中异常表达的miRNA以及miRNA对肿瘤细胞生物学特性的影响,可为肿瘤的诊治提供新靶点。本研究结果显示,甲状腺癌细胞中miR-135b-3p表达显著上调,提示miR-135b-3p参与甲状腺癌的发生和发展。肿瘤细胞的迁移和侵袭与肿瘤的发生发展密不可分。本研究结果显示,抑制miR-135b-3p表达能够抑制甲状腺癌细胞的迁移和侵袭能力,这可能与促进癌细胞E-cadherin蛋白表达、抑制MMP-2蛋白表达有关。肿瘤放射治疗是肿瘤治疗的重要手段之一。但是,肿瘤微环境的改变会使肿瘤细胞产生放疗抵抗性,导致肿瘤治疗失败[9]。提高肿瘤细胞的放射敏感性可有效杀死肿瘤细胞,提高治疗效果。本研究结果显示,抑制miR-135b-3p表达可增强甲状腺癌细胞的放射敏感性。这提示miR-135b-3p作为促癌基因参与甲状腺癌的恶性生物学行为,是甲状腺癌治疗的潜在靶点。
为了进一步探讨miR-135b-3p影响甲状腺癌细胞迁移和侵袭以及放射敏感性的调控机制,采用miRNA靶基因预测了XAF1可能是miR-135b-3p的靶基因。XAF1是一种新型的凋亡抑制蛋白的结合配偶体,在非小细胞肺癌、结直肠癌、乳腺癌等多种肿瘤中表达下调或缺失[10-12],其过表达可抑制肿瘤细胞的增殖并诱导细胞凋亡。XAF1在甲状腺乳头癌中表达下调,并与患者肿瘤TNM分期、病理分级和淋巴结转移密切相关[13]。目前,XAF1对甲状腺癌细胞迁移、侵袭及放射敏感性的影响还未知。本研究通过双荧光素酶实验证实了miR-135b-3p在甲状腺癌细胞中靶向负调控XAF1表达;抑制XAF1表达部分逆转了抑制miR-135b-3p表达对甲状腺癌细胞迁移、侵袭及放射敏感性的影响,提示miR-135b-3p通过上调XAF1表达抑制甲状腺癌细胞的迁移和侵袭,并增强其对放射线的敏感性。
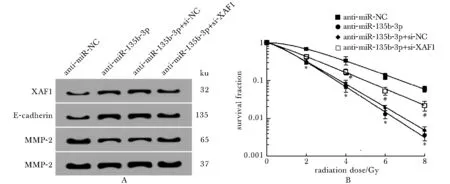
A.bands of XAF1 E-cadherin and MMP-2 proteins expression; B.TPC-1 cells survival curve;*P<0.05 compared with anti-miR-NC group;#P<0.05 compared with anti-miR-135b-3p+si-NC group
图5 抑制XAF1表达降低抑制miR-135b-3p对甲状腺癌细胞TPC-1迁移、侵袭及放射敏感性的影响
Fig 5 Inhibition of XAF1 expression reduced the effects of inhibition of microRNA-135b-3p on TPC-1 migration, invasion and radiosensitivity in thyroid cancer cells

表6 抑制XAF1表达降低miR-135b-3p对甲状腺癌细胞TPC-1迁移和侵袭的抑制作用
*P<0.05 compared with anti-miR-NC group;#P<0.05 compared with anti-miR-135b-3p+si-NC group.
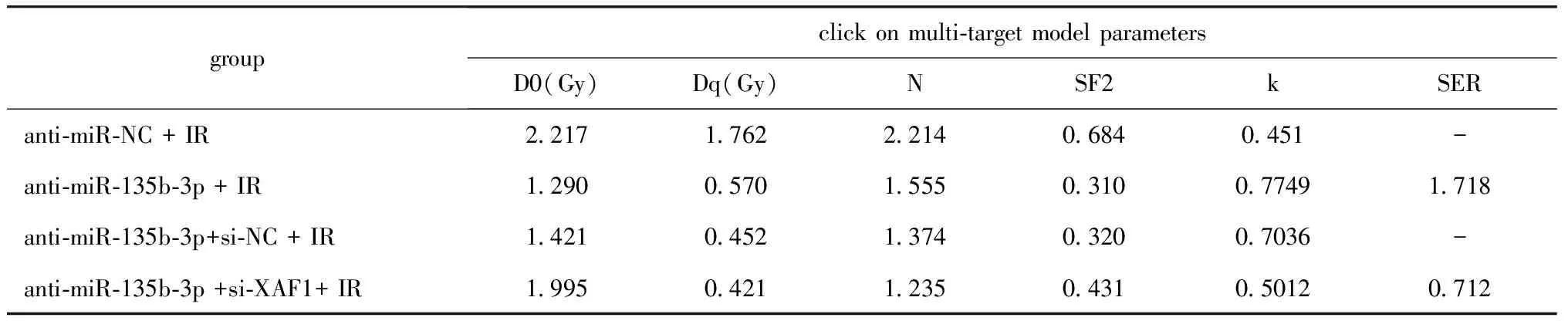
表7 抑制XAF1表达降低抑制miR-135b-3p对TPC-1细胞放射敏感性的作用
综上所述,miR-135b-3p在甲状腺癌细胞中高表达,抑制其表达可能通过上调XAF1抑制甲状腺癌细胞的迁移和侵袭能力,并增强癌细胞的放射敏感性,是甲状腺癌潜在治疗靶点。

