miR-107抑制胶质瘤细胞的体外增殖、迁移和侵袭
孙茂苍,李 鑫
(聊城市第四人民医院 神经内科, 山东 聊城 252000)
恶性胶质瘤是儿童和成人最常见、最具侵袭性的脑肿瘤,预后较差,5年生存率为10%[1]。获得最佳的治疗方案仍然是最大的挑战。针对脑肿瘤分子特征的新的基因表达谱研究已经显示其遗传和表观遗传的改变。microRNA (miRNA)为18~25 个核苷酸组成的短链非编码内源性微小的RNA分子,据报道,其参与神经胶质瘤发生、肿瘤细胞、增殖、凋亡以及抗癌基因转录后调控的基因的功能[2],miR-107为其中之一[3]。叉头盒(forkhead box, FOX)基因家族是一组高度保守的转录因子。 越来越多的证据表明,FOX蛋白在肿瘤发生、胚胎发育、器官发生和多种生物过程的调节中起着关键作用。如细胞增殖,代谢,免疫反应等[4]。 叉头盒k1(forkhead box k1, FOXK1)是FOX家族的成员[5],其在人类多种癌症中失调,但在胶质瘤中的作用及与miR-107之间的关系尚未清楚。本研究拟以胶质瘤细胞系细胞为研究对象,检测其中miR-107和FOXK1的表达,观察过表达miR-107、敲减FOXK1及过表达FOXK1对胶质瘤细胞增殖、迁移和侵袭的影响,以揭示其与miR-107靶向FOXK1关系,为胶质瘤的治疗提供理论依据。
1 材料与方法
1.1 材料
人正常的星形胶质细胞系NHA、神经胶质瘤细胞系 U87、A172及U251(ATCC)DMEM培养基、胎牛血清、CCK-8试剂及胰蛋白酶(Sellect公司);RNA抽提试剂盒及反转录试剂盒(TaKaRa公司);PVDF膜(Roche公司); RIPA蛋白裂解液(上海碧云天生物技术公司);Matrigel基质胶及Transwell小室(Corning公司);双荧光素酶报告基因检测试剂盒(Promega公司)。
1.2 方法
1.2.1 细胞的培养:用含有10 %胎牛血清的DMEM培养基置于37 ℃,5% CO2的恒温培养箱中常规培养人正常的星形胶质细胞NHA、神经胶质瘤细胞 U87、A172、U251,待细胞增殖至汇合度75 %左右,用胰蛋白酶消化约1 min,按照1∶3的比例更换培养基,每2 d传代。
1.2.2 细胞的转染与分组:将miR-NC、miR-107 mimics、si-NC、si-FOXK1、miR-107+pcDNA3.1,miR-107+pcDNA3.1-FOXK1按照脂质体lipofectamineTM2000试剂说明书要求,转染至U87细胞,转染6 h后,更换新鲜培养基培养48 h,分别标记为miR-NC组、miR-107 组、si-NC组、si-FOXK1组、miR-107+pcDNA3.1组,miR-107 +pcDNA3.1-FOXK1组,用RT-qPCR法检测转染效率,转染成功后,用于后续的实验研究。
1.2.3 RT-qPCR检测细胞中miR-107和FOXK1的表达: 取适量对数增殖期1.2.2各组细胞,按miRNA抽提试剂盒说明书要求操作提取RNA,进行定量,然后按反转录试剂盒说明书操作合成cDNA。最后按qRT-PCR试剂盒说明书操作进行miR-107、FOXK1检测。用2-△△Ct计算miR-107、FOXK1的表达。引物信息(5′-3′):miR-107:GCC GAATTCAAAGCGAGATTCCATCAGCA,GCCGGAT CCTGTCAACCCAGAACTCAAAGG;U6:CTCGCTTC GGCAGCACA,AACGCTTCACGAATTTGCGT;FOXK1:ACACGTCTGGAGGAGACAGC,GAGAGGTTGTGCCGGA TAGA;GAPDH:TCCCTCAAGATTGCTAGCAA,AGATCC ACAACGGATACATT。
1.2.4 CCK-8法检测细胞的增殖: 调整各组细胞为105个/mL的细胞悬液,以100 μL/孔接种96孔板,37 ℃,5% CO2培养24 h。每组设3个重复,分别转染24、48、72和96 h加入CCK-8溶液20 μL,450 nm波长测吸光度(A450值)。计算细胞增殖,细胞增殖能力与细胞的A450值之比。
1.2.5 Transwell小室检测细胞的迁移和侵袭: 将 Transwell小室置于孔上,放入细胞培养箱平衡30 min。调整细胞至5×105个/mL的细胞悬液。每个小室加入200 μL细胞悬液,即每孔细胞约为1×105个。将上室放入37 ℃、5% CO2培养箱中培养24 h后,取出上室,用棉签擦去上室膜下表面迁移的细胞,PBS洗2次,甲醇固定30 min。自然晾干后,用1 g/L结晶紫染液染色20 min。弃染液,双蒸水洗2次,再取出后于倒置显微镜下观察拍照(400倍),计数上、下、左、右、中5个不同视野的总细胞数取平均值。
将基质胶和培养基按1∶8稀释后(60 μL)铺于小室上表面,风干后备用,其他步骤同Transwell迁移实验。
1.2.6 Western blot检测细胞中FOXK1的蛋白表达:收集细胞,加入裂解液,冰上裂解30 min。沸水浴10 min进行变性,12 000 r/min离心10 min,取上清置于EP管,加入5×SDS上样缓冲液。电泳后用转膜仪将蛋白转移至PVDF膜;5%脱脂奶粉将膜封闭2 h,洗膜,加入Ⅰ抗,4 ℃过夜孵育,洗膜,加Ⅱ抗,4 ℃ 2 h。加发光液,曝光。
1.2.7 双荧光素酶报告基因检测实验检测miR-107与FOXK1的结合力:将FOXK1 3′UTR-WT(含FOXK1 3′UTR片段)和FOXK1 3′UTR-MUT(含FOXK1 3′UTR片段突变体)的荧光素酶报告载体,用LipofectamineTM2000分别与miR-107、miR-NC共转染,24 h后,按双荧光素酶报告基因检测试剂盒技术手册操作,记录萤火虫荧光素酶和海肾荧光素酶激发值,以两者的比值评价FOXK1基因的激活程度。
1.3 统计学分析
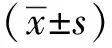
2 结果
2.1 miR-107和FOXK1在胶质瘤细胞中的表达
与NHA组相比,U87、A172和U251组细胞中miR-107的表达显著降低,FOXK1的mRNA和蛋白表达均显著升高(P<0.05)(图1)。
2.2 过表达miR-107对胶质瘤细胞增殖、迁移及侵袭的影响
与miR-NC组相比,miR-107组细胞中miR-107表达显著升高,48和72 h,细胞增殖显著降低,迁移细胞数和侵袭细胞数均显著降低(P<0.05)(图2)。
2.3 miR-107靶向FOXK1
用miRcode数据库预测到miR-107与FOXK1 3′UTR存在结合位点(图3A);与miR-NC组相比,miR-107组WT-FOXK1细胞中荧光活性显著降低,MUT-FOXK1细胞中荧光活性不受影响(图3B);与miR-NC组相比,miR-107组细胞中FOXK1蛋白表达显著降低,与anti-miR-NC组相比,anti-miR-107组细胞中FOXK1蛋白表达显著升高(图3C)(P<0.05)。
2.4 敲减FOXK1对胶质瘤细胞增殖、迁移、侵袭的影响
与si-NC组相比,si-FOXK1组U87细胞中FOXK1蛋白表达显著降低,48或72 h,细胞增殖显著降低,迁移细胞数和侵袭细胞数均显著降低(P<0.05)(图4)。

A.expression of miR-107 in glioma cells; B.expression of FOXK1 mRNA in glioma cells; C.expression of FOXK1 protein in glioma cells;*P<0.05 compared with the NHA group
图1 miR-107、FOXK1在胶质瘤细胞中的表达
Fig 1 Expression of miR-107 and FOXK1 in glioma cells

A.over-expression of miR-107 on the expression of miR-107 in U87 cells; B.over-expression of miR-107 on the proliferation of U87 cells; C.over-expression of miR-107 on the migration and invasion of U87 cells;*P<0.05 compared with the miR-NC group
图2 过表达miR-107对U87细胞增殖、迁移、侵袭的影响
Fig 2 Effect of over-expression of miR-107 on proliferation, migration and invasion of U87 cells

A.miR-107 has a binding site with the 3′UTR of FOXK1; B.effect of miR-107 on the fluorescence activity of FOXK1 cells; C.effect of miR-107 on the expression of FOXK1 protein;*P<0.05 compared with the miR-NC group;#P<0.05 compared with the anti-miR-NC group
图3 miR-107靶向FOXK1
Fig 3 miR-107 targets FOXK1

A.knockdown of FOXK1 on the expression of FOXK1 protein in U87 cells; B.knockdown of the effect of FOXK1 on proliferation of U87 cells; C.effect of knockdown of FOXK1 on migration and invasion of U87 cells;*P<0.05 compared with the si-NC group
图4 敲减FOXK1对胶质瘤细胞增殖、迁移、侵袭的影响
Fig 4 Effect of knockdown of FOXK1 on proliferation, migration and invasion of glioma cells
2.5 过表达FOXK1逆转了miR-107对胶质瘤细胞增殖、迁移、侵袭的抑制作用
与miR-107+pcDNA 3.1组相比,miR-107+pcDNA 3.1-FOXK1组U87细胞FOXK1蛋白表达显著升高,48或72 h,细胞增殖显著升高,迁移细胞数和侵袭细胞数均显著升高(P<0.05)(图5)。
3 讨论
miRNA参与人类多种疾病的发生发展过程,尤其是肿瘤,其通过与靶mRNA的3′非编码区(untranslation region, UTR)结合,调节靶基因的表达,作为肿瘤抑制因子或致癌基因发挥作用[6]。miR-107在多种肿瘤中出现异常表达,据报道,miR-107在胶质瘤细胞的细胞表型中具有重要的调控作用,其发挥作用的机制与调控下游靶标细胞周期蛋白依赖性激酶6(CDK6)[7]、Notch-2[8]、类果蝇sal4(SALL4)[9]和雷帕霉素靶蛋白(mTOR)[10]有关。本研究通过RT-qPCR法检测了胶质瘤细胞中miR-107的表达发现,miR-107的表达在胶质瘤中明显的下调,且过表达miR-107可抑制胶质瘤细胞的增殖、迁移和侵袭,这均与前人的研究结果相一致;进一步研究,通过生物信息学预测、双荧光素酶报告基因检测实验及Western blot实验验证了miR-107可靶向负调控FOXK1表达。
FOXK1是FOX类转录因子之一,在骨肉瘤、肝癌、胃癌、结直肠癌、前列腺癌等多种实体肿瘤中均存在转录失调并发挥重要作用[11]。FOXK1在胶质瘤中的研究甚少。FOXK1通过与基质金属蛋白酶1(MMP1)、基质金属蛋白酶9(MMP-9)和E-钙黏蛋白的启动子结合抑制转录,抑制神经胶质瘤细胞的血管生成[12]。FOXK1通过激活wnt /β-catenin信号通路促进胶质瘤细胞增殖,并且在胶质瘤中被miR-137靶向负调控[13]。本研究检测了胶质瘤细胞中FOXK1的mRNA和蛋白的表达发现,FOXK1在胶质瘤细胞中的表达明显升高,敲减FOXK1可抑制胶质瘤细胞的增殖、迁移和侵袭,这与已有的研究结果相一致;进一步研究发现,过表达FOXK1可逆转miR-107对胶质瘤细胞增殖、迁移和侵袭的抑制作用。不仅miR-107可靶向负调控FOXK1的表达,相反, FOXK1也可负向调控miR-107的表达和作用,揭示了miR-107在胶质瘤中的作用机制与FOXK1之间的紧密关系。

A.over-expression of FOXK1 on the expression of FOXK1 protein in U87 cells; B.over-expression of FOXK1 on the proliferation of U87 cells; C.effect of over-expressing FOXK1 on migration and invasion of U87 cells;*P<0.05 compared with miR-107+pcDNA 3.1 group
图5 过表达FOXK1逆转了miR-107对胶质瘤细胞增殖、迁移、侵袭的抑制作用
Fig 5 Over-expression of FOXK1 reverses the inhibitory effect of miR-107 on proliferation, migration and invasion of glioma cells
综上所述,miR-107可抑制体外胶质瘤细胞的增殖、迁移和侵袭,其机制可能与靶向FOXK1有关,为胶质瘤的靶向治疗提供理论依据。

