miR-195抑制剂降低1型糖尿病小鼠肝脏氧化应激损伤
胡苏琴,王圣凯,吴杭菲,郑靖宇,李剑敏
(温州医科大学附属第一医院 病理科, 浙江 温州 325015)
1型糖尿病(type 1 diabetes,T1DM)是一种自身免疫细胞介导的胰腺β细胞破坏的自身免疫性疾病。氧化应激是糖尿病肝病重要的发病机制。过度的氧化应激刺激会导致线粒体发生膜通透性转换现象(mitochondrial permeability transition,MPT),从而导致细胞死亡[1],但其作用的机制尚未明确。沉默miR-195可以减少脓毒症引起的肝脏损伤,抑制miR-195的保护作用与Bcl-2、Sirt1、Pim1的高水平相关[2]。由此是否可以通过抑制miR-195来治疗糖尿病引起的肝脏氧化应激有待进一步证明。Sirt1的激活减轻对乙酰氨基酚(acetaminophen, APAP)诱导的肝毒性增加肝细胞抗氧化活性[3]。Foxo1的去乙酰化依赖于Sirt1的表达[4],并且Foxo1的去乙酰化能增强肝细胞氧化应激耐受[5]。亲环蛋白D(cyclophilin D,CypD)增加可促进线粒体膜通透性转换孔道(mitochondrial permeability transition pore, MPTP)的打开[6],它与Bax、Bcl-2、caspase-3可共同调节凋亡信号的传导。
1 材料与方法
1.1 材料
1.1.1 实验动物:SPF 级C57BL/6小鼠25只,雄性,[温医大实验动物中心,许可证编号SCXK(浙)2010-0044]。
1.1.2 主要试剂:STZ 链脲佐菌素(Sigma-Aldrich公司);柠檬酸粉末(无锡市民丰试剂厂);柠檬酸三钠粉末(国药集团化学试剂公司);scrambled shRNA、(北京英格恩生物科技公司);miR-195抑制剂:miScript miRNA inhibitor(QIAGEN公司);RT-qPCR 试剂盒(广州锐博公司);Trizol试剂和PCR的引物合成(Invitrogen 公司);反转录试剂盒(TaKaRa公司);Sirt1、Bax、cypD、AcFoxo1、Foxo1、Bcl-2和caspase-3单克隆抗体(CST公司);ECL显示液(上海碧云天生物公司)。
1.2 方法
1.2.1 小鼠的分组及处理:将小鼠分为:对照组(control 组,n=6)、糖尿病模型组(DM 组,n=10)、糖尿病+抑制剂组(DM+antago 组,n=9)。DM 组与DM+antago 组小鼠按常规方法造模。确定成模后DM+antago 组小鼠按照 2.5 mg/kg 尾静脉注射核酸 miR-195 antagomir,对照组和DM 组小鼠同样按照 2.5 mg/kg 尾静脉注射核酸 scrambled shRNA作为阴性对照。小鼠共饲养8周,每7 d注射一次核酸以保证体内转染效果,每两周禁食12 h,尾静脉采集血液量空腹血糖1次。
1.2.2 标本收集:取新鲜肝组织一部分放入 4%中性甲醛溶液中固定,后续进行石蜡包埋;其余肝组织置入冻存管中。经液氮迅速降温后,转移进-80 ℃低温冰箱中备用。
1.2.3 血糖(blood glucose concerntration,BGC)浓度的测定:按照罗氏血糖仪说明书操作。体质量(body weight,BW)测定:按常规方法测量记录小鼠体质量变化。
1.2.4 RT-qPCR检测mRNA的相对表达量:收获肝组织裂解液,按Trizol试剂说明书方法提取总RNA。结果以GAPDH为内参,根据Ct值用 2-ΔΔCt法计算mRNA的相对表达量。每组随机取3只小鼠肝标本,实验重复 3 次。Sirt1,F:5′-TACCAGAA CAGTTTCATAGAGCCAT-3′;R:5′-CATTACTCTTAG CTGCTTGGTC-3′。Foxo1,F:5′-GGCAGCCAGGCAT CTCATAACAA-3′;R:5′-TTCACTTGGGTCAGGCGGT TCAT-3′。CypD,F:5′-GCCGCUUUCCUGACGAGAA TT-3′;R:5′-UUCUCGUCAGGAAAGCGGCTT-3′。
1.2.5 Western blot检测蛋白表达水平:收获肝组织裂解液,置 4 ℃,12 000 r/min离心,10 min,取上清液。免疫沉淀法提取乙酰化蛋白,用BCA试剂盒测定蛋白含量。定容定量后取样品加热、变性、加样。电泳分离蛋白,转膜,用5% 脱脂牛奶封闭,TBST洗膜,4 ℃下Ⅰ抗孵育过夜,洗膜后用II抗室温孵育1 h,再次洗膜后加化学发光液。用Image-lab成像仪曝光、显影。用Image-lab对条带进行分析,以目的蛋白与内参蛋白条带累积吸光度值(A)比作为反映目的蛋白表达水平的相对指标。I抗浓度:各蛋白指标1∶1 000,内参GAPDH 1∶5 000;Ⅱ抗1∶5 000。每组随机取3只小鼠肝标本,实验重复3次。
1.2.6 MDA含量和T-SOD活力的检测:参照试剂盒说明书具体步骤操作,用硫代巴比妥酸法(TBA)检测肝组织MDA含量,用羟胺法检测肝组织T-SOD活力。每组随机取3只小鼠肝标本,实验重复 3 次。
1.3 统计学分析
2 结果
2.1 小鼠空腹血糖及质量的变化
与对照组相比,DM 组及DM+antago 组自成模后到实验结束小鼠血糖均高16.7 mmol/L(P<0.01);与对照组相比,DM 组及DM+antago 组的质量明显性下降,DM+antago 组质量下降程度较DM 组小(P<0.05)。
2.2 模型小鼠肝脏组织HE形态学改变
对照组镜下肝细胞排列整齐,细胞质均匀,肝索清晰可见,未见明显的细胞水肿;DM 组镜下肝小叶结构非常紊乱,肝细胞明显水肿,细胞质疏松不均匀,肝索-肝窦分界不清;miR-195抑制剂干预后,DM+antago组肝细胞体积较DM 组变小,水肿程度变轻(图1)。
2.3 肝组织中各组 mRNA的表达
与对照组相比,DM组miR-195、CypD、Bax和caspase-3表达量明显升高(P<0.01),Sirt1、Foxo1和 Bcl-2 mRNA表达均显著下降(P<0.01);与DM组相比,DM+antago组的miR-195、CypD、Bax和caspase-3明显降低(P<0.05),DM+antago组的Sirt1、Foxo1和Bcl-2 mRNA表达显著上升(P<0.05)(图2)。

A,D.the central venous zone and the portal zone of the control group respectively; B,E.the central venous zone and the portal zone of the DM group respectively; C,F.were the central venous zone and the portal zone of the DM+antago group respectively
图1 Control 组、DM 组和DM+antago 组的肝组织 HE 染色的镜下改变
Fig 1 Microscopic changes of liver tissue in the control, DM, and DM+antago groups with HE staining(×400)

A.relative expression of miR-195 mRNA in mouse liver tissue of each group;B.relative expression of Sirt1 mRNA in mouse liver tissue of each group; C.relative expression of Foxo1 mRNA in mouse liver tissue of each group; D.relative expression of CypD mRNA in mouse liver tissue of each group; E.relative expression of Bcl-2 mRNA in mouse liver tissue of each group; F.relative expression of Bax mRNA in mouse liver tissue of each group;G.relative expression of caspase-3 mRNA in mouse liver tissue of each group;*P<0.01 compared with control group;#P<0.05 compared with DM group
图2 各组小鼠肝组织中miR-195、Sirt1、Foxo1、CypD、Bcl-2、Bax和caspase-3 mRNA的表达量

2.4 各组小鼠肝脏组织中Sirt1、CypD、Bcl-2、Bax、caspase-3、Foxo1、AcFoxo1蛋白的表达
与对照组相比,DM 组Sirt1、Bcl-2 蛋白表达明显下降(P<0.05),AcFoxo1/Foxo1、CypD、Bax和caspase-3蛋白表达明显升高(P<0.05);与DM 组相比,DM+antago 组Sirt1、Bcl-2 蛋白表达明显升高(P<0.05),AcFoxo1/Foxo1、CypD、Bax和caspase-3 的蛋白表达明显降低(P<0.05)(图3,表1)。

图3 各组小鼠肝组织蛋白表达Fig 3 protein expression in mouse liver tissue in each group
2.5 各组小鼠肝脏组织MDA含量及T-SOD活力的变化
与对照组相比,DM 组肝脏组织中MDA 的含量明显升高(P<0.01),T-SOD活力显著降低(P<0.01);与DM 组相比,在下调肝脏microRNA-195 表达后,DM+antago 组肝脏组织中MDA的含量明显下降(P<0.01),T-SOD活力显著上升(P<0.01)(图4)。
3 讨论
1型糖尿病(T1DM)是一种慢性自身免疫疾病,通过破坏胰腺产生胰岛素β-细胞, 从而导致胰岛素缺乏和过量的葡萄糖产生[7]。氧化应激损伤是糖尿病所致肝病重要的发病机制之一[8]。
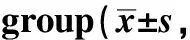
表1 各组小鼠肝组织中 Sirt1、CypD、Bcl-2、Bax、 caspase-3和 AcFoxo1/Foxo1蛋白的表达
*P<0.05 compared with control group;#P<0.05 compared with DM group.

A.content of MDA was detected by thiobarbituric acid method; B.total SOD activity was analysed by hydroxylamine method;*P<0.05 compared with control group;#P<0.05 compared with group DM
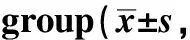
miR-195是微小RNA-15家族中的一员。T2DM中miR-195随血糖升高在肝脏中上调[9]。前期研究发现,miR-195抑制剂可改善高糖对心肌氧化应激损伤的影响,但在肝脏中是否同样发挥作用有待进一步研究。本实验发现miR-195抑制剂可使肝细胞水肿等病变明显减轻。miR-195通过位于Sirt1 mRNA 3′非翻译区的两个靶位点靶向抑制Sirt1表达[10]。前期研究发现,在糖尿病心肌病中miR-195抑制剂可调高心肌组织中Sirt1表达。本实验发现, miR-195明显升高,Sirt1明显降低。miR-195被抑制后Sirt1有所上调,说明在I型小鼠糖尿病肝病模型中miR-195负向调节Sirt1。Sirt1的增加能促进Foxo1去乙酰化,同时降低Foxo1的乙酰化[11]。Foxo1去乙酰化后能参与调控抗氧化系统的相关基因的转录[12]。本实验AcFoxo1/Foxo1水平DM组较对照组增高,而DM+antago组较DM组下降,推测miR-195抑制剂增加Sirt1的表达后,Foxo1的去乙酰化水平增高。
线粒体在氧化应激损伤刺激下发生MPT。当MPT较严重时发生细胞凋亡信号通路的激活。CypD定位在线粒体的基质里。CypD缺陷抑制MPT,降低Ca2+和氧化应激诱导的细胞死亡[13]。Bcl-2蛋白定位于线粒体外膜上,可以抑制经过损伤刺激的Bax从细胞质转位到线粒体外膜形成大孔道的过程从而抑制线粒体凋亡的发生[14]。本实验中,DM 组较对照组CypD、caspase-3、Bax表达量明显提升,Bcl-2 表达明显降低; 而抑制miR-195 的表达后,CypD、caspase-3、Bax 显著降低,而Bcl-2明显升高。SOD和MDA是一组经典的氧化应激指标,本实验相比于对照组DM组肝组织T-SOD活力明显下降,MDA含量显著上升;和DM组相比,DM+antago 组的T-SOD活力显著增加,而MDA含量显著降低。由此可进一步推测:miR-195抑制可使线粒体细胞膜稳定性增加,肝细胞的凋亡降低,增强肝脏氧化应激耐受。
综上,推测在I型糖尿病B6小鼠的模型中,miR-195抑制剂可使Sirt1的表达升高,增加下游Foxo1的去乙酰化,从而增强对抗氧化相关基因的调节,同时增加了线粒体的膜稳定性,最终减少肝细胞因糖尿病所致氧化应激的凋亡。

