Opa相互作用蛋白5在胰腺癌中的表达及其对PANC-1细胞增殖的影响
周鸿铭,唐小牛,郭 伟,吕业超,姜玉新
(皖南医学院 基础医学院 医学寄生虫学教研室,安徽 芜湖 241002)
胰腺癌(pancreatic cancer,PC)是一种恶性消化系统肿瘤,是世界范围内最具侵袭性的恶性肿瘤之一[1],全球每年因患胰腺癌而死亡的患者超过200万例[2],在中国胰腺癌位列中国城市男性恶性肿瘤发病率的第8位,居北京市和上海市人群恶性肿瘤死亡率的第5位,且每年均呈上升趋势[3-4],其发病隐匿、早期诊断困难、易发生转移、预后较差。5年生存率低于5%。
Opa(Neisseria gonorrhoeae opacity-associated)相互作用蛋白5(OIP5)也称为hMis18beta[4]、LINT-2511[6],属于癌/睾丸抗原(cancer/testis antigens,CTA)蛋白。其编码基因位于15号染色体。研究发现,OIP5与C21orf45和M18BP1形成复合物,在有丝分裂末期的着丝粒中特异性积累,对着丝粒/动粒的结构和功能至关重要[7];此外,该基因通过E2F-Rb通路在细胞周期进展中发挥重要调控作用。这一功能是通过与视网膜母细胞瘤蛋白和LAP2α(lamina-associated polypeptide 2α,板层素相关多肽2亚型α)相互作用介导的[8-9]。总的来说,这些发现均说明了OIP5在细胞各个生物学进程中的关键作用[10]。
OIP5异位表达已在几种肿瘤中被鉴定。OIP5高表达与晚期肾透明细胞癌相关,且患者总生存时间缩短[11]。OIP5在结直肠癌[12]、胃癌[13]或急性髓性白血病[14]患者的肿瘤样本中也高表达。OIP5高表达与肺癌和食管癌患者的预后不良显著相关,是预后生物标志物和癌治疗最有希望的靶标[15]。进一步研究观察,OIP5上调通过mTORC2和p38/PTEN信号通路诱导AKT活化,并通过磷酸化β-连环蛋白和GSK-3β增强其核转位来激活β-连环蛋白信号传导[16];OIP5下调通过其对mTORC1和β-连环蛋白途径的作用抑制OIP5致癌信号传导[16]。但目前尚未见OIP5在胰腺癌中的表达及其相关生物学功能的报道。因此,本研究首先分析了公共数据中关于OIP5在胰腺癌的表达情况,检测了其在胰腺癌细胞中的表达,并构建慢病毒敲减载体,观察OIP5敲减对胰腺癌细胞的存活率、凋亡率以及细胞克隆形成的影响,为探讨OIP5在胰腺癌中的作用提供实验依据。
1 材料与方法
1.1 材料
1.1.1 细胞系:人胰腺癌细胞系 MIAPaCa-2、PANC-1、KP-3、BxPC-3和人胚肾细胞系(HEK)293T(中国科学院上海细胞库)。
1.1.2 主要试剂:DMEM(Gibco公司);胎牛血清(Ausbian公司);1%青霉素和链霉素溶液、Trizol试剂和4%多聚甲醛(上海生工生物股份有限公司);牛磺酸、HEPES和RT-PCR Superscript Ⅱ(Invitrogen公司);pGCSIL-GFP载体和pHelper系统(上海吉凯基因化学有限公司);SYBR Master Mixture试剂盒(TaKaRa 公司);MTT(北京鼎国生物技术公司);二甲基亚砜(DMSO)(上海国药集团);Giemsa染液(Chemicon International 公司);膜联蛋白V-APC(eBioscience公司)。兔抗GAPDH和OIP5一抗以及HR标记的IgG二抗(Sigma-Aldrich 公司)。其他均为国产分析纯。
1.2 方法
1.2.1 OIP5在临床样本中的表达分析:本研究通过公共在线数据库GEPIA(http://gepia.cancer-pku.cn/)[17]分析了OIP5在胰腺癌样本及癌旁和正常样本中的表达,同时,分析了其总生存率和无病生存率。
1.2.2 细胞的培养:在DMEM中培养细胞系,补充10%胎牛血清,1%青霉素和链霉素溶液,3 mmol/L牛磺酸和25 mmol/L HEPES,并在37 ℃、5% CO2培养箱中孵育。细胞汇合度>75%进行后续实验。
1.2.3 慢病毒载体的构建及细胞转染:根据人OIP5基因(GenBank登录号NM_007280)全长开放读码框设计特异性沉默序列;同时合成对照序列。序列如下:OIP5基因shRNA序列:5′-CTACCTCTG AAGGCTACACTT-3′,对照序列:5′-TTCTCCGAA CGTGTCACGT-3′。将带有上述序列的茎环寡核苷酸插入pGCSIL-GFP载体,并构建重组载体pGCSIL-shOIP5和pGCSIL-shCtrl。根据文献报道进行慢病毒颗粒包装[18]。简言之,根据试剂盒说明书,使用pHelper系统将pGCSIL-shOIP5/pGCSIL-shCtrl共转染到HEK-293T细胞,转染后48 h收获慢病毒。
将PANC-1细胞(5×104个/孔)接种到6孔板中,并用感染复数(MOI)为20的pGCSIL-shOIP5慢病毒或pGCSIL-shCtrl转染。将细胞在37 ℃、5%CO2培养孵育72 h后,荧光显微镜下观察细胞增殖情况。5 d 后,使用实时定量聚合酶链反应(RT-qPCR)和蛋白质印迹测定慢病毒敲低效率。
1.2.4 RT-qPCR检测OIP5 mRNA:使用Trizol试剂从细胞系中分离总RNA。使用2 μg总RNA,50 μmol/L Oligo(T)和1μL(200 U)RT-PCR Superscript Ⅱ在37 ℃下进行反转录50 min。扩增OIP5的特异性引物如下:OIP5上游引物:5′-TGGCATTGAAGGTTCA CTCA-3′;下游引物:5′-AGGGCAGCATGGGTAGAAT A-3′。使用SYBR Master Mixture试剂盒在qPCR循环仪上进行RT-qPCR。用GAPDH作为内参。使用Pfaffl[12]方法分析数据。
1.2.5 MTT检测法细胞增殖试验:处于对数期的PANC-1细胞悬液铺到96孔板(2 000个/100 μL/孔),设置3个复孔,在CO2培养箱中培养;24 h后用Celigo细胞计数仪读板,连续检测5 d,并绘制细胞曲线。
用pGCSIL-shOIP5、pGCSIL-shCtrl质粒转染的PANC-1细胞(1 000个细胞/100 μL/孔)分别接种到96孔板中,并在37 ℃和5% CO2下连续孵育5 d。随后,向每孔中加入10 μL MTT(5 g/L),并在37 ℃培养箱中孵育4 h。然后,弃去上清液,向各孔中加入100 μL二甲基亚砜,并于37 ℃温育10 min。酶标仪测490 nm的吸光度值。
1.2.6 集落形成试验:将pGCSIL-shCtrl和pGCSIL-shOIP5转染的PANC-1细胞(1 000个/孔)接种在6孔板中并孵育10 d以形成集落。每2 d更换新鲜培养基。随后用PBS(pH 7.2)洗涤细胞,并用4%多聚甲醛固定30~60 min。用PBS洗涤固定的细胞,并用100 μL Giemsa染液染色20 min。在光学显微镜下计数含有>50个细胞的菌落总数。
1.2.7 流式细胞仪分析细胞凋亡:将PANC-1细胞以5×104个/孔的密度培养到6孔板中。pGCSIL-shCtrl和pGCSIL-shOIP5慢病毒感染后5 d,收集细胞系并用冰冷的PBS(pH 7.4)洗涤。用1×染色缓冲液将细胞浓度调节至1×106/mL。将100 μL细胞悬浮液用5 μL膜联蛋白V-APC染色,并在室温下避光孵育10~15 min。流式细胞仪分析细胞凋亡情况。所有实验重复3次检测。
1.3 统计学分析
2 结果
2.1 OIP5在胰腺癌中的表达与预后的关系
胰腺癌中OIP5 mRNA表达显著高于正常胰腺组织(P<0.05)(图1A),OIP5高表达患者的总存活率显著低于OIP5低表达患者(P<0.05)(图1B),且其无病生存率也显著降低(P<0.05)(图1C)。
2.2 胰腺癌细胞OIP5的表达
OIP5mRNA在MIAPaCa-2、PANC-1和KP-3中表达较高,而在BxPC-3细胞中的表达较低(图2A)。Western blot也证实了OIP5蛋白在上述细胞中的表达程度(图2B)。
2.3 慢病毒pGCSIL-shOIP5转染对PANC-1细胞中OIP5表达的影响
慢病毒pGCSIL-shOIP5和pGCSIL-shCtrl用于感染PANC-1细胞。(图3A),超过80%的细胞被pGCSIL-shOIP5/pGCSIL-shCtrl慢病毒感染。为了确定pGCSIL-shOIP5慢病毒的敲低效应,通过RT-qPCR和蛋白印迹法分析检测了PANC-1细胞系中的OIP5表达。与pGCSIL-shCtrl慢病毒转染组相比,在PANC-1细胞中通过pGCSIL-shOIP5慢病毒转染显著降低OIP5 mRNA表达(P<0.01)(图3B)。pGCSIL-shOIP5慢病毒转染也下调了OIP5蛋白表达(图3C)。

A.expression of OIP5 mRNA in pancreatic cancer and normal pancreatic tissue; B.overall survival curve of OIP5 expression in patient with pancreatic cancer; C.disease free survival curve of OIP5 expression in patient with pancreatic cancer
图1 在线分析OIP5在胰腺癌组织及正常组织中的表达及其生存分析
Fig 1 Online analysis of OIP5 expression and survival analysis in pancreatic cancer tissues and normal tissues on the GEPIA website

A.OIP5 mRNA expression in four pancreatic cancer cell lines; B.Validation of OIP5 protein expression in four pancreatic cancer cell lines图2 OIP5在胰腺癌细胞系中的表达检测Fig 2 Expression of OIP5 mRNA in four pancreatic
2.4 OIP5沉默对胰腺癌PANC-1细胞增殖的影响
用pGCSIL-shCtrl慢病毒转染的细胞数量在5 d内显著逐渐增加,而pGCSIL-shOIP5转染细胞的数量增加幅度较缓。尤其是第4天和第5天,显著低于shCtrl组(P<0.01)(图4A,B)。此外,MTT检测结果进一步证实OIP5沉默在第4天和第5天显著抑制了PANC-1细胞的增殖(P<0.01)(图4C)。
2.5 OIP5沉默对胰腺癌PANC-1细胞集落形成的影响
shOIP5慢病毒转染的PANC-1细胞集落形成明显受抑(图5A)。经检测,OIP5沉默后细胞集落数(平均为9个)显著低于shCtrl对照组中的数量(平均为40个)(P<0.01)(图5B)。

A.the transfection effeciency of lentivirus vectors pGCSIL-shOIP5 and pGCSIL-shCtrl on PANC-1 cells(×100); B.effects of pGCSIL-shOIP5 knockdown on the expression of OIP5 mRNA in PANC-1 cells,*P<0.01 compared with shCtrl group; C.effects of pGCSIL-shOIP5 knockdown on the expression of OIP5 protein in PANC-1 cells


A.representative image of proliferation of PANC-1 cells(×100); B.PANC-1 cell count; C.te proliferation ratio of PANC-1 was measured by MTT;*P<0.01 compared with shCtrl group

2.6 OIP5沉默对胰腺癌PANC-1细胞凋亡的影响
如图6A所示,OIP5沉默后PANC-1细胞凋亡比例为8.3%,明显高于shCtrl慢病毒转染的细胞(细胞凋亡比例为4.5%)(P<0.01)(图6B)。
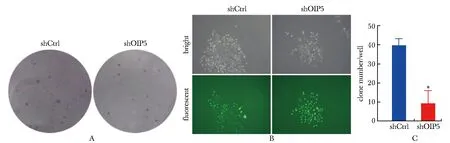
A.representative picture of colony formation for PANC-1 cell after transfecting relative lentiviruses(×100); B.representative images of individual colonis under light and fluorescence microscopes(×100); C.analysis of the number of clones in each well,*P<0.01 compared with shCtrl group

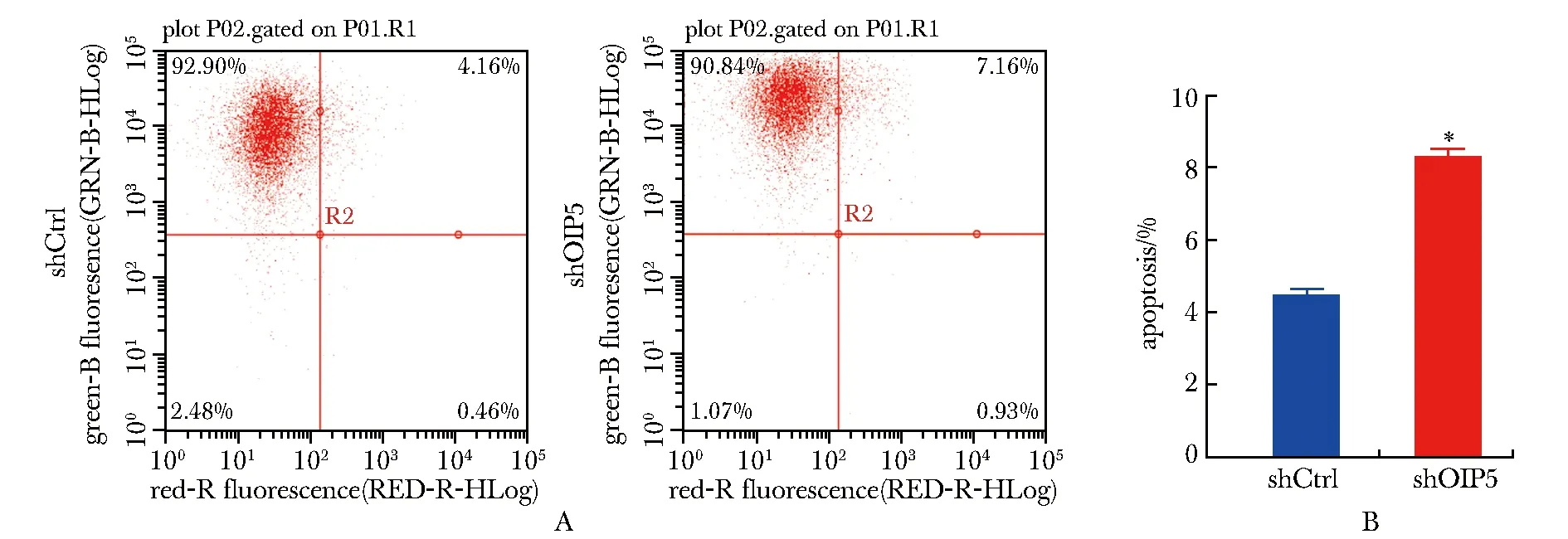
A.representative results of apoptotic cells analyzed by flow cytometry; B.analysis of apoptotic rate of PANCA-1 cells after shOIP5 or shCtrl knockdown,*P<0.01 compared with shCtrl group

3 讨论
癌/睾丸抗原(CTA)具有免疫原性、高度的肿瘤特异性并表达于各种肿瘤中。这些特征使CTA成为肿瘤免疫疗法的最有希望的候选者之一[21]。CTA根据其编码基因的染色体定位分为两个亚类,包括染色体X编码的CT抗原和常染色体编码的癌/睾丸抗原[21]。OIP5是一种常染色体编码的CTA。研究显示,CTA通常作为癌基因促进肿瘤发展。OY-YES-1是人OIP5的CTAs同源物,抑制OY-YES-1的表达可降低肝细胞癌的细胞凋亡、迁移和转移[22]。
OIP5异常表达于几种肿瘤,包括胶质母细胞瘤[23]、膀胱癌[24-25]、急性髓性白血病[14]、非小细胞肺癌、食管鳞状细胞癌[15]、乳腺癌[26-27]、肾透明细胞癌[11]、鼻咽癌、结直肠癌和胃癌[12]和肝细胞癌[16]。此外,OIP5表达与男性,肿瘤大小,肿瘤恶性程度和较高的T分类显著正相关[24]。与OIP5表达较低的患者相比,具有高OIP5表达的膀胱癌患者的存活时间更短。在NSCLC和食管癌中,高度OIP5表达预示较短的患者的总体存活[15]。OIP5表达与食管癌淋巴结转移呈正相关。在肾透明细胞癌中,OIP5上调与TNM分期和较差的预后呈正相关[4]。本研究中,基于生物信息学的数据显示OIP5在胰腺癌组织中也高度表达,且OIP5 mRNA高表达的胰腺癌患者表现出总生存率和无病生存率均显著降低。
OIP5参与几种癌类型的细胞进展,因为它对细胞增殖和细胞凋亡起作用。OIP5敲低抑制了膀胱癌的集落形成能力并抑制了细胞[24]。在非小细胞肺癌、食管癌和肾透明细胞癌中,OIP5下调显著降低细胞活力和集落形成效率,而OIP5表达的恢复促进细胞生长[11,15]。OIP5敲低也导致结肠直肠癌和胃癌细胞系中的细胞抑制[12]。此外,OIP5在肥胖患者的白色脂肪组织中过度表达,并促进脂肪前体细胞和成熟细胞的增殖并导致脂肪增生[28]。
本研究中,RT-qPCR和Western blot检测OIP5在多个细胞系中的表达结果证实,OIP5在胰腺癌细胞系中具有高表达。为了探讨OIP5在胰腺癌中的作用,通过构建慢病毒敲减载体,观察了OIP5敲减对胰腺癌PANC-1细胞的增殖、凋亡以及集落形成的影响,结果显示,OIP5沉默可显著抑制胰腺癌PANC-1细胞的增殖,提示OIP5可能是胰腺癌的靶向治疗[26,29]。
综上所述,OIP5在胰腺癌细胞系中具有高表达,OIP5基因可调控胰腺癌PANC-1细胞的增殖、凋亡以及集落形成,具体机制还有待进一步研究,提示OIP5可能在胰腺癌发病机制中作为癌基因发挥作用,从而为胰腺癌的靶向治疗提供了潜在的生物标志物。

