gp73在小鼠肝纤维化肝组织中的表达及机制
马玲玉,甄一宁,罗云萍,段昭君
(中国医学科学院基础医学研究所 北京协和医学院基础学院 免疫学系, 北京 100005)
肝纤维化是由于肝脏受到各类刺激损伤后,在肝内发生的细胞外基质(extracellular matrix, ECM)沉积与降解过程失衡的一种病理过程。肝星状细胞(hepatic stellate cells,HSCs)在肝纤维化过程中发挥了重要的作用。HSCs在肝纤维化中被激活,合成并分泌多种ECM成分[1]。增多的ECM积聚在肝细胞与内皮细胞之间的腔隙中,影响肝细胞与血管之间的物质交换[2-3]。由于肝纤维化难于在早期发现,而一旦发现往往已是肝硬化阶段,给治疗带来巨大挑战,所以必须深入了解肝纤维化的病理变化,探索出有效的早期诊断和治疗的方案。
高尔基体跨膜糖蛋白73(golgi protein 73, gp73)是高尔基体膜上的一种驻留蛋白,位于顺式和中间高尔基体池中,因为其最初发现时分子质量大小为73 ku而得名[4]。该蛋白在正常的肝脏中几乎不表达或低表达,而在病毒感染的组织和许多肿瘤中表达上调,尤其是在肝癌患者的血清中,因此血清GP73也成为了目前关注较多的一种新兴肿瘤标志物[5]。进一步研究表明,血清GP73可以提升有肝硬化背景的肝癌患者的诊断灵敏性和特异性[6]。并且GP73在肝纤维化患者的血清中表达也升高[7-8],但是相关的机制并不是十分明确。本研究旨在对gp73在肝纤维化过程中是否表达升高以及对升高的原因进行初步探索。
1 材料与方法
1.1 材料
1.1.1 实验动物及细胞系:SPF级6周C57BL/6J雄鼠(中国医学科学院基础医学研究所实验动物中心);SPF级C57BL/6-IGF2BP3floxp/floxp鼠(陆军军医大学叶丽林教授馈赠);SPF级B6.129-ROSA26tm101(CreERT2)/V鼠(Rosa26-cre/ERT2)(北京唯尚立德生物科技有限公司);人胚肾细胞系HEK-293T(中国医学科学院基础医学研究所细胞资源中心)。
1.1.2 试剂:Sirius Red染液、Acetic acid solution(abcam公司);GOLPH2抗体(Proteintech公司);IGF2BP3(胰岛素样生长因子2 mRNA结合蛋白3,insulin like growth factor 2 mRNA binding protein 3, IGF2BP3)抗体(Novus公司);ELISA检测试剂盒(武汉云克隆科技股份有限公司)。
1.2 方法
1.2.1 CCl4诱导小鼠纤维化模型: 将玉米油与四氯化碳(CCl4)按照4∶1的比例稀释,每周2次腹腔注射C57BL/6J小鼠,每只小鼠注射剂量为150 μL。6周后脱颈处死小鼠。对照组按照相同剂量注射玉米油。
1.2.2 ELISA法检测小鼠血清gp73水平: 首先按照试剂盒说明书将检测所用的标准品稀释成7个浓度,收集的小鼠血清稀释10倍,然后将样品与标准品加入检测孔板中在37 ℃下温育1 h。接下来甩干孔板,加入检测工作液A后再次在37 ℃下温育1 h。弃去液体后,加入洗涤液浸泡2 min,然后弃掉洗涤液甩干,重复3次后加入工作液B,于37 ℃下温育30 min,接着重复洗涤步骤5次。最后加入底物溶液,在37 ℃下避光显色,18 min后加入终止液。用酶标仪在450 nm波长处检测吸光度值。
1.2.3 免疫组化染色: 将石蜡切片烤片后,进行梯度脱蜡,用碱性修复液进行抗原修复,然后在样本上滴加3% H2O2,室温下静置15 min以去除内源性过氧化物酶干扰。用羊血清室温静置封闭1 h后进行抗体的孵育。然后加入DAB显色液显色。最后将切片脱水后封片,在显微镜下进行观察。
1.2.4 原代肝星状细胞(HSCs)分离: 将麻醉后的小鼠仰卧位固定在泡沫板上,用眼科剪和镊子剖开腹部暴露肝脏,从下腔静脉依次灌入DMEM培养基和消化酶,之后剪下肝脏,轻轻研磨后放入体外消化酶中37 ℃ 消化20 min,消化完成后用200目滤网过滤,用DMEM培养基洗细胞2次后用4.5 mL培养基重悬细胞,与等体积的20%的OptiPREPTM梯度液混匀后在液面上轻轻加2 mL的DMEM培养基,将配好的细胞梯度液小心地在4 ℃,1 380×g条件下离心20 min。最后在9 mL处得到白色层细胞即为HSCs。
1.2.5 细胞转染: 在转染前一天将合适密度的细胞铺板。按照转染试剂说明书稀释质粒,随后将转染质粒与试剂的混合液加入细胞中,4~6 h后换液,继续培养48 h,然后收取细胞进行后续检测。
1.2.6 RT-PCR检测相关基因的表达改变: 用Trizol提取293T细胞总RNA后按照RT-PCR试剂盒的方法反转录合成cDNA,然后以cDNA为模板,按照试剂盒的体系进行PCR的相对定量检测。引物序列(h-人源;m-鼠源):h-GOLM1上游引物:5′-AGAGCGTCAACAAGCTGTACC-3′,h-GOLM1下游引物:5′-CAGCCTGCCGTAATTCCTCTG-3′;h-IGF2BP3上游引物:5′-AGCTGAGGAGGAGATCATGAAG-3′,h-IGF2BP3下游引物:5′-AAGGCGTTCAGATTTAAT CCAG-3′;m-GOLM1上游引物:5′-ATCTCTTGGGTCG CTTGGAC-3′,m-GOLM1下游引物:5′-GTTCCACGC TTCTCGAGCTA-3′;m-acat2上游引物:5′-CCCGTGG TCATCGTCTCAG-3′,m-acat2下游引物:5′-GGACA GGGCACCATTGAAGG-3′。
1.2.7 流式细胞计量术: 首先将两组小鼠的肝组织取下,制成单细胞悬液,离心后加入事先准备好的抗体溶液,放于冰上避光孵育30 min,用磷酸盐缓冲液(PBS)洗涤细胞2次后,最后一次用PBS重悬细胞,准备上机检测。
1.3 统计学分析
2 结果
2.1 C57小鼠肝纤维化模型的鉴定
与对照组相比,CCl4组的肝组织中有大量被染为红色的胶原纤维,证明纤维化模型构建成功(图1)。

图1 Sirius Red染色鉴定构建的纤维化小鼠模型Fig 1 Mouse model of fibrosis was identified by Sirius Red staining(×40)
2.2 肝纤维化小鼠的血清中gp73蛋白水平升高
与对照组小鼠血清中gp73水平(204±20)ng/mL相比,肝纤维化小鼠血清中的gp73蛋白水平(285±16)ng/mL明显升高(P<0.01)(图2)。
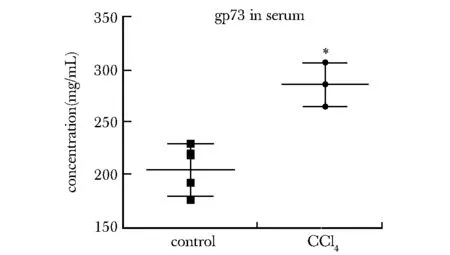
*P<0.01 compared with control group图2 纤维化小鼠的血清中gp73蛋白水平升高Fig 2 gp73 protein were elevated in the serum of
2.3 肝纤维化小鼠的肝组织中gp73蛋白水平升高
与对照组相比,纤维化组的肝组织中gp73表达水平升高(P<0.05)(图3)。
2.4 肝纤维化小鼠的HSCs中GOLM1 表达升高
与对照组相比,纤维化组的HSCs中GOLM1表达水平升高(P<0.001)(图4)。
2.5 肝纤维化小鼠的肝组织中IGF2BP3蛋白水平升高
对来自TCGA数据库的RNA测序结果进行基因表达的相关性分析,样本包括肝细胞癌患者的肿瘤组织以及正常人肝组织,分析发现GOLM1和IGF2BP3呈现正相关的关系(http://gepia.cancer-pku.cn/index.html)(图5A)。两组小鼠免疫组化结果如图5B。阳性的染色区域统计相比于对照组, 纤维化的肝组织中IGF2BP3蛋白表达水平升高(P<0.05)(图5C)。
2.6 IGF2BP3过表达和敲低能影响GOLM1表达水平

A.immunohistochemistry of liver tissue; B.the statistics of the positive staining area; *P<0.05 compared with control group

*P<0.001 compared with control group图4 C57小鼠肝纤维化模型的HSC中GOLM1 表达升高Fig 4 GOLM1 expression was elevated in hepatic stellate cells of C57 mouse hepatic fibrosis model
如图6A,随着IGF2BP3表达水平的升高,GOLM1的mRNA水平相较于对照组(OE Ctrl)显著升高(P<0.001);而在293T瞬时转染shRNA质粒sh1、sh2后,随着IGF2BP3的表达水平降低,GOLM1的mRNA水平随之降低(P<0.01)(图6B)。
2.7 IGF2BP3基因敲除鼠肝纤维化模型的HSCs中gp73水平下降
构建IGF2BP3基因敲除鼠(IGF2BP3floxp/floxpERT2-cre)和野生鼠(C57BL/6J)(WT)的肝纤维化模型,分离肝组织中的HSCs,然后进行流式细胞计量术检测。与WT组HSCs中gp73表达(35.38±3.74)相比,gp73蛋白水平在IGF2BP3敲除组的HSCs中表达(23.64±5.48)降低(P<0.01)(图7)。

A.IGF2BP3 was positively correlated with GOLM1; B.immunohistochemistry of liver tissue(×10); C.the statistics of the positive staining area;*P<0.05 compared with control group


A.GOLM1 expression level was increased afterIGF2BP3 was over-expressed; B.GOLM1 was down-regulated afterIGF2BP3 was knocked down;*P<0.05,**P<0.01,***P<0.001 compared with control group


A.flow cytometry chart of HSC; B.statistical chart of HSC by flow cytometry; *P<0.01 compared with control group图7 IGF2BP3基因敲除鼠肝纤维化的HSCs中gp73水平下降Fig 7 Protein levels of gp73 in HSCs was decreased in fibrotic IGF2BP3 knockout
3 讨论
目前研究肝纤维化所用的动物模型主要有腹腔注射CCl4诱导、胆管结扎手术和血清免疫法等,而其中以CCl4腹腔注射诱导法简单易行且稳定可靠。本研究中即采用腹腔注射CCl4法来诱导小鼠肝纤维化,在肝纤维化成功构建的基础上,检测发现血清中gp73的含量显著升高,镜下肝细胞肿胀,炎性反应细胞浸润,这与临床患者血清GP73升高以及病理改变类似,因此用此模型研究血清gp73在肝纤维化中的变化及相关机制是合适的。GP73是位于高尔基体膜上的Ⅱ型跨膜蛋白,由Kladney等首次分离并鉴定[4]。本研究发现在肝纤维化后HSC内表达gp73升高,而HSCs是肝纤维化中的关键细胞,这一发现为接下来肝纤维化的相关机制研究提供了线索。IGF2BP3是胰岛素样生长因子2信使RNA结合蛋白家族的成员之一,对多种RNA生命活动的各个方面如合成、剪接及降解都发挥了重要作用[11]。IGF2BP3不仅可以促进肝纤维化中的关键细胞HSCs向活化形式转变,并且能够促进HSCs的迁移[9, 12]。本研究中发现纤维化肝组织中gp73和IGF2BP3水平均升高,进一步的体外实验发现IGF2BP3过表达和敲低能够影响GP73的表达,并且在IGF2BP3敲除鼠的纤维化肝组织HSCs中gp73水平也是下降的,提示纤维化时GP73的升高表达可能受IGF2BP3调控。IGF2BP3作为RNA结合蛋白可以与mRNA结合增强其稳定性[10],由此可以进行推测,在肝纤维化过程中升高表达的IGF2BP3通过增强GOLM1的稳定性来促进其表达。
综上所述,本研究发现 gp73蛋白在纤维化小鼠的血清和肝组织中显著升高,同时肝组织中的IGF2BP3水平也是升高的,并且GP73表达水平与IGF2BP3的表达水平有一定相关性。后续的工作将进一步探索两者之间的关系,为肝纤维化诊断、治疗或预后评估提供参考。

