养精种玉汤对小鼠卵母细胞体外成熟及PDGFA和PDGFRα表达的影响*
肖彩仙, 段 恒, 唐立明
(重庆医科大学中医药学院,重庆400016)
近年来,由于生活方式和社会环境的改变,晚婚晚育者、卵巢功能不全者和肿瘤年轻患者等增多,不孕症患者比例逐年上升[1]。卵母细胞体外成熟(in vitro maturation,IVM)成为治疗不孕症的一种潜在有效的方法[2]。目前,全世界应用IVM技术诞生的试管婴儿有5 000多名,中国也广泛应用该技术治疗多囊卵巢综合征的不孕患者[3-4]。尽管IVM实践有了很大发展,但仍然存在成熟率低、稳定性差等问题,不能得到全面推广[5]。中药可用于辅助生殖,减轻卵巢过度刺激综合征,改善卵泡发育和卵子质量[6]。养精种玉汤(Yangjing-Zhongyu decoctin,YZD)为治疗不孕症的经典名方,临床和动物实验研究显示,养精种玉汤可以治疗女性不孕,提高卵母细胞成熟率[7-8]。
血小板源性生长因子(platelet-derived growth factor,PDGF)家族的成员是由4种不同基因编码的4种不同多肽链(A、B、C和D)组成的二聚糖蛋白,这些多肽链合成时为无活性前体,在蛋白水解加工后,4个PDGF链通过同源二聚化或异二聚化组装成二硫键连接的二聚体,产生5种不同的二聚体同种型:PDGF-AA、PDGF-AB、PDGF-BB、PDGF-CC和PDGFDD[9]。有研究显示,PDGF的A亚基(PDGF subunit A,PDGFA)和 PDGF受 体 α(PDGF receptorα,PDGFRα)在卵母细胞中表达,向培养基中添加PDGF可以促进原始卵泡的发育,而PDGFRα基因的突变则会导致小鼠卵巢变小,进而影响卵母细胞的成熟[10-12]。因此,本研究观察养精种玉汤对小鼠卵母细胞体外成熟的影响,并进一步观察养精种玉汤对小鼠卵母细胞体外成熟PDGFA和PDGFRα表达的影响,探讨PDGFA和PDGFRα对小鼠卵母细胞体外成熟的作用机制。
材料和方法
1 材料
1.1 动物 SPF级雌性KM小鼠140只,8~10周龄,体质量25~30 g,SPF级雄性KM小鼠12只,12周龄,体质量30~35 g,均由重庆医科大学动物实验中心提供,许可证号为SYXK(渝)2018-0003。
1.2 药物和试剂 养精种玉汤含熟地90 g、当归45 g、白芍45 g和山萸肉45 g,购自重庆桐君阁大药房,经重庆医科大学中医药学院中药教研室制备成含生药1.5 kg/L的浸膏;由费耀教授根据2015版《中国药典》鉴定为正品,生产批号为20181102。注射用尿促卵泡激素(follicle stimulating hormone,FSH;丽珠制药厂,生产批号H20052130);孕马血清促性腺激素(pregnant mare serum gonadotropin,PMSG;浙江宁波三生药业有限公司,生产批号110044564);胎牛血清(Biological Industries,04-400-1B);M199培养基(Gibco,12340030);抗PDGFA抗体(Affinity,AF5179);抗PDGFRα抗体(Affinity,AF0241);抗 β-actin抗体(CST,4970T);goat anti-rabbit IgG(博奥森,0295G);RNA提取试剂盒(Axygen,AP-MN-MS-RNA-50);逆转录试剂盒(Bimake,B24403)。
1.3 仪器 CO2细胞培养箱(Thermo);XTL-400型体视显微镜(重庆澳浦光电技术有限公司);Synergy HTX全自动酶标仪和CFX PCR检测系统(Bio-Rad);Odyssey Fc双色红外荧光成像系统(LI-COR Biosciences);NanoDrop 2000超微量核酸测定仪(Thermo)。
2 方法
2.1 养精种玉汤血清的制备 将16只雌性小鼠按随机数字表法分为对照组和养精种玉汤组,每组各8只,按20 g/kg剂量灌胃给药,正常组给等体积的生理盐水,每天1次,连续3 d。我们前期采用高效液相色谱监测养精种玉汤的最佳取血时点,发现养精种玉汤灌胃后0.5 h达最高药物吸收峰值,因此我们选择末次给药0.5 h后摘眼球取血。常温下静置2 h,4℃、3 000 r/min离心15 min,0.22μm微孔滤膜过滤除菌后分装,于-80℃冷藏备用。
2.2 小鼠卵母细胞的采集与分组 小鼠处死前46~48 h腹腔注射10 U PMSG,每只0.1 mL,无菌打开腹腔,取出卵巢,清洗3次。在解剖镜下,用1 mL注射针头刺破卵巢中的卵泡,用巴氏吸管收集未成熟的卵母细胞-颗粒细胞复合体(oocyte-granulosa cell complexes,OCCs),反复清洗4次,将多只小鼠OCCs混合后分为空白(blank)组、空白血清(blank serum)组、养精种玉汤血清(YZD)组和FSH组。将各组分别放入加有10%胎牛血清的M199培养液中,空白血清组、养精种玉汤血清组和FSH组分别加入2%的小鼠血清、养精种玉汤小鼠血清和75 U FSH。放入37℃、5%CO2的培养箱中培养。
2.3 卵母细胞成熟率的计算 OCCs体外培养24 h后,用透明质酸酶消化去除颗粒细胞,在显微镜下观察并计算各组卵母细胞成熟率(成熟卵母细胞个数/卵母细胞总数×100%),有第1极体排出为成熟卵母细胞。
2.4 小鼠体外受精率及卵裂率的计算 雄性小鼠处死后取出附睾及附睾尾,PBS清洗3次,剪成段,释出精子于含10%胎牛血清的培养液中,置于37℃、5%CO2培养箱中培养1~2 h使精子获能。将培养24 h的各组OCCs用透明质酸酶消化去除颗粒细胞,调整精子密度,按精卵约为10 000∶1的比例将精子加入含有卵母细胞的培养液中继续孵育5 h。显微镜下观察并计算卵母细胞的受精率(受精卵个数/成熟卵个数×100%),出现两个原核的细胞为受精卵;24 h后计算卵裂率(卵裂球个数/受精卵数×100%)。
2.5 Western blot检测PDGFA和PDGFRα蛋白的表达 每组收集20只KM小鼠的OCCs,培养24 h后去除颗粒细胞。各组卵母细胞于4℃、5 000 r/min离心5 min,弃上清,加入裂解液,超声破碎细胞,提取总蛋白。采用10%的预制凝胶,140 V电泳,待溴酚蓝至凝胶底部结束电泳;300 mA转膜60 min,室温封闭1.5 h;加入I抗[抗PDGFA(1∶500)和抗PDGFRα(1∶1 000)]4℃过夜;II抗(1∶5 000)室温摇床孵育1.5 h;配制ECL发光液,暗室中曝光2 min;用ImageJ软件对目的条带进行灰度分析,以β-actin为内参照进行比对。
2.6 real-time PCR检测PDGFA和PDGFRα的mRNA表达水平 每组收集6只小鼠的OCCs,培养24 h后去除颗粒细胞,每组卵母细胞加入Buffer RⅠ,用21号注射器反复抽吸10次,转入1.5 mL离心管,然后加入Buffer RⅡ,涡漩振荡,离心,取上清加入异丙醇,混匀。将上述液体移入离心柱内芯,离心,弃滤液,加Buffer W1A,离心,弃滤液,加Buffer W2清洗2次,离心,弃滤液。将离心柱芯转移到1.5 mL离心管,加入Buffer TE,室温静置1 min,离心洗脱得RNA。反应条件为:逆转录42℃15 min,85℃2 min;预变性95℃ 30 s;扩增95℃ 5 s,60℃ 30 s,共40个循环;熔解曲线95℃ 5 s,60℃ 1 min。以GAPDH为内参照,统计分析PDGFA和PDGFRα的mRNA表达。引物信息见表1。
3 统计学处理
用软件SPSS17.0进行数据分析。率的比较用χ2检验;蛋白和mRNA表达的数据表示为均数±标准差(mean±SD),组间均数比较采用单因素方差分析,两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
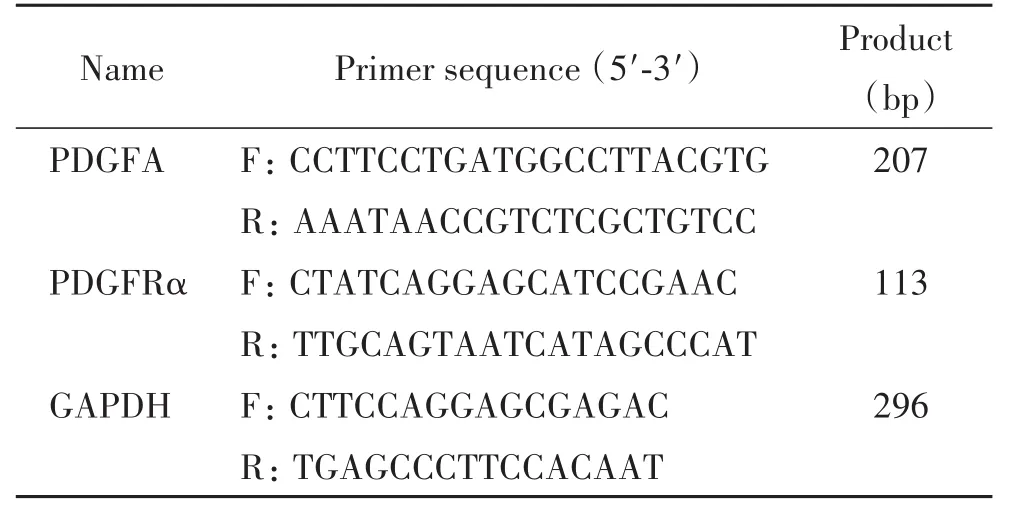
表1 real-time PCR实验的引物序列Table 1.The sequences of the primers for real-time PCR
结 果
1 养精种玉汤对小鼠卵母细胞体外成熟的影响
与空白组和空白血清组比较,养精种玉汤血清组小鼠卵母细胞成熟率显著提高(P<0.01);与FSH组比较,养精种玉汤血清组卵母细胞成熟率的差异无统计学显著性(P>0.05),见图1及表2。这说明养精种玉汤能提高卵母细胞的体外成熟率。

Figure 1.Immature oocytes of each group were cultured in vitro for 24 h(×100).图1 各组未成熟卵母细胞体外培养24 h的形态变化

表2 养精种玉汤对小鼠卵母细胞体外成熟的影响Table 2.Effect of YZDon in vitro maturation of mouse oocytes
2 养精种玉汤对小鼠体外受精和受精卵发育的影响
与空白组比较,养精种玉汤血清组受精率明显提高(P<0.05);与空白血清组比较,养精种玉汤血清组受精率的差异无统计学显著性(P>0.05),但受精率较空白血清组提高,见表3。这提示养精种玉汤能提高卵母细胞受精率。
3 养精种玉汤对PDGFA和PDGFRα蛋白表达的影响
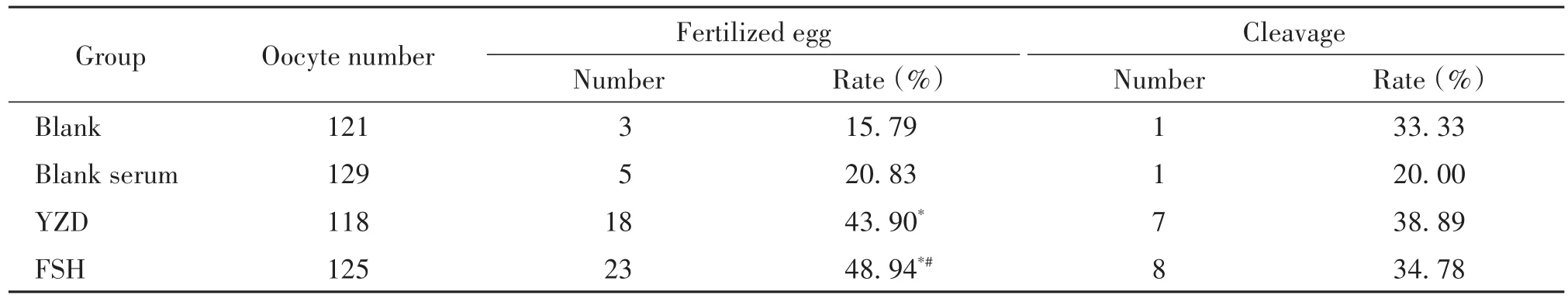
表3 养精种玉汤血清对小鼠体外受精和受精卵发育的影响Table 3.The effect of YZDon in vitro fertilization and fertilized egg development in mice
Western blot结果显示,与空白组和空白组血清组比较,养精种玉汤血清组PDGFA和PDGFRα蛋白的表达减少(P<0.01),见图2。

Figure 2.The protein expression of PDGFA and PDGFRα in the oocytes of each group.Mean±SD.n=3.**P<0.01 vs blank group;##P<0.01 vs blank serumgroup.图2 各组卵母细胞中PDGFA和PDGFRα蛋白的表达
4 养精种玉汤对PDGFA和PDGFRαmRNA表达的影响
real-time PCR结果显示,与空白组和空白血清组比较,养精种玉汤血清组PDGFA和PDGFRα的mRNA表达量减少(P<0.01),见图3。

Figure 3.The mRNA expression of PDGFA and PDGFRα in the oocytes of each group.Mean±SD.n=3.**P<0.01 vs blank group;##P<0.01 vs blank serumgroup.图3 PDGFA和PDGFRα的mRNA在各组卵母细胞中表达的变化
讨 论
养精种玉汤出自《傅青主女科》,由熟地、当归、白芍和山萸肉组成。功效平补肝肾,填精益血,本方所治之证因精血不足,肝肾阴虚,冲任失养而成,故立补血养精之法,精血充足,冲任得养而种子成孕[13]。中医认为:“肾藏精,肾为天癸之源,冲任之本,肾气盛,冲任满盈,天癸蓄极泌至,月事以时下,经调而有子。”名医罗元恺曾指出天癸是非肉眼所能见的元阴,溶于血中,与西医的雌激素尤其相似。在血分雌激素的影响下,卵泡不断发育,当雌激素亦即“阴”的水平达到重阴时卵泡发育成熟,排出卵子,故“女精”即卵子。卵子之精在血分“阴”提高的前题下溢泻,所以有“精血”同源和“精、阴、血”同源之说。傅山所创养精种玉汤,说明血中补阴,阴中养精,养精才能种玉的道理,同时又把血、阴、精联系在一起,从中医的肾-天癸-冲任这一生殖轴确立治疗原则[14-15]。后历经无数医家的反复临床实践及疗效验证,现已成为治疗不孕症的基础方[16]。
PDGF是机体内一种重要的促分裂剂和趋化剂,能刺激机体内各种类型的细胞分裂和增殖[17]。Nilsson等[18]提出PDGF由卵母细胞产生,其作用于周围的颗粒和卵泡膜/间质细胞以促进原始卵泡发育。一些研究报道了哺乳动物卵巢中PDGF及其受体存在于大鼠[11]、人类[19]和猪[10]等,这些实验研究以卵泡或卵巢为研究对象,利用免疫组化研究PDGF蛋白对卵泡发育的作用。但有研究者指出虽然卵泡中卵母细胞的免疫反应性似乎非常特异,但尚不清楚在发育的后期阶段卵泡中观察到的卵母细胞染色是由于蛋白质的存在,还是非特异性抗体结合导致的[11]。本实验结果显示,养精种玉汤血清组较空白组卵母细胞成熟率明显提高,且PDGFA和PDGFRα表达较空白组减少,表明养精种玉汤可以提高小鼠卵母细胞的体外成熟率,同时也证实了在卵泡发育的后期阶段中观察到的卵母细胞PDGFA和PDGFRα染色是由于其蛋白质的存在。
PDGF作为重要的促有丝分裂原,通过与靶细胞膜上的α和β蛋白酪氨酸激酶受体结合,促使有丝分裂信号向胞内传递,从而引起DNA合成、细胞分裂及增殖[17,20]。PDGF结合使PDGFRα二聚化,并激活受体的激酶活性,触发细胞内信号传导级联反应,包括Ras-MAPK、PI3K和PLCγ途径,这些途径都参与了卵母细胞的成熟过程。例如:PDGFR主要通过衔接蛋白Grb2和Shc连接到Ras-MAPK,Grb2通过其SH2结构域结合激活的PDGFR,并通过其SH3结构域复合Sos1激活Raf-1和MAPK级联的下游,从而刺激细胞生长[21]。此外,PDGF在培养细胞中的表达是动态的[21]。Pascuali等[22]研究发现,青春期前(卵泡正处于发育阶段)大鼠PDGF受体的抑制导致卵泡膜和颗粒细胞增殖减少,雌激素浓度降低,他们认为局部抑制PDGF会增加卵巢细胞凋亡,从而发生大量卵泡闭锁。有研究表明,PDGF家族成员的表达受激素调节,用雌激素治疗未成熟小鼠24 h可降低卵巢PDGF及其受体的表达,且免疫组化结果显示PDGFRs的免疫染色随着卵泡发育至窦前期(卵母细胞成熟之前)而增强,但此后减弱[23]。上述研究表明,PDGF及其受体的蛋白表达在发育的卵母细胞中升高,而在卵母细胞成熟时表达下降。本实验结果显示养精种玉汤血清组PDGFA和PDGFRα水平较空白组下降,说明养精种玉汤可能通过下调PDGFA和PDGFRα的蛋白和mRNA表达来促进小鼠卵母细胞的体外成熟。
本实验将养精种玉汤与辅助生殖相结合,丰富了“肾主生殖”的内涵,有利于中医药在辅助生殖中的应用与发展,为辅助生殖领域开辟新途径。

