mmLDL通过p38 MAPK通路上调小鼠肠系膜动脉ET受体*
谢 希, 陈 琛, 林 杰, 汤宏霞, 秦旭平, 李 洁△
(1南华大学附属郴州医院,郴州市第一人民医院,湖南郴州423000;2南华大学药物药理研究所,湖南衡阳421001)
弱氧化修饰低密度脂蛋白(minimally modified low-density lipoprotein,mmLDL)是指载脂蛋白B结构完整、氧化程度轻微的低密度脂蛋白(low-density lipoprotein,LDL),它可以促进单核细胞与内皮细胞黏附;促进血管平滑肌细胞迁移和增殖;促进氧化型低密度脂蛋白(oxidized low-density lipoprotein,oxLDL)形成,从而促进泡沫细胞的产生[1-3];可以损伤内皮细胞导致免疫细胞浸润到血管壁,随后发生脂质沉积和炎症反应[4],产生活性氧簇(reactive oxygen species,ROS)和炎性细胞因子。这一系列反应促进动脉粥样硬化的形成。
p38 MAPK是动脉粥样硬化过程中一种常见的炎症通路[5],参与炎症信号传导,调控细胞黏附分子,调节白细胞介素1β(interleukin-1β,IL-1β)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、IL-6等炎症介质的产生[6],增强血管对血管内皮生长因子和ROS的敏感性,激活NF-κB通路,NF-κB是MAPK通路下游一个核内转录因子,具有明显的增殖、抗凋亡和促炎作用,NF-κB途径的激活在炎症过程中起重要作用[7-8]。在IL-6家族中,IL-6是主要的促炎细胞因子,IL-6信号通路包括糖蛋白130/膜结合IL-6受体通路和糖蛋白130/可溶性IL-6受体通路,分别称为经典信号和反式信号[9]。有研究表明,细胞内MAPK信号通路在调节血管内皮素受体表达中起重要作用[10]。
内皮素(endothelin,ET)系统是由受体及其配体组成,是调节血管张力和血压的重要部分,在心血管发病机制中的发挥重要作用。受体调节是通过改变受体密度和(或)亲和力及靶细胞敏感性来维持组织内稳态的一个重要因素[11]。ET-1是体内最强的血管收缩剂之一,并且引起的收缩作用持久。内皮素受体分为A型(ETA受体)和B型(ETB受体)两种亚型。ETA受体在血管平滑肌细胞(vascular smooth muscle cells,VSMCs)上表达,主要调节血管收缩和细胞增殖[12],并与MAPK通路的激活有关[10]。ETB受体分为ETB1和ETB2两类:ETB1受体位于内皮细胞,通过诱导前列环素I2(prostacyclin I2,PGI2)和一氧化氮(nitric oxide,NO)的释放起血管舒张作用;ETB2受体表达于VSMCs并介导血管收缩反应。在正常生理条件下,ETB2受体基本不表达,不引起收缩效应[13],而在病理条件下,如缺血性心脏病[14]、肺动脉高压[15]和动脉粥样硬化患者[12,16-17],血管平滑肌 ETB2受体表达明显增加,并且介导血管收缩作用明显增强。一般情况下我们说的ETB受体指的是ETB2受体。未见文献报道mmLDL对在体动物动脉ETA受体的作用,但我们已经发现小鼠尾静脉注射mmLDL可以上调肠系膜动脉 ETB受体[1,3]。本研究首次考察小鼠尾静脉注射mmLDL是否通过激活p38 MAPK通路上调肠系膜动脉VSMCs中的ETA受体和ETB受体,以及mmLDL对IL-6的影响。
材料与方法
1 mmLDL的制备
4℃条件下,将0.2 g/L的LDL置于加入了1 μmol/L FeSO4的PBS液体中氧化96 h,最后使用0.25 mmol/L EDTA终止该反应即可生成mmLDL[1,18]。将mmLDL产物使用硫代巴比妥酸反应物(thiobarbituric acid reactive substance,TBARS)法和琼脂糖凝胶电泳法进行鉴定。TBARS法检测结果显示,丙二醛样结构的浓度为(10.95±0.08)μmol/(g LDL);0.8%的琼脂糖凝胶电泳结果显示,mmLDL的电泳迁移率是LDL的(1.67±0.01)倍。制备好的mmLDL于4℃冰箱避光保存,2周内用完。
2 主要试剂
LDL、ETB受体激动剂角蝰毒素6c(sarafotoxin 6c,S6c)、二甲亚砜(dimethyl sulfoxide,DMSO)和BQ-788购于Sigma;抗ETA受体抗体、抗ETB受体抗体、抗p38 MAPK抗体、抗NF-κB p65抗体、抗p-NF-κBp65抗体、辣根过氧化物酶标记的GAPDH单克隆抗体、抗IL-6抗体及辣根过氧化物酶标记的山羊抗兔和山羊抗小鼠IgG购于Pierce Biotechnology;ET-1购于Enzo;抗p-p38 MAPK抗体购于Cell Signaling Technology;Tween 20和IL-6 ELISA试剂盒购于Proteintech Biotechnology;小鼠oxLDL ELISA试剂盒购于北京诚林生物科技有限公司;SB 203580购于Med-Chem Express,需用DMSO初溶。
3 主要仪器
DMT 620微血管张力测定仪(Danish Myo Technology A/S);SZ51立体显微镜(OLYMPUS);显微手术解剖工具(World Precision Instruments);优普纯水机(成都优普纯水设备有限公司);电泳/蛋白转印系统(大连竞迈生物科技有限公司);SW-CJ-2FD型双人单面净化工作台(苏州净化设备有限公司);WX3000P实时荧光定量PCR仪(Stratagene);Image Gauge 4.0(Fuji Photo Film)。
4 实验动物及分组
8~12周龄的SPF级昆明小鼠共140只,体重25~30 g,雌雄均可,购买于湖南斯莱克景达实验动物有限公司,实验动物许可证号为SCXK(湘)2016-0002。适应性喂养7 d后用于实验研究。
动物随机分为正常对照(生理盐水,normal saline,NS)组(尾静脉注射NS)、mmLDL组(尾静脉注射 mmLDL)、mmLDL+SB 203580组(尾静脉注射mmLDL及腹腔注射p38 MAPK通路抑制剂SB 203580)、LDL组(尾静脉注射 LDL)和 mmLDL+DMSO组(尾静脉注射mmLDL及腹腔注射DMSO)。NS组、mmLDL组和mmLDL+SB 203580组每组各40只;LDL组和mmLDL+DMSO组每组各10只。mmLDL 按照 1 mg/kg[3,19]的剂量连续 4 d 进行尾静脉注射,共8次,每隔12 h一次,于96 h采用眼球取血法采血后将小鼠颈椎脱臼处死。以相同方式给小鼠尾静脉注射NS作为正常对照组。为考察p38 MAPK炎症通路是否参与mmLDL对小鼠肠系膜动脉ET受体表达的影响,在每日第一次小鼠尾静脉注射mmLDL的前2 h,腹腔注射p38 MAPK抑制剂SB 203580溶液,剂量为25 mg/kg[20-21],每隔24 h一次;另设置溶剂对照组(mmLDL+DMSO组)。
5 主要方法
5.1 血管收缩功能检测 小鼠处死后,即刻取出其肠系膜动脉组织并浸入预冷至4℃的Na+-Krebs溶液(成分:无水CaCl21.5 mmol/L,NaCl 119 mmol/L,葡萄糖 5.5 mmol/L,KCl 4.6 mmol/L,NaH2PO41.2 mmol/L,NaHCO315 mmol/L,MgCl21.2 mmol/L)。在立体显微镜下将所需动脉周围组织快速剥离干净,为了去除血管内皮影响,使用0.1%的TritonX-100液灌注血管10 s,随后用Na+-Krebs溶液反复冲洗血管多次,再用20μmol/L 5-羟色胺刺激血管预收缩;最后加入10μmol/L乙酰胆碱进行检验,若所引起的舒张率<10%,则表明血管内皮去除完全。用显微手术剪将去内皮的肠系膜动脉剪成1.5~2 mm的血管环,每个血管环中穿入两根半径为20μm金属丝,浸入37℃DMT恒温浴槽中,金属丝两端分别与张力微调装置和换能器相连接。张力换能器与电脑PowerLab系统相连,记录血管张力变化。通过微调装置将血管环静息张力调整在1.5 mN左右,每隔15 min更换一次Na+-Krebs溶液,如此平衡1.5 h后2次使用K+-Krebs液(成分:KCl 63.5 mmol/L,无水CaCl21.5 mmol/L,NaCl 60 mmol/L,葡 萄 糖 5.5 mmol/L,NaH2PO41.2 mmol/L,NaHCO315 mmol/L,MgCl21.2 mmol/L)检查血管环活性,当2次测得K+-Krebs溶液所引起的血管环收缩张力均大于1 mN,并且两次收缩幅度差<10%即说明血管环合格,可继续后续实验。在浴槽中加入相应的试剂:S6c可以特异性激动ETB受体,引起ETB受体介导的血管收缩反应;现无ETA特异性激动剂,研究ETA受体介导的收缩时,先将1μmol/L的S6c诱导ETB受体产生最大收缩,保持S6c与浴槽内血管环接触1 h,收缩曲线逐渐下降,至基线水平,并保持稳定,即认为ETB受体完全脱敏[22-23],此时加入ET-1,将只激动 ETA受体。为了检查ETB受体是否完全脱敏,在使用S6c后,加入选择性ETB受体拮抗剂BQ-788(0.1μmol/L),再加入ET-1介导血管收缩反应,结果显示加入或不加入BQ-788,ET-1介导的血管收缩量效曲线几乎重叠,说明ETB受体完全脱敏[22-23]。
5.2 ELISA检测小鼠血清中oxLDL和IL-6的表达小鼠眼球取血后,室温自然凝固25 min,3 000 r/min离心20 min,收集上清液,于-80℃保存,如保存过程中出现沉淀,应再次离心。oxLDL和IL-6血清浓度采用小鼠ELISA试剂盒测定。严格按厂家说明书进行操作,于酶标仪上读取吸光度,绘制标准曲线,根据相应标准曲线计算样品中oxLDL和IL-6含量。
5.3 RT-qPCR检测小鼠肠系膜动脉组织的mRNA含量 提取肠系膜动脉组织的总mRNA并检测其密度。两步法逆转录合成cDNA。cDNA第1条链的合成采用20μL反应体系,转录程序为:25℃10 min,42℃ 60 min,65℃ 15 min。50μL qPCR体系的反应程序为:95℃ 5 min变性;94℃ 20 s,55℃ 20 s,72℃30 s,40个循环。反应结束后采用分离曲线分析法以确定PCR产物的特异性。mRNA定量分析采用PCR循环阈值(CT)比较法,以GAPDH为内参照,计算ETA受体、ETB受体和IL-6的mRNA相对表达量。特异性引物序列见表1。

表1 引物序列Table 1.Sequences of the primers for RT-qPCR
5.4 Western bolt法检测小鼠肠系膜动脉组织中的目的蛋白含量 每个样本由3根肠系膜动脉组成,取研磨筛至冰上,将预处理好的血管环段加入组织裂解液和蛋白酶抑制剂,于研磨筛上充分研磨后12 000 r/min离心30 min,仔细收集上清液,使用BCA蛋白分析试剂盒进行蛋白定量。加入1/4蛋白液体积的buffer(5×),100℃水浴10 min使蛋白变性;提取的蛋白用SDS-PAGE进行分离并转移到PVDF膜上,5%脱脂牛奶封闭,分别将I抗(抗ETA受体、ETB受体、p38 MAPK、p-p38 MAPK、NF-κB p65、p-NF-κBp65、IL-6和GAPDH抗体)均按1∶1 000稀释,4℃过夜,II抗为辣根过氧化物酶标记的山羊抗兔和山羊抗小鼠IgG(1∶5 000稀释)。图像经Image Gauge 4.0分析,并且均采用自身灰度值校正,以目的基因的条带灰度与管家基因的灰度比值表示蛋白的表达水平。
6 统计学处理
实验数据均以均数±标准误(mean±SEM)表示,血管环收缩曲线均通过累加激动剂获得,其收缩值以相对63.5 mmol/L K+预收缩的百分比表示。用Emax(最大收缩百分率)和pEC50(血管达最大收缩效应的50%时相应激动剂摩尔浓度的负对数)来描述血管收缩功能。采用Pearson线性相关分析评估IL-6血清水平与ETB受体和ETA受体介导的血管最大收缩功能之间的联系。Student'st检验用于两组数据之间的比较;单因素方差分析(one-way ANOVA)和Dunnett事后检验比较两组以上数据;双因素方差分析和Bonferroni事后检验用于比较2条曲线在相同浓度处产生的收缩值之间的差异。统计分析及作图使用Prism 5.0软件。以P<0.05为差异有统计学意义。
结 果
1 动脉内皮去除的验证及血管环对K+的收缩反应
经Triton X-100处理过的血管环由乙酰胆碱引起的舒张率<5%,表明实验血管内皮去除完全。mmLDL组、mmLDL+SB 203580组、mmLDL+DMSO组、NS组和LDL组实验血管环在K+-Krebs液刺激下均明显收缩,各组收缩张力分别为(4.33±0.38)mN、(4.00±0.28) mN、(4.01±0.27) mN、(4.41±0.34)mN和(4.14±0.31)mN(P>0.05)。
2 小鼠血清oxLDL水平
ELISA结果显示,mmLDL组和NS组血清中oxLDL 的 浓 度 分 别 为(116.95±2.853)μg/L 和(117.52±3.788)μg/L(P>0.05),排除oxLDL对实验结果的影响,见图1。

Figure 1.Serumlevels of oxLDL.Mean±SEM.n=8.图1 mmLDL组和NS组小鼠血清oxLDL浓度
3 SB 203580抑制mmLDL对小鼠肠系膜动脉ETB受体功能及表达的增强作用
DMT实验结果显示,mmLDL组S6c诱导ETB受体介导的收缩功能呈浓度依赖性增强,血管收缩量效曲线明显左移,Emax由NS组的(5.85±1.04)%升高为mmLDL组的(127.51±9.99)%(P<0.01),而pEC50(8.11±0.24和8.00±0.04)无显著差异(P>0.05);腹腔注射SB 203580后,S6c诱导的收缩血管的量效曲线右移明显,Emax[(37.42±4.96)%]较mmLDL组明显降低(P<0.01),pEC50(7.86±0.06)有所降低,但差异无统计学意义(P>0.05),见图2A。
RT-qPCR实验结果显示,mmLDL组ETB受体的mRNA水平较NS组的1.01±0.05上升为2.19±0.10(P<0.01);使用SB 203580后,ETB受体的mRNA水平降为1.29±0.08(P<0.01),见图 2B。Western bolt实验结果显示,mmLDL组ETB受体的蛋白水平从0.35±0.02 上升为 1.01±0.02(P<0.01);腹腔注射SB 203580后,ETB受体的蛋白水平降为0.55±0.01(P<0.01),见图2C。

Figure 2.The p38 MAPK inhibitor SB 203580 inhibited mmLDL-induced increases in ETB receptor function and expression in mouse mesenteric artery.A:inhibitory effect of SB 203580 on mmLDL-induced blood vessel contraction mediated by ETB receptor(n=8);B:inhibitory effect of SB 203580 on mmLDL-induced up-regulation of ETB receptor mRNA expression(n=6);C:inhibitory effect of SB 203580 on mmLDL-induced up-regulation of ETB receptor protein expression(n=4).Conc.:concentraion;M:mol/L.Mean±SEM.**P<0.01 vs NSgroup;##P<0.01 vs mmLDL group.图2 p38 MAPK抑制剂SB 203580拮抗mmLDL对小鼠肠系膜动脉ETB受体功能及表达的增强作用
4 SB 203580抑制mmLDL对小鼠肠系膜动脉ETA受体功能及表达的增强作用
DMT实验结果显示,mmLDL组ET-1诱导ETA受体介导的收缩功能呈浓度依赖性增强,血管收缩量效曲线明显左移,Emax由NS组的(145.12±9.55)%升高为mmLDL组的(232.31±22.79)%(P<0.01),而pEC50(8.29±0.07 和 8.20±0.02)无 显 著差 异(P>0.05);腹 腔 注射 SB 203580后,Emax[(160.34±8.30)%]较 mmLDL组明显降低(P<0.01),pEC50(8.20±0.06)无明显变化(P>0.05),见图3A。
RT-qPCR实验结果显示,mmLDL组ETA受体的mRNA水平由NS组的1.01±0.07上升为2.91±0.16(P<0.01);使用SB 203580后,ETA受体的mRNA水平降为1.55±0.05(P<0.01),见图3B。Western bolt实验结果显示,mmLDL组ETA受体的蛋白水平由NS组的0.24±0.04上升为0.94±0.03(P<0.01);腹腔注射SB 203580后,ETA受体的蛋白水平降为0.54±0.04(P<0.01),见图3C。
5 SB 203580抑制mmLDL引起的小鼠血清及肠系膜动脉IL-6水平升高
ELISA实验结果显示,mmLDL组血清的IL-6浓度从 NS组的(238.9±12.44)ng/L上升至(433.6±10.96)ng/L(P<0.01);使用SB 203580后,IL-6的血清浓度降为(330.2±12.15)ng/L(P<0.01),见图4A。
RT-PCR实验结果显示,mmLDL组IL-6的mRNA水平从 NS组的 1.02±0.08上升至 4.11±0.35(P<0.01);使用SB 203580后,IL-6的mRNA水平降为1.97±0.17(P<0.01),见图4B。Western blot实验结果显示,尾静脉注射mmLDL后IL-6的蛋白水平从NS组的 0.29±0.04上升至 0.97±0.08(P<0.01);使用SB 203580后,IL-6蛋白水平降为 0.48±0.03(P<0.01),见图4C。
Pearson相关分析结果显示,IL-6的血清浓度与ETB受体和ETA受体介导的血管收缩Emax值之间均存在正相关(r=0.87,P<0.05;r=0.97,P<0.01),见图4D、E。

Figure 3.The p38 MAPK inhibitor SB 203580 inhibited mmLDL-induced increases in ETA receptor function and expression in mouse mesenteric artery.A:inhibitory effect of SB 203580 on mmLDL-induced blood vessel contraction mediated by ETA receptor(n=8);B:inhibitory effect of SB 203580 on mmLDL-induced up-regulation of ETA receptor mRNA expression(n=6);C:inhibitory effect of SB 203580 on mmLDL-induced up-regulation of ETA receptor protein expression(n=4).Conc.:concentraion;M:mol/L.Mean±SEM.**P<0.01 vs NSgroup;##P<0.01 vs mmLDL group.图3 p38 MAPK抑制剂SB 203580拮抗mmLDL引起的小鼠肠系膜动脉ETA受体功能及表达增强
6 SB 203580对mmLDL诱导的小鼠肠系膜动脉中p-p38 MAPK和p-NF-κB蛋白水平的影响
Western blot实验结果显示,mmLDL组p-p38 MAPK和p-NF-κB的蛋白水平分别由NS组的0.12±0.02和 0.16±0.03上升为 0.57±0.06和 1.02±0.03(P<0.01);使用SB 203580后,p-p38 MAPK和p-NF-κB 的蛋白水平分别降为 0.32±0.04和 0.50±0.05(P<0.01),见图5。
讨 论
mmLDL作为重要的心血管疾病危险因子,在动脉粥样硬化初期起重要的作用,但其具体机制尚不明确。本课题组在体外研究中采用器官培养方法,发现mmLDL与大鼠冠状动脉共同培养,可以上调ETA受体和ETB受体[22,24],mmLDL 与大鼠脑基底动脉共同培养,可以上调ETB受体[25];小鼠在体实验发现mmLDL可以通过ERK1/2途径,增加TNF-α和IL-1β水平,增加小鼠肠系膜ETB受体和α1受体介导的血管收缩功能及表达[2-3];小鼠在体实验发现mmLDL可以通过PI3K/Akt途径,增加小鼠肠系膜ETB受体介导的血管收缩功能及表达[1]。本研究通过小鼠在体实验研究发现p38 MAPK炎症通路参与mmLDL诱导上调小鼠肠系膜动脉ETA受体和ETB受体,增加炎症因子IL-6血清浓度及血管壁的表达。
VSMCs内ETA受体和ETB受体的表达异常与心血管疾病的发生发展密切相关。ETA受体和ETB受体的上调可致血管收缩增强并减少血液流动,促进VSMCs的增殖和迁移,参与动脉粥样硬化过程并导致心血管相关疾病[13,26-28]。有研究表明,大鼠暴露于二手烟环境中,可激活ERK1/2途径,诱导增加脑基底动脉和冠状动脉ETA受体和ETB受体介导的血管收缩功能及表达[17,29],从而增加缺血性脑卒中、冠状动脉粥样硬化等疾病的风险。还有报道指出,通过体外器官培养,PM2.5可以增强大鼠支气管ET受体介导的收缩功能及表达,MEK1/2和p38通路参与ETB受体上调,JNK和p38通路参与ETA受体的上调,从而增加肺动脉高压等疾病风险[30]。本研究发现,通过小鼠尾静脉注射mmLDL,可以增强ETA受体和ETB受体介导的血管收缩功能,提高肠系膜动脉ETA受体和ETB受体的mRNA和蛋白表达。实验结果显示,mmLDL+DMSO组和mmLDL组血管收缩的量效曲线几乎重叠,排除了DMSO对本实验结果的影响;LDL组血管收缩的量效曲线虽略高于NS组,但两组间的差异无统计学显著性,排除了LDL对本实验结果的影响;使用K+-Krebs液考察血管的收缩功能,K+-Krebs液在mmLDL组、mmLDL+SB 203580组、mmLDL+DMSO组和NS组引起的血管收缩反应均大于1 mN,且各组间差异没有统计学显著性,排除了实验操作对血管收缩功能的影响。我们同时也检测血压,发现此时血压不受影响。
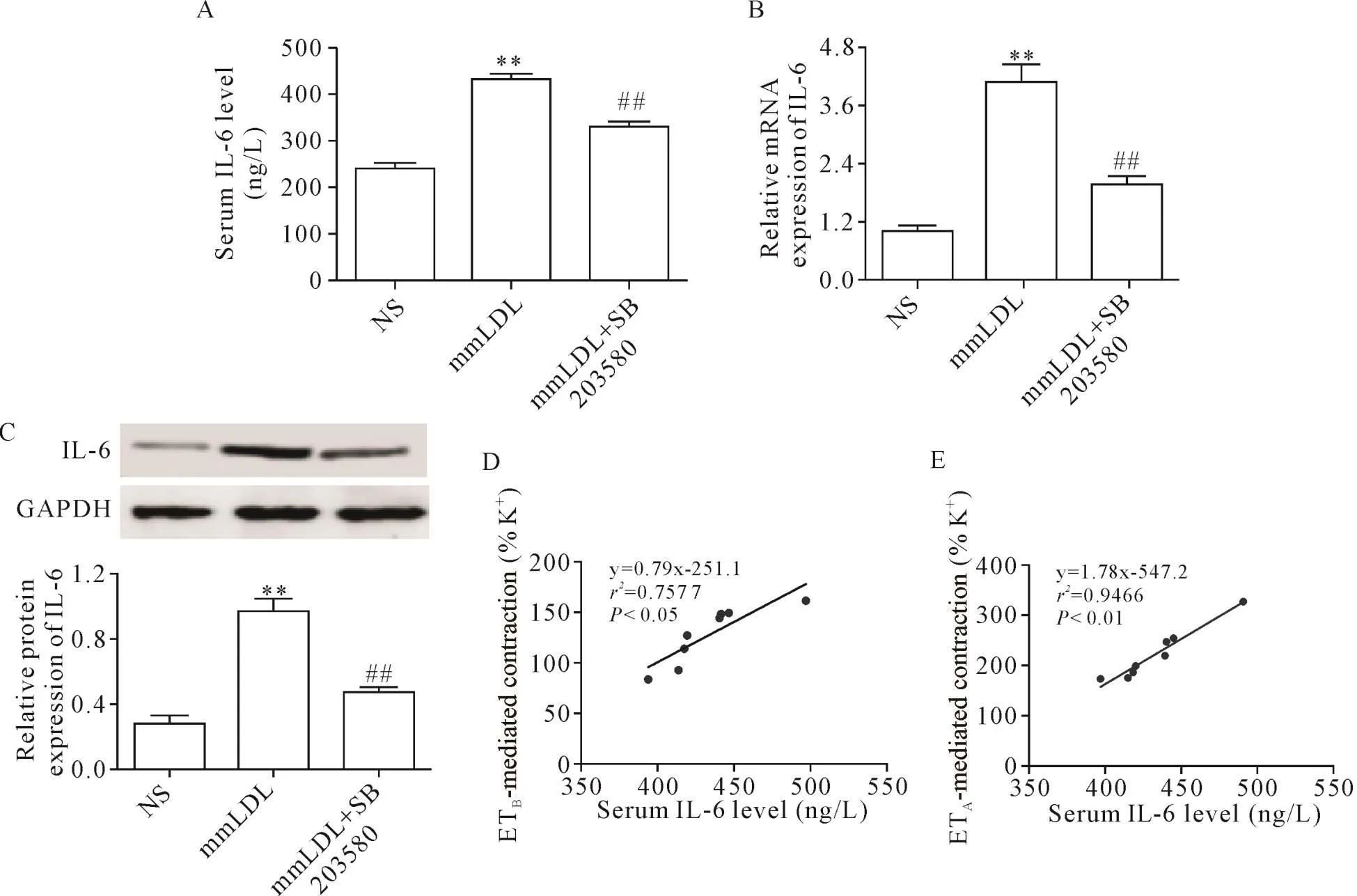
Figure 4.The p38 MAPK inhibitor SB 203580 inhibited mmLDL-induced increases in mouse serum and mesenteric artery IL-6 levels.A:inhibitory effect of SB 203580 on mmLDL-induced increase in serum IL-6 level(n=8);B:inhibitory effect of SB 203580 on mmLDL-induced up-regulation of IL-6 mRNA expression(n=6);C:inhibitory effect of SB 203580 on mmLDL-induced up-regulation of IL-6 protein expression(n=4);D:the positive linear correlation between the serum IL-6 level and the maximum S6c-induced contraction responses(n=8);E:the positive linear correlation between the serum IL-6 level and the maximum ET-1-induced contraction responses(n=8).Mean±SEM.**P<0.01 vs NS group;##P<0.01 vs mmLDL group.图4 p38 MAPK抑制剂SB 203580拮抗mmLDL诱导的小鼠血清及肠系膜动脉IL-6水平升高

Figure 5.The p38 MAPK inhibitor SB 203580 inhibited mmLDL-induced increases in p-p38 MAPK(A)and p-NF-κB(B)protein levels in mouse mesenteric artery.Mean±SEM.n=4.**P<0.01 vs NSgroup;##P<0.01 vs mmLDL group.图5 p38 MAPK抑制剂SB 203580拮抗mmLDL上调的小鼠肠系膜动脉中p-p38 MAPK和p-NF-κB的蛋白水平
SB 203580是p38 MAPK选择性抑制剂[14]。有研究表明,SB 203580可以预防I型糖尿病动物模型中的糖尿病心肌病,通过抑制p38 MAPK途径降低TNF-α、IL-1β和IL-6水平,减轻心肌炎症反应,改善心脏功能[7];SB 203580可以预防肺动脉高压的发展,通过抑制p38 MAPK途径降低关键炎症介质IL-6水平,逆转肺血管重构[5]。早期本课题组发现NF-κB信号转导途径参与了mmLDL诱导上调离体VSMCs ETB受体[24]。本研究通过给小鼠腹腔注射p38 MAPK通路选择性抑制剂SB 203580,抑制了mmLDL增加p-p38 MAPK和p-NF-κB蛋白水平,表现为p-p38 MAPK以及p-NF-κB蛋白条带灰度值较mmLDL组明显减弱;表明尾静脉注射mmLDL激活了p38 MAPK通路及下游NF-κB转录因子。
细胞炎症因子IL-6参与慢性炎症疾病病理生理过程,如肺动脉高压[5]、糖尿病[31]、动脉粥样硬化[32]。IL-6可分泌于白细胞、成纤维细胞、脂肪细胞、角质形成细胞和内皮细胞被感染的情况下,并可以被IL-1β或TNF-α等细胞因子诱导[9]。IL-6调节下丘脑-垂体-肾上腺轴,参与单核细胞趋化、血管生成和胶原积累,影响细胞增殖、分化、迁移和存活[33],加速动脉粥样硬化进程。在本研究中,我们发现尾静脉注射mmLDL明显增加IL-6的mRNA水平、蛋白水平和血清浓度。Pearson相关分析结果显示,血清IL-6水平升高与ETA受体和ETB受体介导的最大收缩百分率呈正相关,表明尾静脉注射mmLDL可诱导炎症反应,炎症反应可能参与了mmLDL上调ETA受体和ETB受体的过程。而SB 203580显著抑制了此作用,表明p38 MAPK通路参与mmLDL上调ETA受体、ETB受体和IL-6表达的过程。
综上所述,mmLDL激活p38 MAPK信号通路及下游的NF-κB转录因子,可以增加肠系膜动脉ETA受体和ETB受体表达,增强ETA受体和ETB受体介导的血管收缩功能,增加IL-6血清浓度及血管壁表达,并且血清IL-6水平升高与ETA受体和ETB受体介导的最大收缩百分率呈正相关。了解这一点,可为心血管疾病诊断及治疗提供新的靶点。

