上皮钠通道在相关呼吸系统疾病中的研究进展*
张 颖, 李 敏, 高力扬
(宁夏大学西部特色生物资源保护与利用教育部重点实验室,宁夏大学生命科学学院,宁夏银川750021)
上皮钠通道(epithelial sodium channel,ENaC)是一种非电压依赖性的离子通道,是上皮细胞主要的Na+转运通道之一,属于 ENaC/退化蛋白(degenerin)超家族[1-2]。ENaC对阿米洛利敏感,主要分布于人体肺部[3]、肾脏[4]、结肠、生殖道[5]及中枢神经系统[6]等多种组织的上皮细胞,能够控制Na+进入上皮细胞,对稳定细胞内Na+浓度及维持细胞渗透平衡具有重要作用[7]。
细胞内外液体渗透平衡是维持细胞正常生理功能的基础,这种平衡取决于细胞内外的相对渗透压和膜的渗透性[8],而人体细胞内液和细胞外液的渗透压主要取决于电解质如Na+、K+、Cl-及HCO3-等的浓度,其中Na+是细胞外液渗透压的主要决定因素[9],一旦Na+在细胞内外转运失衡,机体会出现一系列的病变。ENaC作为重要的Na+通道,其与各类疾病的相关性引起了人们的广泛关注。现有研究表明ENaC与心血管系统(如原发性高血压)[10-12]、呼吸系统(如囊性纤维化)[13-14]、泌尿系统(如假性低醛固酮症)[15-16]及生殖系统(如早产)[5,17]等相关多种疾病的发生发展具有重要联系。ENaC与呼吸系统相关疾病如囊性纤维化、哮喘及慢性阻塞性肺病等的关系尤为密切。本文从ENaC的结构和功能、在呼吸系统相关疾病发生发展中的作用机制及以ENaC为靶点的治疗药物和新方法等方面对近年来国内外的相关研究进行综述,旨在系统认识ENaC在呼吸系统疾病中的调控机制,从而为开发相关疾病的治疗药物及手段提供参考资料。
1 ENaC概述
1.1 ENaC种类及分布 ENaC是ENaC/degenerin超家族的成员之一[2],在肺鱼目(肺鱼)、四足类(青蛙和蟾蜍)等多个物种里均有表达[18],其中人ENaC有α、β、γ及δ共4种亚基,分别由SCNN1A、SCNN1B、SCNN1G及SCNN1D基因所编码[19]。ENaC的4种亚基都具有保守结构,这种保守结构有2个嵌入细胞膜的跨膜片段(transmembrane segments,TM),分别称为TM1和TM2[20]。各亚基的氨基(―NH2)和羧基(―COOH)末端位于细胞内,分别与TM1和TM2连接,胞外含有每个亚基大约70%氨基酸的片段[21](图1)。ENaC的α亚基具有多种亚型,是构成ENaC的功能性单位[21];β亚基是一类高度糖基化的蛋白,是构成ENaC的辅助单位[20];γ亚基的作用在于对ENaC的特定位点进行剪切,从而调节其活性[7]。大规模芯片和高通量RNA测序结果显示:α、β及γ亚基不仅在肾、肺和结肠有高水平的表达,在生殖道、食道、皮肤、甲状腺和舌头等部位也有不同程度的表达(详细表达图谱可在https://www.ebi.ac.uk/gxa/home获取)[22]。δ亚基在人脑、胰腺、睾丸和卵巢中的表达水平较高,而在肾脏和肺中的表达水平很低,其具体功能尚不明确,需要进一步的研究[18]。一个具有完整功能性的ENaC通道通常由α、β和γ亚基或者δ、β和γ亚基组成异源三聚体结构[23-24](除此之外也存在其它组合方式[25-26])。不同亚基聚集形成的通道呈现出不同的功能,例如:由α、β和γ亚基聚集形成的通道大量分布在肾脏、肺及结肠等部位,能够高效吸收转运Na+[27];而δ、β 和γ亚基组成的通道在神经组织有较多分布[18],其具体生理病理功能尚未被阐明。
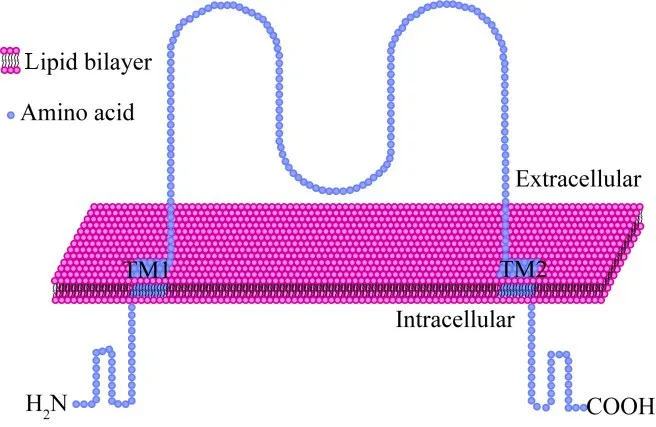
Figure 1.Schematic diagram of the transmembrane structure of the ENaCsubunit.图1 ENaC亚基跨膜结构示意图
1.2 ENaC的功能及调节机制 ENaC的基本功能是控制细胞内Na+浓度,维持细胞内外渗透压平衡。ENaC所在的组织部位不同,其发挥的生理作用不同。例如:远端肾单位处的ENaC能够调节细胞外液量和肾脏中K+的分泌[28];在女性生殖道中,ENaC在生殖周期调节子宫液的吸收[29-30];分布于血管内皮细胞中的ENaC可以参与血压的调节[12]。除此之外,ENaC对呼吸系统微环境的稳定具有极其重要的影响。肺部微环境中,肺泡薄液层的水盐平衡是维持肺部正常气体交换的先决条件[31]。如果未能及时吸收足够的盐和水会使得肺内液体从间质过度移动到肺泡腔,引起肺部水肿,从而引发一系列肺部疾病。目前,已报道的肺泡上皮细胞跨膜离子通道主要有ENaC、钠钾泵(Na+/K+ATPase)、水通道蛋白(aquaporins,AQPs)和囊性纤维化跨膜传导调节因子(cystic fibrosis transmembrane conductance regulator,CFTR)。其中,Na+通过 ENaC 顶端进入上皮细胞中[7],通过Na+/K+ATPase从基底外侧泵出肺泡上皮细胞[32],AQPs和CFTR主要调节细胞中H2O和Cl-的平衡[33-35]。肺泡上皮细胞水盐平衡调节的示意图如图2所示。作为重要的Na+转运通道,ENaC与Na+/K+ATPase等其它离子通道协同维持着肺部微环境的稳定。
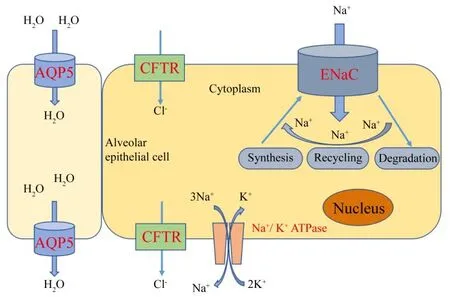
Figure 2.Schematic diagram of regulation of water-salt balance in alveolar epithelial cells.ENaC:epithelial sodium channel;AQP5:aquaporin 5;CFTR:cystic fibrosis transmembrane conductance regulator.图2 肺泡上皮细胞水盐平衡调节的示意图
ENaC的功能受诸多因素的影响,如ENaC蛋白磷酸化、泛素化或改变ENaC在细胞膜上的数量等都可以调控ENaC的钠转运效率。细胞内活性氧升高会使ENaC内化增加导致转运效率降低[36]。大量研究表明,呈革兰氏阳性的胞内菌单增李斯特菌可以通过增加PKC-α表达的方式抑制H441细胞中ENaC-α 的表达及功能[37]。促炎消退介质maresin 1可以通过增强ENaC和钠钾ATP酶活性的方式调节肺水清除,缓解LPS引起的急性肺损伤[38]。肺炎链球菌溶血素可以通过募集TNF来源的TIP肽来调控ENaC蛋白磷酸化状态,从而抑制肺水清除,最终导致严重的肺泡-毛细血管屏障功能损伤[39]。高碳酸血症会通过促进ENaC-β的磷酸化、多泛素化和ENaC蛋白内吞,影响ENaC在细胞表面的稳定性[40]。而且,ENaC亚基的胞外结构域可受多种调节因子调节,例如泛素蛋白连接酶 Nedd4L[41]、血清/糖皮质激素调节激酶1(serum/glucocorticoid regulated kinase 1,SGK1)[42]等。另有研究显示细胞可以通过内吞作用减少ENaC在细胞膜上的分布[43],从而降低其功能。综上所述,通常情况下ENaC的钠转运效率主要从以下水平进行调节:(1)调节ENaC亚基基因表达量;(2)通过信号转导系统从细胞信号方面对通道活性进行调控;(3)调节ENaC蛋白在细胞膜和细胞质中的分布。这些调控方式涉及通道蛋白的合成、运输、插入细胞质膜、降解等过程[44]。
2 ENaC与相关呼吸系统疾病
2.1 囊性纤维化(cystic fibrosis,CF) CF是一种常见的肺部疾病,由CFTR突变引起[45],其症状为气道表面液体(airway surface liquid,ASL)脱水,黏液在气道中积聚,成为病原菌反复感染的场所以及产生长期的呼吸道炎症[45]。有研究显示在小鼠体内过表达ENaC,小鼠气道上皮会加速ASL脱水,导致黏液清除功能受损[46],而抑制CF肺病模型中ENaC的活性可恢复ASL的水合作用并增强黏膜纤毛转运速率,缓解CF症状[47]。
ENaC可以被泛素连接酶Nedd4L泛素化并被快速内化和降解[41]。Butterworth等[48]研究表明,抑制去泛素化酶(deubiquitinases,DUBs)会减少细胞表面的ENaC。Kimura等[41]发现敲除 Nedd4L后的小鼠,其肺上皮中的ENaC蛋白水平升高,且该小鼠肺部表现出CF的特征,以上结果提示CF发病机制与ENaC蛋白表达量有重要联系。有研究证明cAMP/PKA复合物可以通过Nedd4L来调节ENaC[49],而CFTR会影响ENaC对cAMP/PKA的敏感性,CFTR存在时cAMP/PKA抑制ENaC,CFTR不存在时激活ENaC[50-51]。短腭肺鼻上皮克隆 1(short palate lung and nasal epithelial clone 1,SPLUNC1)是一种约25 kD的分泌蛋白,可在细胞外与ENaC结合抑制ENaC活性防止ASL脱水[52],当SPLUNC1表达降低时,CF患者病情加重[53]。此外,ENaC通过改变离子稳态在驱动CF炎症过程中也发挥着作用。Scambler等[54]检测到具有CF突变的人支气管上皮细胞和单核细胞中NLRP3依赖性IL-1β或IL-18分泌增加,进一步研究显示ENaC介导的Na+转运失调会改变Na+/K+浓度梯度,从而增强K+外排和下游NLRP3炎性体激活,并且ENaC的β亚基在细胞中的过度表达增加了NLRP3依赖性的IL-18分泌,使用ENaC抑制剂处理CF突变细胞后抑制了CF中的炎症因子的表达,所有结果提示了存在ENaC影响CF炎症的特定ENaCNLRP3信号轴。
基于ENaC在CF中的重要作用,已有大量研究将ENaC作为治疗CF的靶标。通过使用反义寡核苷酸(antisense oligonucleotide,ASO)[55]、靶向 siRNA[56]及其它干扰ENaC亚基基因表达或ENaC活性的分子[32],均可显著缓解CF的症状,这也从另一方面显示出ENaC在CF发病机制中的重要性。除此之外,还可通过增强Nedd4L活性、开发SPLUNC1分子模拟物等方法为治疗囊性纤维化提供新方向。
2.2 哮喘(asthma) 哮喘是一种慢性炎症性气道疾病,通常由于气道受过敏原、感染等异质性刺激引起。常出现气道阻塞、黏液分泌过多及气道高反应性(airway hyperresponsiveness,AHR)等症状[57]。哮喘患者病情加重时,上皮细胞黏液分泌增多会导致气道堵塞,严重时甚至危及生命[58-59]。位于气道上皮的ENaC可以通过向细胞内转运Na+来调节细胞内外的相对渗透压,创造一个渗透梯度以促进气道液体的吸收[60]。Mall等[46]观察到,在转基因过表达ENaC的小鼠体内会出现ASL脱水,黏液清除功能受损的现象,并且还伴随气道阻塞和炎症[61]等症状。Anagnostopoulou等[62]研究表明,过敏性炎症会抑制ENaC介导的Na+转运,降低上皮细胞对气道液体的吸收。ENaC的亚细胞定位结果显示其定位于气道上皮细胞的纤毛上,在维持纤毛的清除功能方面具有重要作用[63-64]。Fritzsching等[65]以黏液纤毛清除受损的ENaC-β转基因(Scnn1b-Tg)小鼠为动物模型,使用过敏原处理小鼠,结果发现Scnn1b-Tg幼鼠呼吸道对过敏原的清除能力显著降低,气道嗜酸性粒细胞增多,并且小鼠气道上皮细胞、巨噬细胞、2型先天淋巴样细胞和Th2细胞中IL-13表达水平升高,AHR增强。AHR会导致患者反复出现呼吸短促、咳嗽和喘息症状。这说明ENaC在维持黏液纤毛清除功能及在哮喘的发病机制中扮演了重要角色。由此可见,在哮喘的发病机制中ENaC能够影响气道上皮对ASL的分泌和吸收,能够维持上皮纤毛对过敏原的清除功能,具有成为治疗哮喘靶标的潜在意义。
2.3 急性肺损伤(acute lung injury,ALI)/急性呼吸窘 迫 综 合 征(acute respiratory distress syndrome,ARDS) ALI/ARDS是指由非心源性原因导致肺毛细血管内皮和肺泡上皮损伤,血管通透性增加的临床综合征,表现为急性进行性加重的呼吸困难、低氧血症及肺水肿,早期为ALI,发展严重时即为ARDS[66]。目前已有多项研究表明 ENaC与 ALI/ARDS的发病过程密切相关,且ENaC被认为是限制肺水肿期间肺泡液清除率(alveolar fluid clearance,AFC)的关键因素。SGK1可促进ENaC的α、β和γ亚基表达,对减轻肺水肿具有重要意义。有研究证明,罗格列酮可以通过PPARγ/SGK1依赖性信号通路降低支气管肺泡灌洗液中的TNF-α和IL-1β的水平,促进ALI模型小鼠中ENaC的表达并增强AFC,显著减轻肺水肿的症状[42]。Zhu等[67]研究发现胰岛素可以通过促进ALI模型大鼠中SGK1磷酸化,激活并上调ENaC的表达,进一步的研究发现胰岛素是通过PI3K/SGK1 途 径[68]和 mTORC2/SGK1[69]途 径 上 调ENaC表达从而改善肺水肿症状。随后,Deng等[70]观察到胰岛素还可以通过抑制Nedd4L,增加依赖于PI3K/Akt途径的ENaC表达,减轻肺水肿并增强AFC。而 Qi等[71]实验结果显示,17β-雌二醇通过PI3K/Akt/SGK1信号传导途径升高ENaC-α表达和抑制炎症,在一定程度上缓解肺水肿。这说明SGK1有望成为改善ENaC功能的间接靶点。此外,在急性肺损伤期间产生的缺氧症状及过度分泌的炎症因子如TNF-α、IL-1β等会抑制ENaC的离子转运效率从而加重ALI/ARDS的症状[72]。
2.4 慢性阻塞性肺病(chronic obstructive pulmonary disease,COPD) COPD是气道长期受刺激物如香烟烟雾[73]等刺激,出现上皮细胞损伤,肺毛细血管破坏,上皮细胞加速衰老,气道重塑等现象并最终导致肺功能丧失的疾病[74],气道黏液阻塞和持续的炎症是该病的重要特征[75-76]。在COPD患者气道中,ENaC异常导致气道表面脱水,ASL量减少,并损害黏液淤积和清除。李雯等[77]探究了ENaC在COPD发病机理中的作用,通过检测从患者体内分离的支气管上皮细胞,发现COPD患者上皮细胞中α和γ亚基显著升高,表明ENaC可能在COPD的发病中起关键作用。Rab等[13]将成年SCNN1B敲除小鼠和野生型同窝幼仔长期暴露于香烟烟雾中,显示SCNN1B敲除小鼠肺中黏液过度分泌,产生了COPD的症状,进一步证实了ENaC与COPD肺病的相关性,但ENaC在COPD发生过程中所发挥的具体作用仍在探究中。
2.5 ENaC与其它呼吸系统疾病 除上述疾病外,还有研究显示ENaC与支气管扩张症和慢性支气管炎相关。支气管扩张症是指由慢性支气管炎症或感染引起的气道永久性扩张,Fajac等[78]分析了55例特发性支气管扩患者的基因,结果表明ENaC-β和ENaC-γ基因的变异可能是导致支气管扩张的主要原因。Astrand等[79]显示ENaC可以促进慢性支气管炎患者气道的黏液水合作用及转运。已有研究证明ENaC在癌细胞的迁移、增殖和凋亡等生物学过程中发挥效应[80]。另外,关于ENaC在肺部癌症的相关研究也逐渐成为了近年来研究的热点。He等[81]通过对一系列肺癌细胞株进行了全基因组RNA测序和染色质免疫沉淀测序分析,发现编码ENaC-α亚基的基因SCNN1A与小细胞肺癌(small-cell lung cancer,SCLC)发生过程中的重要转录因子ASCL1(achaetescute complex-like 1)表达高度相关。体外研究证明,阿米洛利能显著抑制ASCL1依赖性SCLC的生长,因此得出结论SCNN1A(ENaC-α)基因是神经内分泌肺癌谱系癌基因ASCL1的直接转录靶标,可以将其作为这种癌症的候选靶标[81]。
3 ENaC在相关呼吸系统疾病治疗中的应用
综上所述,ENaC与多种呼吸系统疾病的发生发展具有密切联系,有充足的研究证明其是治疗相关呼吸系统疾病的优选靶点。近年来以其作为直接或间接靶点,开发相关疾病的治疗药物和方法的研究也日益增多。目前为止的研究主要集中在两方面,一是开发调节ENaC的药物和新型分子。这些药物或分子可以直接靶向作用于ENaC或通过相应的信号途径间接调控ENaC的表达和活性,如临床药物特布他林通过cAMP、PKA等途径激活ENaC的表达[82],对支气管哮喘、COPD等疾病的缓解及治愈有重要意义。SPX-101是一种新型的ENaC靶向药物,它是一种吸入性治疗性多肽,可抵抗蛋白水解降解,并在低pH下稳定,通过促进通道内化来降低ENaC活性,从而达到治疗CF疾病的作用[43]。另一方面是通过siRNA[56]或ASO[47]靶向作用于ENaC 各亚基的编码基因,直接干扰ENaC的表达进而缓解病症,然而这些新的药物或分子的治疗效果和副作用等则需要进一步的临床研究来证明。
4 展望
本文总结了近年来国内外ENaC在相关呼吸系统疾病中作用的研究进展,并对ENaC在相关疾病中治疗的应用进行了小结,但这些治疗药物或治疗方法仍需要进一步的临床验证。离子通道是细胞间相互通讯和传送信号的基本途径之一。随着国内外对ENaC广泛深入的研究,人们对ENaC在各种疾病中的作用也有了更加深刻的认识,以ENaC为靶点治疗各种相关疾病的思路也越来越受关注。但是ENaC在这些疾病和生理活动的调控机制尚未完全阐明,如ENaC中δ亚基的功能尚未得到确切阐释。因此进一步探索ENaC的生物学功能,将为相关疾病的治疗和药物的开发开辟新的方向。

