AMPK通过抑制NLRP3炎症小体参与延缓衰老过程*
尚画雨, 沈文清, 马穰桂, 夏 志
(1成都体育学院运动医学与健康学院,四川成都610041;2华东师范大学体育与健康学院,上海200241;3井冈山大学体育学院,江西吉安343009)
衰老是在细胞、组织和器官水平上发生的生理性内稳态的渐进性损害过程。就代谢角度而言,该过程主要表现为体成分、胰岛素抵抗、自噬功能障碍、线粒体和炎症反应的变化,其中涉及生长激素、胰岛素/胰岛素样生长因子1及各种能量感应系统如AMP活化蛋白激酶(AMP-activated protein kinase,AMPK)、沉默信息调节因子(silent information regulators,SIRTs)等多条信号通路的变化[1]。而从临床角度来看,诸如代谢紊乱、心血管疾病和神经退行性疾病等众多疾病的发生发展亦与衰老密切相关。目前,学界普遍认为呈时间依赖性的细胞损伤是机体衰老的主要原因。但近期研究表明,采取改变能量感应系统和炎症水平的策略可促进长寿和延长健康寿命,提示通过调控机体能量感应与炎症水平可能具有延缓机体衰老的重要潜力[1]。本文拟就近年来能量开关AMPK与核苷酸结合寡聚化结构域样受体蛋白 3(nucleotide-binding oligomerization domain-like receptor protein 3,NLRP3)炎症小体的相关进展进行梳理,探析其在衰老进程中的调控作用,并归纳其与线粒体、内质网应激(endoplasmic reticulum stress,ERS)、自噬和SIRT1等常见代谢途径的互作关系,为从能量感应和炎症水平调控角度探寻延缓衰老和防治衰老相关疾病的临床干预手段提供有益参考。
1 AMPK在衰老过程中的作用
大量研究结果表明,信号分子AMPK的活化与衰老过程中对代谢变化的反应能力下降有关[1],其直接参与多种衰老相关疾病的发生发展,如心肌缺血、心肌肥大和心力衰竭等心脏疾病[2],以及阿尔茨海默病(Alzheimer disease,AD)、帕金森病(Parkinson disease,PD)和肌萎缩侧索硬化症等神经退行性疾病[3]。此外,亦与代谢综合征和糖尿病(diabetes mellitue,DM)等一系列增龄性代谢紊乱疾病有关[4]。
近期研究发现,AMPK可抑制核因子κB(nuclear factor-κB,NF-κB)途径的激活,由于NF-κB作为先天免疫和炎症反应的关键调节因子可协同其下游NLRP3炎症小体参与AD进程[5],从而提示AMPK还参与了炎症反应的调控。Zhou等[6]研究证实,软骨细胞特异性AMPKα1或AMPKα2敲除小鼠和AMPKα1/α2双敲除小鼠均呈现出更为严重的与自发增龄性/手术诱导近似的骨关节炎,同时其白细胞介素1β(interleukin-1β,IL-1β)水平显著升高,提示了AMPK在增龄性骨关节炎中的重要作用。此外,小鼠骨骼肌特异性AMPK敲除亦被证实可诱发肌肉功能减退的肌病[7],且AMPKα2敲除小鼠可呈现出皮肤[8]及细胞[9]的老化加速,同时增龄性的心功能不全症状更为显著[10]。以上研究结果表明,AMPK在骨和骨骼肌的增龄性变化以及心脏和皮肤增龄性损伤中均发挥了重要作用。然而,其具体作用机制仍不明确。最近Jiang等[11]报道指出,青蒿素可能通过诱导AMPK/NF-κB/NLRP3途径明显抑制巨噬细胞内炎症反应,从而有效改善主动脉粥样硬化。需要指出的是,由于炎症反应在上述所有病理过程中均发挥关键作用,因此深入研究AMPK在炎症中的调控机制对于延缓衰老进程、防治衰老相关疾病可能具有重要意义。
2 NLRP3炎症小体在衰老过程中的作用
NLRP3炎症小体包含一个富含亮氨酸重复序列(leucine-rich repeat,LRR)结构域、一个中心核苷酸结合寡聚化结构域(nucleotide-binding oligomerization domain,NOD)和一个氨基末端热蛋白结构域(pyrin domain,PYD),主要与含有胱天蛋白酶募集域(caspase recruitment domain,CARD)的凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a CARD,ASC)相互作用[12]。作为一类多蛋白复合物,在暴露于致病微生物和宿主危险信号后,胞质内一些模式识别受体(pattern recognition receptors,PRRs)充当病原体相关分子模式(pathogen-associated molecular patterns,PAMPs)和损伤相关分子模式(damage-associated molecular patterns,DAMPs)的传感器,可通过激活胱天蛋白酶1(caspase-1)导致IL-1β和IL-18的成熟和释放,进而形成炎症小体[12]。其中,PAMPs和DAMPs可通过降低细胞内K+浓度、介导线粒体损伤促使活性氧(reactive oxygen species,ROS)生成或溶酶体组织蛋白酶B(cathepsin B)的胞浆释放,最终诱导NLRP3炎症复合物激活[12],见图1。研究表明,上述刺激条件可随衰老而明显升高并激活NLRP3炎症小体,进而参与衰老性疾病的炎症进程[13],因此被认为是该进程中介导无菌性炎症的关键驱动因素[14]。
最近,人们开始关注NLRP3炎症小体在衰老过程中的作用。Stout-Delgado等[15]研究发现,野生型老年小鼠呈现NLRP3高表达的肺纤维化,而NLRP3敲除使其更能抵抗由肺泡巨噬细胞介导的实验性和自然增龄性纤维化。McBride等[16]指出,NLRP3缺失小鼠的健康寿命得以延长,多种增龄性退行性改变被弱化,不仅呈现出相对肌肉力量和耐力增加,其肌病纤维数量的增龄性上调现象亦得到抑制。此外,增龄性游离胆固醇(free cholesterol,FC)和神经酰胺水平的升高已被证明会导致小鼠胸腺内免疫监控下降而激活NLRP3炎症复合物,而将NLRP3和ASC基因敲除后,其增龄性的胸腺萎缩症状明显减轻,同时皮质胸腺上皮细胞和T细胞祖细胞的数量均有所增加[17]。另有报道指出,老龄小鼠体内肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)水平明显升高可进一步诱发NLRP3炎症小体活化[18]。虽然NLRP3炎症小体在 AD[19]、动脉粥样硬化[11]和 DM[20]等多种衰老相关疾病中均见表达上调,但目前尚不清楚衰老过程中NLRP3炎症小体的激活究竟是增龄性疾病的诱因还是继发性应答,尚有待后续研究予以阐明。此外,衰老过程中调控NLRP3炎症复合物的分子机制仍不明确,厘清其调控因素可能为控制炎症提供有益靶标,并有助于进一步延长健康寿命。目前,关于NLRP3炎症小体依赖性过程(如线粒体、ERS、自噬和SIRT1)的各种功能研究均认为,AMPK是NLRP3炎症复合物的重要调控因子。
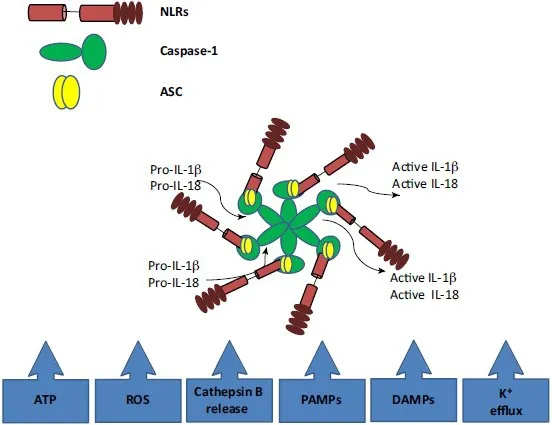
Figure 1.Composition and activation of NLRP3 inflammasome[12].图1 NLRP3炎症小体的组成和激活[12]
3 AMPK对NLRP3炎症小体的调节作用
3.1 线粒体 作为调节线粒体内稳态、生物合成和降解的主要步骤,当线粒体出现功能障碍时,AMPK途径活化以避免能量感应不足[21],介导下游过氧化物酶体增殖物激活受体γ辅激活因子1α(peroxisome proliferator-activated receptorγ coactivator-1α,PGC-1α)和 核 呼 吸 因 子 1(nuclear respiratory factor-1,NRF1)表达,触发线粒体生物合成。线粒体是多条途径激活NLRP3炎症小体的共同介质,其中ROS作为氧化型线粒体DNA(mitochondrial DNA,mtDNA)的近端信号而激活NLRP3炎症复合物[22]。Garrido-Maraver等[23]研究发现,AMPK可通过上调锰超氧化物岐化酶和过氧化氢酶的表达,参与细胞防御以对抗线粒体ROS介导的氧化应激。抗氧化剂γ-生育酚亦被证实可在AMPK活化的条件下抑制NLRP3炎性小体激活从而延缓DM进程[24]。
此外,氧化应激和线粒体功能受损伴低度炎症状态对衰老的影响亦已得到研究证实[1],因此由衰老诱发的线粒体功能障碍与NLRP3炎症小体之间可能存在关联。Wu等[25]指出,线粒体靶点抗氧化肽SS-31可有效改善衰老小鼠体内NLRP3炎症小体介导的认知缺陷。鉴于具有诱导AMPK活化潜能的抗氧化剂可抑制NLRP3复合物激活,受AMPK调节的内源性抗氧化生物合成可能是抑制增龄性线粒体ROS(mitochondrial ROS,mtROS)的保护性靶点。不少报道指出,内源性抗氧化剂褪黑素(melatonin,MT)能有效下调衰老小鼠体内的氧化应激和NLRP3炎症小体表达,提示其可能通过抑炎效应而在促进健康方面发挥重要作用[26],但MT抑制NLRP3炎症复合物的具体分子机制尚不明确。Wang等[27]还发现,MT以保护性的方式诱导老年小鼠体内AMPK活化,同时抑制还原型烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)氧化酶催化亚基gp91phox过表达,有效改善脂多糖诱导的血脑屏障功能障碍,其作用效果与二甲双胍(metformin,Met)干预相同。虽然AMPK活化可通过上述多种机制抑制NLRP3炎症小体活化,但MT抑制gp91可能与gp91参与衰老过程中NLRP3复合物激活有关,仍有待进一步研究验证。
3.2 ERS ER作为蛋白质合成和折叠的主要场所,在多个分子伴侣、折叠酶和辅酶因子的活性作用下调节新蛋白质的折叠和降解,因而被视为是蛋白质动态网络的一个关键组成部分[1]。在衰老过程中,随着蛋白质动态网络的缓冲能力下降,细胞内错误折叠的蛋白质组成聚集体逐渐积累,最终导致组织细胞功能下降并诱发细胞凋亡[28]。ERS反应也称为未折叠蛋白反应(unfolded protein response,UPR),其作为一种协调适应性反应,限制ER内未折叠蛋白质的积累,并通过调节不同UPR靶基因以抵御体内多种增龄性改变[28]。
研究表明,ERS能激活NLRP3炎症小体,但AMPK活化会通过抑制蛋白质的翻译而减弱ERS[28]。因此,白藜芦醇(resveratrol,Res)、Met、AICAR和水杨酸盐等AMPK激活剂可通过抑制ERS而阻止NLRP3 炎症小体激活[29-30]。近期研究在 DM[29]和内皮功能障碍[30]两个增龄性病理过程以及自然衰老大鼠[28]中进一步发现,使用AMPK激活剂能明显削弱ERS,从而有效抑制NLRP3炎症复合物活化,且施加AMPK抑制剂可诱发相反的表型变化[31]。以上研究结果提示,通过AMPK活化抑制ERS,进而负性调节NLRP3炎症小体,对于延缓衰老以及防治衰老相关疾病可能具有重要意义。
3.3 自噬 自噬作为一种溶酶体降解途径,可将功能失调的胞质原件清除并再循环,从而维持细胞能量和氨基酸稳态[32]。在衰老过程中,自噬水平明显下调,受损蛋白质和细胞器(如线粒体)的累积可导致诸多生理过程发生增龄性改变。研究表明,自噬相关基因 5(autophagy-related gene 5,ATG5)过表达小鼠与正常小鼠相比,其寿命增加约17%,且呈现胰岛素敏感性、肌力和氧化还原稳态有效改善[33]。此外,诱导自噬激活亦为衰老过程中维持心脏功能和活力的关键因素[10],而自噬缺失则会进一步加重绝经性骨质疏松症[34],提示上调机体自噬水平可在一定程度上延长寿命和延缓衰老。此外,自噬在调节炎症细胞活化、清除炎症细胞激活的内源性信号、隔离和降解炎症细胞组分等方面也发挥着重要作用。Liu等[35]报道指出,通过激活AMPK/Unc-51样激酶1(Unc-51-like kinase 1,ULK1)/p62信号通路诱导线粒体自噬,能有效阻止线粒体膜电位丢失以抑制NLRP3炎症小体活化,见图2。反之,自噬流量标志物p62特异性敲除将导致受损线粒体积聚和IL-1β介导的炎症反应过度发生,而p62的延时复表达则可引发NF-κB抗炎效应,诱导NLRP3炎症小体失活[36]。亦有学者证实,自噬流量的阻断会诱导NLRP3炎症复合物激活[37]。由此可见,自噬诱导机制在负性调节NLRP3炎症小体方面可能具有重要潜力。
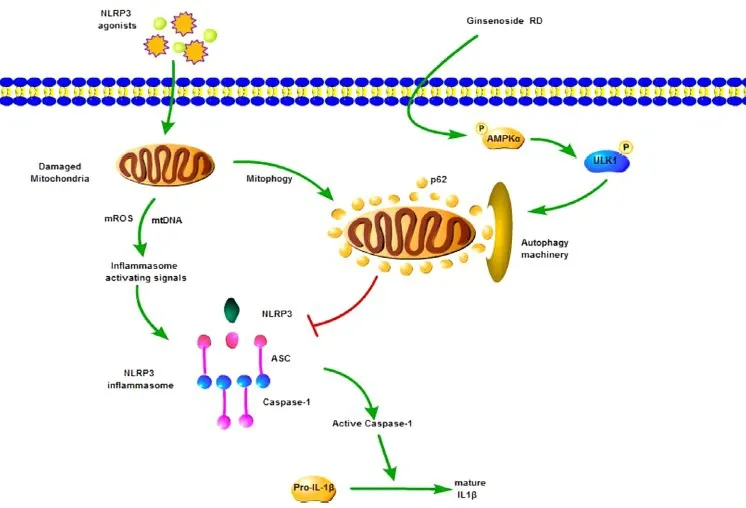
Figure 2.Activation of AMPK/ULK1/p62 signaling pathway and inhibition of NLRP3 inflammasome activation by activating autophagy-induced decreased mtROSand mtDNA release to cytoplasm[35].图2 AMPK/ULK 1/p62自噬通路激活下调mtROS、mtDNA释放入胞质而抑制NLRP3炎症小体的活化[35]
近期报道指出,富含刺激醛的特级初榨橄榄油可通过激活AMPK/ULK1途径诱导自噬以抑制NLRP3炎症小体激活,有效改善AD小鼠血脑屏障功能,并减轻AD相关的病理损伤[38]。Ko等[39]施加雷帕霉素(rapamycin,RAPA)诱导自噬水平升高,进而清除mtROS,从而抑制IL-1β、IL-18释放和caspase-1激活,且Res、京尼平和抗抑郁药物等化合物亦可通过诱导自噬对NLRP3炎症小体发挥负性调节作用[40-42]。有趣的是,上述自噬诱导化合物均被证实能够诱导AMPK磷酸化并参与衰老进程。例如,RAPA可通过诱导自噬和抑制哺乳动物RAPA靶蛋白(mammalian target of RAPA,mTOR)表达以延缓衰老和延长寿命[43]。据此推测,RAPA对NLRP3炎症小体的抑制作用可能与该药物明显改善机体代谢能力有关。此外,Res与长寿和健康寿命亦有关联[44]。Wu等[45]近期发现,Res通过上调AMPK诱导线粒体自噬发生,有效减轻腹膜间皮细胞内ROS-NLRP3介导的炎性损伤。然而,其抗衰老作用是否与NLRP3复合物抑制有关则有待后续研究进一步探明。
3.4 SIRT1 SIRTs是一组(SIRT1至SIRT7)高度保守的脱乙酰酶,其活性依赖烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)。其中,核蛋白SIRT1构象与原核生物体内长寿基因Sir2的表达产物最为相似,且与AMPK具有许多相似的作用,包括二者对应激和营养状态的响应、诱导线粒体生物合成、调节糖稳态以及控制重要转录调控因子(如PGC-1α、FOXOs和乙酰基转移酶p300等)活性的能力[21]。此外,Res和热量限制对促进健康的积极作用也被认为与激活 SIRT1和AMPK有关[21,46]。研究发现,AMPK依赖细胞内NAD+水平升高而激活SIRT1,反之SIRT1则介导AMPK激酶人类肝激酶1(liver kinase B1,LKB1)去乙酰化,促使AMPK的磷酸化激活[46],以上结果提示二者存在互作关系。进一步针对AMPK激活剂Res的研究结果表明,其增强线粒体功能的机理在于SIRT1与AMPK之间具有一个正反馈回路,从而可将这两个低能量状态传感器连接而产生统一响应[46]。
此外,败血症小鼠在施加SIRT1高选择性抑制剂 EX527[47]或SIRT1基因敲除[48]后,其体内活化的IL-1β水平明显升高。在内皮细胞中,SIRT1敲除可诱导NLRP3炎症小体激活,SIRT1复表达则抑制后者活性[49]。以上研究结果表明,SIRT1对NLRP3炎症复合物具有负性调节作用,但其分子机制目前仍不明确,且在衰老及其相关疾病中的炎性效应尚未见文献报道。Li等[50]最近的研究指出,CD40可能在内皮细胞内参与了SIRT1对NLRP3炎症小体的负性调节过程。鉴于SIRT1在衰老中的角色以及对NLRP3炎症复合物的负性调节作用,研究SIRT1特异性激活剂(SRT1720或SRT2104)或抑制剂(EX527)对衰老过程中NLRP3炎症小体的影响可能将颇具意义。综上所述,我们将衰老过程中AMPK对NLRP3炎症小体的调节作用归纳于图3。

Figure 3.The regulatory effect of AMPK on NLRP3 inflammasome during aging.图3 衰老过程中AMPK对NLRP3炎症小体的调节作用
4 小结与展望
AMPK可通过线粒体内稳态、ERS、自噬和SIRT1激活等多条途径调控NLRP3炎症复合物,在延缓衰老方面可能具有重要潜力。衰老进程中的常见分子事件如线粒体功能障碍和ROS生成或mtDNA氧化、自噬缺陷、溶酶体通透性改变和各种代谢产物(如FC、葡萄糖)的累积等均可激活或抑制NLRP3炎症小体,而后者与DM、动脉粥样硬化、心血管和神经退行性疾病等衰老性疾病密切相关。因此,抑制NLRP3炎症小体的特定化合物可作为新的抗衰老药物继续深入研究。在未来的相关研究中,还应考虑在体内或体外不同应激状态下,或在NLRP3突变模型中,深入研究NLRP3与其它炎症复合物以及调节因子的相互作用,以期探明NLRP3炎症小体在各种抗衰老策略改善AMPK/SIRT1和自噬流量、减少应激和抑制炎症等过程中的不同作用究竟如何整合至协调反应之中。此外,其它炎症复合物是否参与衰老进程?AMPK能否调节这些复合物?均亟待明确。尽管上述分子机制尚有待未来研究进一步阐明,但NLRP3炎症小体这一特殊的炎症复合物很可能成为药物和/或运动干预衰老以及衰老相关疾病进程的共同靶点。

