草乌甲素对LPS诱导的RAW264.7细胞抗炎作用及相关机制研究
孙 甜 吕业超 唐小牛 湛孝东 姜玉新
1.皖南医学院医学寄生虫学教研室,安徽 芜湖 241002; 2.嘉兴学院医学院病原生物学与免疫学教研室,浙江 嘉兴 314001
过敏性哮喘是常见的由多种细胞及细胞组分参与的气道慢性炎症性疾病,全球多达3亿人受到影响,发病率逐年上升且临床治疗效果不佳[1]。其主要特征是血清IgE和细胞因子水平升高、气道嗜酸性粒细胞增多、粘液积聚、气道高反应性及可逆的气道重塑[2-3]。肺泡巨噬细胞作为肺部微环境中数量最多的炎症细胞参与病原体的识别、摄取和杀伤,在机体炎症反应的启动和调节以及适应性免疫中起着重要作用[4-5]。脂多糖(Lipopolysaccharide, LPS)是革兰氏阴性细菌外膜的主要成分。研究表明,LPS可以刺激巨噬细胞中炎性介质及炎性细胞因子(如NO、TNF-α和IL-6、IL-1β)的分泌,从而导致肺损伤和气道重塑加剧,加重炎症反应[7]。因此,LPS刺激巨噬细胞被广泛应用于研究过敏性哮喘等炎症性疾病。
草乌甲素(Bulleyaconitine A,BLA)是一种从乌头属植物中分离的二萜类生物碱,据报道具有抗炎、镇痛及免疫调节等生物学活性[8-9]。我们前期研究结果表明草乌甲素可缓解过敏性哮喘小鼠的气道炎症反应,但其具体的分子机理尚不十分清楚。鉴于此,本研究拟以LPS刺激小鼠巨噬细胞RAW264.7为炎症模型,旨在从细胞水平上进一步阐明草乌甲素的抗炎机制,从而为草乌甲素对过敏性哮喘的治疗提供更多实验依据。
1 材料与方法
1.1 材料
1.1.1主要材料与试剂
小鼠腹腔巨噬细胞系RAW264.7由皖南医学院中心实验室赠与;草乌甲素标准品(BLA)(编号CAS#107668-79-1)购自上海源叶生物科技有限公司;脂多糖(LPS)(编号L2880-O55:B5)购自美国Sigma公司;DMEM完全培养液购自美国Gibco公司(编号REF:C11965500BT);CCK-8细胞活力/毒性检测试剂盒购自合肥睿捷生物科技有限公司(编号REF: BL001B);IL-6、IL-1β、TNF-α和MCP-1 ELISA检测试剂盒(编号分别为REF: AE90247Mu;REF:AE90731Mu;REF:AE90301Mu;CSB-E07430m)购自美国Amresco公司;兔抗iNOS、COX-2、TLR4、NF-κBp65、p38MAPK、ERK和JNK等多克隆抗体(编号分别为13120S、12282S、D220102-0100、8242S、8690S、4695S、9252P)购自美国Cell Signaling Technology公司。
1.1.2主要仪器设备
超净工作台(型号SJ-CJ-2D)为上海尚净公司产品;CO2细胞培养箱为日本SANYOMCO公司产品;倒置显微镜(型号IX73)为日本OLYMPUS公司产品;多功能酶标仪(型号Tecan Infinite F200)为瑞士TECAN集团公司产品;低温高速离心机(型号3-18KS)为美国Sigma公司产品;恒温水浴锅(型号HH-3)为江苏金坛市亿通电子有限公司产品。
1.2 方法
1.2.1细胞培养
RAW264.7细胞于37℃、5%CO2以及95%相对湿度的培养箱中孵育,用含10%胎牛血清(FBS)、1%双抗(青霉素和链霉素)的DMEM完全培养液培养。每隔1天换液1次,待细胞铺满培养皿进行传代或冻存。取对数生长期细胞进行实验。
1.2.2细胞活性检测
将对数生长期的RAW264.7细胞制备成细胞悬液,加入6孔板,每孔100 μL细胞悬液,待细胞融合度达80%时,分别使用不同浓度的草乌甲素(0、25、50、100、150、200、400、600、800、1 000、1 500 μg/mL)处理细胞,培养24 h后弃去培养液,将CCK-8溶液与DMEM完全培养液按1∶10的比例稀释后,每孔加入100 μL稀释液,避光在培养箱中继续孵育2 h后终止培养,使用酶标仪测定在450 nm处的吸光度(OD)值。
1.2.3不同草乌甲素作用时间细胞上清液中炎症因子的检测
将对数生长期的RAW264.7细胞制备成细胞悬液,加入6孔板,每孔2 mL。待细胞融合度达80%时用150 μg/mL的草乌甲素预处理细胞2 h,然后每孔加入500 ng/mL的LPS刺激细胞,在草乌甲素作用时间分别为0、0.5、1、2、3、4、5、6、8、12、16、18、20、24、30、48 h时终止培养并收集细胞上清液,用ELISA试剂盒检测IL-6、IL-1β、TNF-α和MCP-1含量,具体操作按照说明书进行。
1.2.4Western blot检测草乌甲素对LPS诱导的RAW264.7细胞信号通路的影响
处理方法同上,在草乌甲素作用时间分别为0、2、6、12、18、24 h时终止培养,收集细胞并提取总蛋白-20℃保存备用。取等量样品行SDS-PAGE电泳,湿转至NC膜;5%BSA封闭2 h,一抗4℃孵育过夜,TBST洗膜3遍,每遍10 min;二抗孵育40 min,TBST洗膜3遍,每遍10 min,ECL发光试剂盒曝光成像。
1.3 统计学分析
2 结 果
2.1 草乌甲素对RAW264.7细胞活力的影响
CCK-8结果(图1)表明25、50、100、150 μg/mL的草乌甲素作用于RAW264.7细胞24 h对其活力没有显著影响,而200、400、600、800、1 000、1 500 μg/mL的草乌甲素作用于细胞24 h对其增殖活力有显著的抑制作用,因此后续实验使用150 μg/mL的草乌甲素处理细胞。

图1 草乌甲素对RAW264.7细胞活力的影响(a,P < 0.05 vs.对照组)
2.2 不同草乌甲素作用时间对LPS诱导的RAW264.7细胞炎症因子含量的影响
为了了解草乌甲素对LPS诱导的RAW264.7细胞炎症因子释放的影响,我们检测了炎症因子IL-6、IL-1β、TNF-α以及MCP-1的水平。其结果如图2A所示:与LPS组相比,草乌甲素作用各时间段TNF-α含量均降低(P< 0.01),其中30 h组与其他各小时组相比含量最低(P< 0.05),而30 h组与48 h组相比差异无统计学意义(P> 0.05);图2B显示:与LPS组相比,草乌甲素作用各时间段IL-1β含量均降低(P< 0.01),其中5 h组与6、16、18、20、30、36 h组相比IL-1β含量更低(P< 0.05);图2C显示与LPS组相比,除3、4 、16和20 h差异无统计学意义外,其他各作用时间段IL-6含量均降低(P< 0.05);图2D显示与LPS组相比,除0.5h和2 h差异无统计学意义外,其他各作用时间段MCP-1含量均降低(P< 0.05)。
2.3 草乌甲素对LPS诱导的RAW264.7细胞中iNOS和COX-2表达水平的影响
在本研究中,通过Western blot检测iNOS和COX-2的表达。结果显示,与对照组相比,LPS显著增加iNOS和COX-2的表达。然而,用150 μg/mL的草乌甲素分别处理细胞2、6、12、18、24 h均可降低iNOS和COX-2的表达(P<0.01),其中与其他各作用时间组相比草乌甲素作用时间48 h抑制效果最好(图3)。总之,结果显示草乌甲素可以抑制LPS诱导的RAW264.7细胞中iNOS和COX-2的表达水平。
2.4 草乌甲素对LPS诱导的TLR4和NF-κB通路活化的影响
通过Western blot检测TLR4和NF-κBp65的表达。结果显示,与对照组相比,LPS显著增加TLR4的表达以及NF-κBp65的磷酸化。然而,用150 μg/mL的草乌甲素分别处理细胞2、6、12、18、24 h均可降低TLR4的表达并降低NF-κBp65的磷酸化,其中与其他各作用时间组相比草乌甲素作用时间48 h抑制效果最好(图4)。总之,结果显示草乌甲素可以抑制LPS诱导的RAW264.7细胞中TLR4的表达以及NF-κB的活化。
2.5 草乌甲素对LPS诱导的MAPK通路活化的影响
通过Western blot检测BLA对MAPK通路活化的影响。结果显示LPS显著增加p38、细胞外受体激酶(ERK)和c-Jun-N末端激酶(JNK)的磷酸化。然而,用草乌甲素分别作用于细胞2、6、12、18、24 h抑制了p38、ERK和JNK的磷酸化,其中与其他各作用时间组相比草乌甲素作用时间48 h抑制效果最好(图5)。总之,结果显示草乌甲素可有效抑制LPS诱导的RAW264.7细胞中MAPK信号通路的活化。
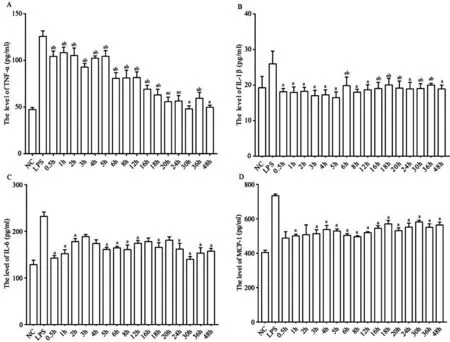
A:a,与LPS组相比,P<0.01;b,与30 h组相比,P<0.01;c,与30 h组相比,P<0.05。B:a,与LPS组相比,P<0.01;b,与5 h组相比,P<0.05。C:a,与LPS组相比,P<0.05。D:a, 与LPS组相比,P<0.05。
图2 不同草乌甲素作用时间对LPS诱导的RAW264.7细胞中炎症因子释放的影响
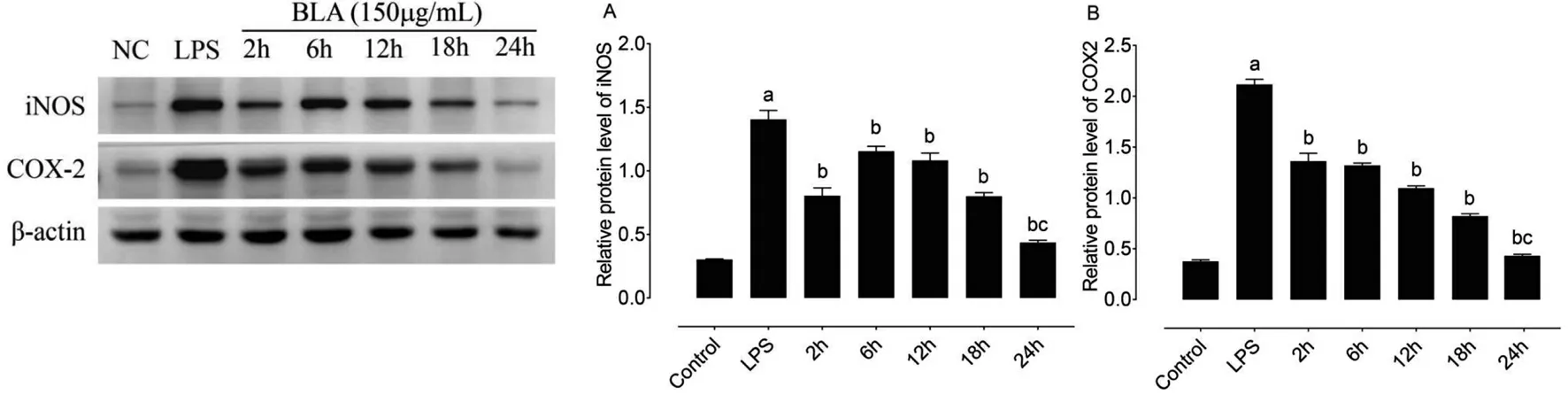
A:a,与对照组相比,P<0.01;b,与LPS组相比,P<0.01; c,与18 h组相比,P<0.01。B:a,与对照组相比,P<0.01;b,与LPS组相比,P<0.05;c,与18 h组相比,P<0.01。
图3 草乌甲素抑制LPS诱导的iNOS和COX-2表达水平

A:a,与对照组相比,P<0.01;b,与LPS组相比,P<0.01; c,与12 h组相比,P<0.05。B:a,与对照组相比,P<0.01;b,与LPS组相比,P<0.05;c,与2 h组相比,P<0.05;d,与6 h组相比,P<0.01;e,与18 h组相比,P<0.05。
图4 草乌甲素抑制LPS诱导的NF-κB的活化和TLR4的表达
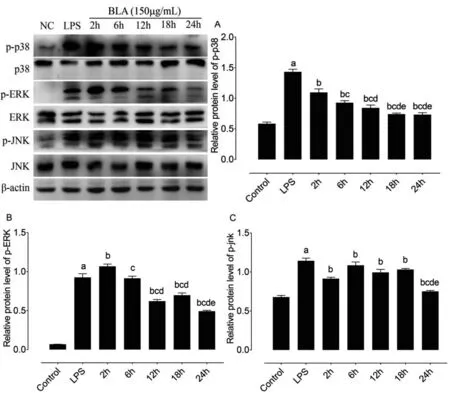
A:a,与对照组相比,P<0.01;b,与LPS组相比,P<0.01;c,与2 h组相比,P<0.01;d,与6 h组相比,P<0.05;e,与12 h组相比,P< 0.01。B:a,与对照组相比,P<0.01;b,与LPS组相比,P<0.05;c,与2 h组相比,P<0.01;d,与6 h组相比,P<0.01;e,与12 h组相比,P<0.05。C:a,与对照组相比,P<0.01;b,与LPS组相比,P<0.05;c,与2 h组相比,P<0.01;d,与6 h组相比,P<0.01;e,与12 h组相比,P<0.01。
图5 草乌甲素抑制LPS诱导的p38、ERK和JNK的活化
3 讨 论
巨噬细胞作为先天免疫的第一道防线,在炎症的发生发展和消除中起关键作用;其通过在病原体入侵时释放细胞因子和炎症介质引起先天免疫反应[10]。炎症期间,活化的巨噬细胞产生过量的炎症介质(如NO和TNF-α)以及炎性细胞因子(如IL-1β和IL-6),这些物质通过与其他炎症介质的协同作用促进过敏性哮喘等炎症性疾病的发生与发展[11]。因此,巨噬细胞广泛用于炎症和免疫的研究中。
草乌甲素(Bulleyaconitine A,BLA),一种分离自乌头属植物的二萜类生物碱,目前对于BLA生物学活性的研究主要集中在镇痛方面[12]。研究发现,BLA可减轻紫杉醇诱导的大鼠脊髓背角C-纤维突触的神经病理性疼痛[13];另有研究表明BLA通过抑制蛋白激酶C(PKC),减少神经病理性大鼠未损伤的背根神经节神经元中对河豚毒素敏感的钠电流,从而缓解疼痛[14]。此外,BLA通过直接刺激脊髓小胶质细胞中强啡肽A的表达表现出抗过敏反应[15]。而据最新研究报道BLA可缓解过敏性哮喘小鼠的气道炎症反应[16],但其潜在的抗炎分子机理尚不十分清楚。
本研究首先采用CCK-8检测了BLA对于RAW264.7细胞活力的影响,结果显示BLA在小于等于150 μg/mL时没有细胞毒性,因此后续实验使用150 μg/mL的BLA处理细胞。受刺激的巨噬细胞分泌大量的炎症介质,包括促炎细胞因子(如IL-6、IL-1β、TNF-α)和单核细胞趋化蛋白-1(MCP-1),导致炎症细胞浸润到气道炎症中,并导致多种免疫紊乱[17-18]。本课题通过检测不同BLA作用时间细胞上清液中IL-6、IL-1β、TNF-α以及MCP-1的水平发现,BLA作用不同时间均可下调它们的水平,其中BLA在作用时间48 h时对TNF-α的抑制效果最明显。在炎症过程中,由诱导型一氧化氮合酶(iNOS)产生的NO自由基在感染的先天免疫反应中起重要作用[19];哮喘等炎症性疾病发生时iNOS表达通常升高[20]。环氧合酶-2(COX-2)是炎症介质前列腺素(PG)和白三烯等生成过程中的关键酶,这些炎症介质引起机体红肿热痛和炎症细胞浸润,从而加重现有的炎症[21-22]。因此,抑制iNOS和COX-2对减轻气道炎症很重要。在本研究中,LPS组的iNOS和COX-2表达显著高于对照组。然而,用BLA处理显着降低了iNOS和COX-2表达水平,其中BLA作用48 h抑制作用最好。研究证实,NF-κBp65作为转录因子NF-κB家族的其中一员,在炎症性疾病中过度激活,如过敏性哮喘[23-24]。丝裂原活化蛋白激酶(MAPK)家族包括3个成员:细胞外信号调节激酶1/2(ERK1/2),p38MAPK和c-Jun N-末端激酶(JNK)[25]。NF-κB及MAPK作为典型的炎症信号通路,它们能够调节iNOS的转录以及相关促炎细胞因子(包括TNF-α、IL-1β和IL-6等)的表达,并在炎症反应中与COX-2相互作用[25-27]。LPS可通过toll样受体4(TLR4)信号通路激活NF-κB及MAPK通路,诱导炎性细胞因子的产生,从而加重炎症[28]。另一方面,据报道MAPK的磷酸化和活化可促进NF-κB的活化、核转运和随后的转录调节[29-30]。因此,在本研究中,我们检测了BLA对LPS刺激的NF-κB和MAPK通路活化的影响。结果显示,与对照组相比,LPS刺激可增加RAW264.7细胞TLR4的表达以及p65、p38、ERK、JNK的磷酸化;而BLA处理可降低TLR4的表达并降低p65、p38、ERK、JNK的磷酸化。这些结果表明,BLA可能通过抑制NF-κB和MAPK通路的活化减少炎症细胞因子的产生来发挥抗炎作用。
综上所述,本研究通过细胞实验证明草乌甲素能够抑制LPS诱导的RAW264.7细胞炎症反应,其机制可能是通过抑制TLR4、NF-κB及MAPK信号通路的活化,从而减少iNOS、COX-2和促炎细胞因子的表达实现的。因此,我们的研究为草乌甲素治疗过敏性哮喘等炎症性疾病提供了实验依据,为进一步研究草乌甲素的抗炎机制奠定了基础。

