不同乳酸菌在毛酸浆发酵中的特性研究
朱 丹 ,朱立斌,苗欣月,颜飞翔,牛广财*,魏文毅,贾 建
(1.黑龙江八一农垦大学生命科学技术学院,黑龙江大庆 163319;2.黑龙江八一农垦大学食品学院,黑龙江大庆 163319;3.黑龙江省农产品加工工程技术研究中心,黑龙江大庆 163319)
毛酸浆(Physalis pubescensL.)别名洋菇娘、黄菇娘等,茄科酸浆属的一年或多年生草本植物。毛酸浆为药食两用植物,具有清热解毒、利咽化痰等功效[1-2]。其果实营养丰富,颜色橙黄,酸甜可口,深受大众的喜爱,是一种宝贵的植物资源,具有重大的开发价值[3]。目前,以毛酸浆为主要原料开发生产的产品逐渐增多,主要有果汁、罐头、果酒、果醋、果冻、果酱和果脯等[4-8]。随着人们生活水平的提高,消费者的营养与保健意识逐渐增强,对毛酸浆新产品的需求与日俱增,开发具有独特风味的乳酸发酵型果蔬饮品具有广阔的发展前景。
乳酸菌是一类发酵糖类产生乳酸的细菌总称,乳酸菌及其代谢产物具有抗衰老、降低胆固醇、调节血脂、增强免疫力、抑制肿瘤、改善胃肠菌群等保健功效[9-11]。利用乳酸菌发酵后的水果和蔬菜饮料中新产生的乳酸使产品增加了柔和爽口的酸味[12-14]。截至目前,毛酸浆乳酸菌发酵的研究鲜有报道。
本研究拟采用6种不同乳酸菌对毛酸浆进行发酵,比较发酵过程中总酸含量、乳酸菌活菌数和色泽的变化,为研发出一种新型毛酸浆乳酸菌发酵饮料提供依据,对进一步拓展毛酸浆的加工途径有着重要意义。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
毛酸浆果:黑龙江省大庆市农贸市场。
1.1.2 菌株
嗜热链球菌(Streptococcus thermophilus)(L1)、保加利亚乳杆菌(Lactobacillus bulgaricus)(L2)、瑞士乳杆菌(Lactobacillus helveticus)(L3)、植物乳杆菌(Lactobacillus plantarum)(L4)、短乳杆菌(Lactobacillus brevis)(L5)、干酪乳杆菌(Lacbobacillus casei)(L6):中国工业微生物种保藏中心。
1.1.3 试剂
白糖(食品级):黑龙江北方糖业股份有限公司;Pectinex XXL果胶酶(10 000 U/mL):诺维信(中国)生物技术有限公司;MRS肉汤培养基:青岛海博生物公司;氢氧化钠(分析纯):天津市大茂化学试剂厂。
1.2 仪器与设备
HR7633打浆机:飞利浦家庭电器(珠海)有限公司;WS108手持式折光仪:河北润联科技开发有限公司;TD5Z台式低速离心机:湖南凯达科学仪器有限公司;LDZX-75KBS立式压力蒸汽灭菌器:上海申安医疗器械厂;DL-CJ-1N超净工作台:北京东联哈尔仪器制造有限公司;CR-410型色差仪:日本柯尼卡美能达公司;EX324电子分析天平:奥豪斯仪器(上海)有限公司;BX43-OLYMPUS显微镜:奥林巴斯有限公司;DRP-9082电热恒温培养箱:上海森信试验仪器有限公司。
1.3 方法
1.3.1 毛酸浆乳酸菌发酵
毛酸浆果汁的制备:选取成熟度好、粒大饱满、无病虫害、无霉变的毛酸浆鲜果,去除萼片,清水洗涤后于90 ℃热烫5 min,打浆后备用。打浆后的毛酸浆按2.0 mL/kg加入Pectinex XXL果胶酶,将其置于45 ℃水浴中酶解4 h[15]。用白糖直接调糖度至21%。将调完糖度的果汁经85 ℃处理10 min后,冷却至室温,备用。
菌种活化:将乳酸菌接种于MRS肉汤培养基,37 ℃活化培养24 h。
毛酸浆乳酸菌发酵:按3%(V/V)的接种量将活化好的乳酸菌接种于毛酸浆果汁中,在37 ℃条件下恒温发酵。发酵过程中取样,测定总酸含量、活菌数和色泽的变化。
1.3.2 单一乳酸菌发酵特性实验
分别将已活化好的乳酸菌L1、L2、L3、L4、L5、L6,按照3%(V/V)的接种量接种于毛酸浆果汁中,37 ℃条件下恒温发酵,每天取样,测定总酸含量和乳酸菌活菌总数,并比较发酵结束后发酵液的色差值,比较各乳酸菌的发酵特性。
1.3.3 复合乳酸菌发酵特性实验
在单一菌发酵试验基础上,选出发酵结果较好的3株乳酸菌L4、L5、L6,将乳酸菌L4、L5和L6两两组合,其组合比例见表1,接种总量为3%,分别接种到毛酸浆果汁中,在37 ℃下恒温发酵。每12 h取样,测定总酸含量和乳酸菌活菌数,并比较发酵结束后发酵液的色差值,选出乳酸菌的最佳配比。

表1 复合乳酸菌组合配比方案Table 1 Combination scheme of compound lactic acid bacteria
1.3.4 测定方法
总酸含量[16]:参照GB/T 12456—2008《食品中总酸的测定》酸碱滴定法进行测定。
乳酸菌菌落总数[17]:参照GB 4789.35—2016《食品安全国家标准食品微生物学检验乳酸菌检验》测定,结果以每毫升发酵液中所含活菌菌落的对数表示,即Lg(CFU/mL)[18]。
色泽:按照朱丹等[19]的方法测定,采用美能达CR-410型色差仪测定各发酵液的亮度(L*值)、红绿值(a*值)、黄蓝值(b*值),计算色差值(ΔE值),其计算如公式如下:
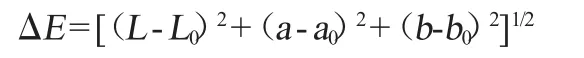
式中:L0、a0、b0表示标准白板的读数;L*值表示亮度,L*值越高表明样品表面越白;a*>0表示红值、a*<0表示绿值;b*>0表示黄值、b*<0表示蓝值。
2 结果与分析
2.1 单一乳酸菌发酵毛酸浆
2.1.1 单一乳酸菌发酵过程中总酸含量的变化
毛酸浆果汁经不同乳酸菌发酵,发酵过程中总酸含量的变化结果见表2。

表2 不同乳酸菌发酵过程中总酸含量的变化Table 2 Changes of total acid contents during the fermentation by different lactic acid bacterium
由表2可知,随着发酵的进行,L1、L2、L33株乳酸菌发酵液中总酸含量较低,均<4.80 g/L,产酸效果不好;而接种L4、L5、L63株乳酸菌的发酵液中总酸含量不断累积,发酵前4天变化较大,发酵7 d后基本稳定。在发酵结束时,乳酸菌L4、L5、L6发酵液中的总酸含量较高,其中,乳酸菌L4发酵液中总酸含量最高,为11.85 g/L。
2.1.2 单一乳酸菌发酵过程中活菌数的变化
不同乳酸菌发酵毛酸浆过程中活菌数的变化结果见表3。
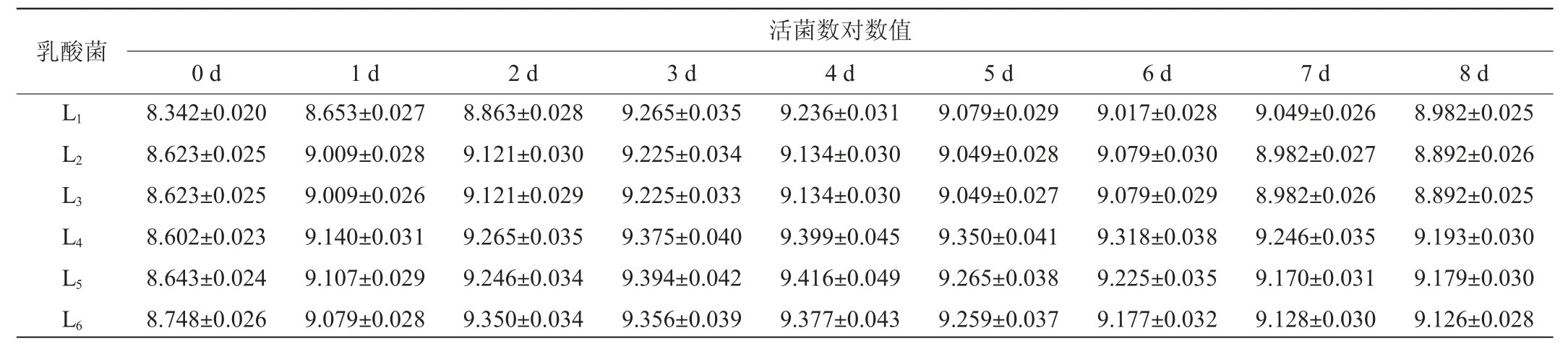
表3 不同乳酸菌发酵过程中活菌数的变化Table 3 Changes of viable count during the fermentation by different lactic acid bacterium
由表3可知,经过活化的乳酸菌接入到毛酸浆果汁后,除乳酸菌L1外,其他各菌株在新的生长环境中迟滞期较短,不断生长繁殖进入对数生长期,并在第3天进入生长稳定期,并且各乳酸菌的菌落总数均达到最大值。至第8天发酵结束时,由于发酵液中的总酸含量较高,菌体出现衰老死亡现象,活菌数略有下降。其中,乳酸菌L4、L5、L6的活菌数相对较高。
2.1.3 单一乳酸菌发酵后对毛酸浆发酵液色泽的影响
不同乳酸菌发酵毛酸浆,发酵结束后发酵液色泽的变化结果见表4。亮度(L*值)、红绿值(a*值)、黄蓝值(b*值)、色差值(ΔE值)是观测果蔬制品颜色变化的常用参数[20]。
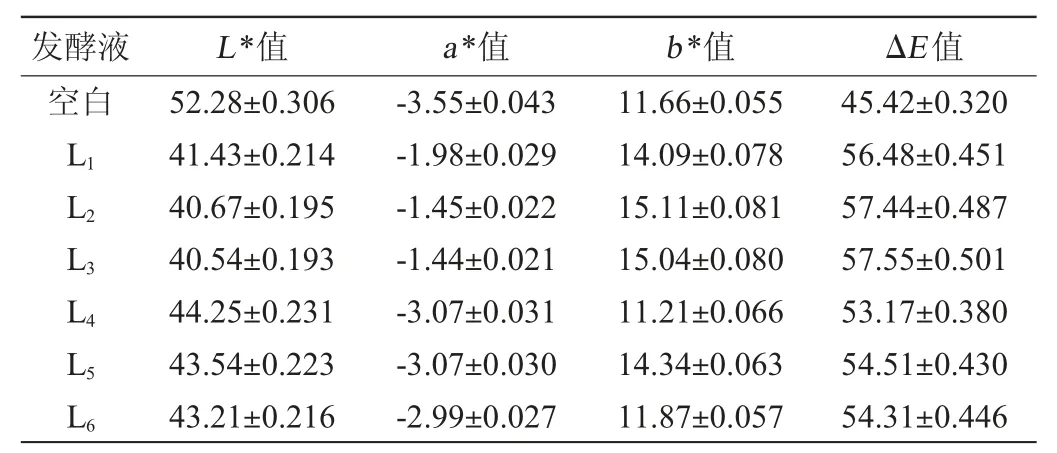
表4 不同乳酸菌发酵结束后发酵液色值测定结果Table 4 Determination results of color value of fermentation broth after fermentation by different lactic acid bacterium
由表4可知,发酵结束后,与未接种乳酸菌的毛酸浆果汁(空白)相比,各发酵液的L*值均变小、ΔE值均变大,说明各发酵液颜色均变暗;乳酸菌L1、L2、L3发酵液的a*、b*值变化较大,发酵液颜色更趋近于红色,而乳酸菌L4、L5、L6发酵液的变化相对较小,说明发酵液更趋近于黄色。因此,乳酸菌L4、L5、L6能更好地保持发酵果实本身的颜色,其色泽更利于人们接受。综上所述,选择L4、L5、L63株乳酸菌进行后续的复合乳酸菌发酵。
2.2 复合乳酸菌发酵毛酸浆
2.2.1 复合乳酸菌发酵过程中总酸含量的变化
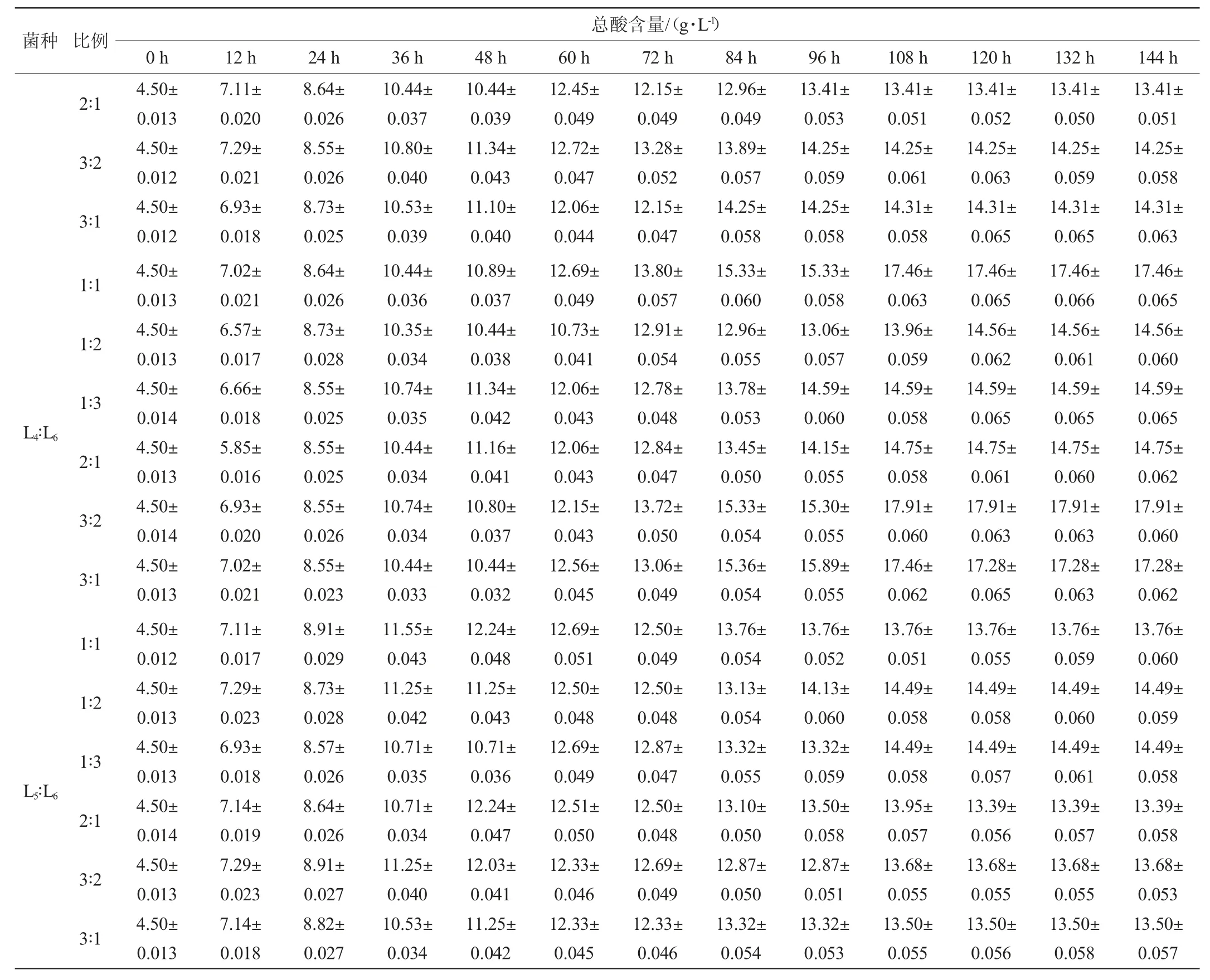
将发酵效果较好的植物乳杆菌(L4)、短乳杆菌(L5)、干酪乳杆菌(L6)3株乳酸菌按不同比例接种到毛酸浆中进行发酵,发酵过程中总酸含量的变化结果见表5。由表5可知,复合乳酸菌发酵毛酸浆过程中,随着发酵的进行,毛酸浆的总酸含量不断上升。各复合乳酸菌发酵液的总酸含量均在发酵0~72 h上升速度较快,在发酵84 h逐渐趋于稳定。发酵结束后,乳酸菌L4与L6按照不同比例组合时,其总酸含量显然高于其他菌种比例,且乳酸菌L4∶L6为3∶2(V/V)时,毛酸浆发酵液中总酸含量最高,可达到17.91 g/L,比单一乳酸菌L4发酵时的总酸含量(11.85 g/L)高6.06 g/L。显然,复合乳酸菌发酵明显优于单一乳酸菌发酵。
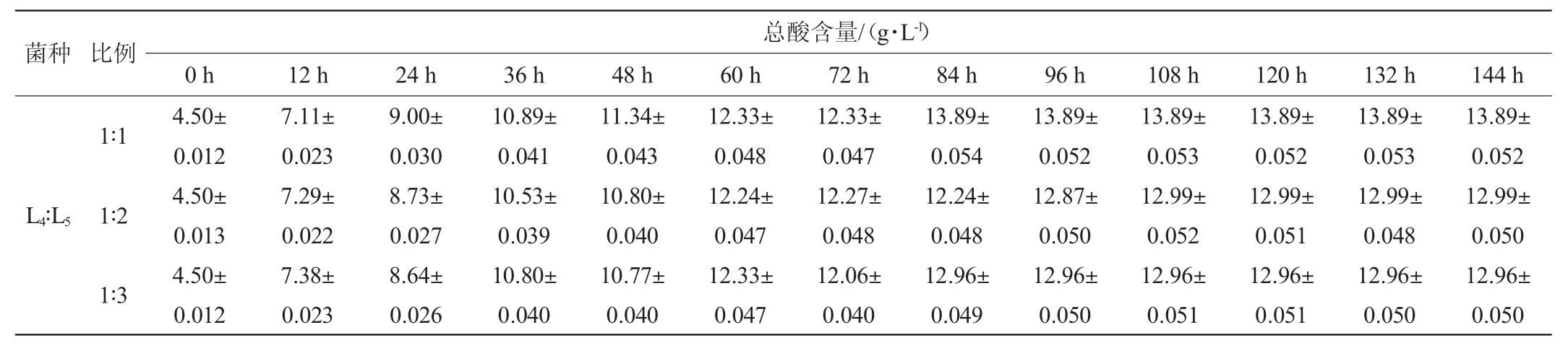
表5 复合乳酸菌发酵过程中总酸含量的变化Table 5 Changes of total acid contents during the fermentation by compound lactic acid bacteria
续表
2.2.2 复合乳酸菌发酵过程中活菌数的变化
植物乳杆菌(L4)、短乳杆菌(L5)、干酪乳杆菌(L6)3株乳酸菌按不同比例接种到毛酸浆果汁中进行发酵,发酵过程中活菌数的变化结果见表6。
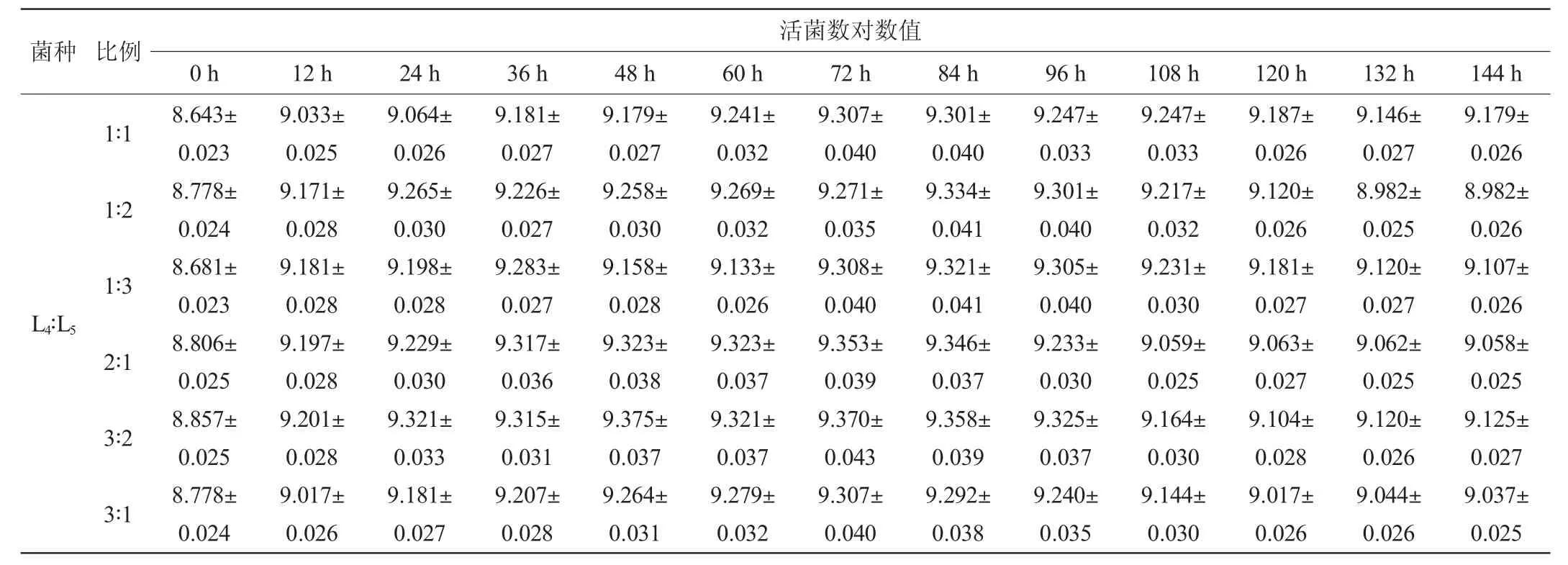
表6 复合乳酸菌发酵过程中活菌数的变化Table 6 Changes of viable count during the fermentation by compound lactic acid bacteria

续表
由表6可知,不同比例的乳酸菌接入毛酸浆中后,乳酸菌利用发酵基质中的营养物质不断代谢繁殖,与这3株单一乳酸菌生长结果相似,迟滞期较短。发酵0~60 h时,复合乳酸菌相继进入对数生长期,并在第72 小时菌落总数达到最大;发酵至108 h后,乳酸菌开始进入衰亡期,由于发酵液中的总酸含量较高,营养物质减少,菌体出现衰老和死亡现象,活菌数开始下降,按不同比例接种乳酸菌发酵的毛酸浆样品间差异不大。
2.2.3 复合乳酸菌发酵后对毛酸浆发酵液色泽的影响
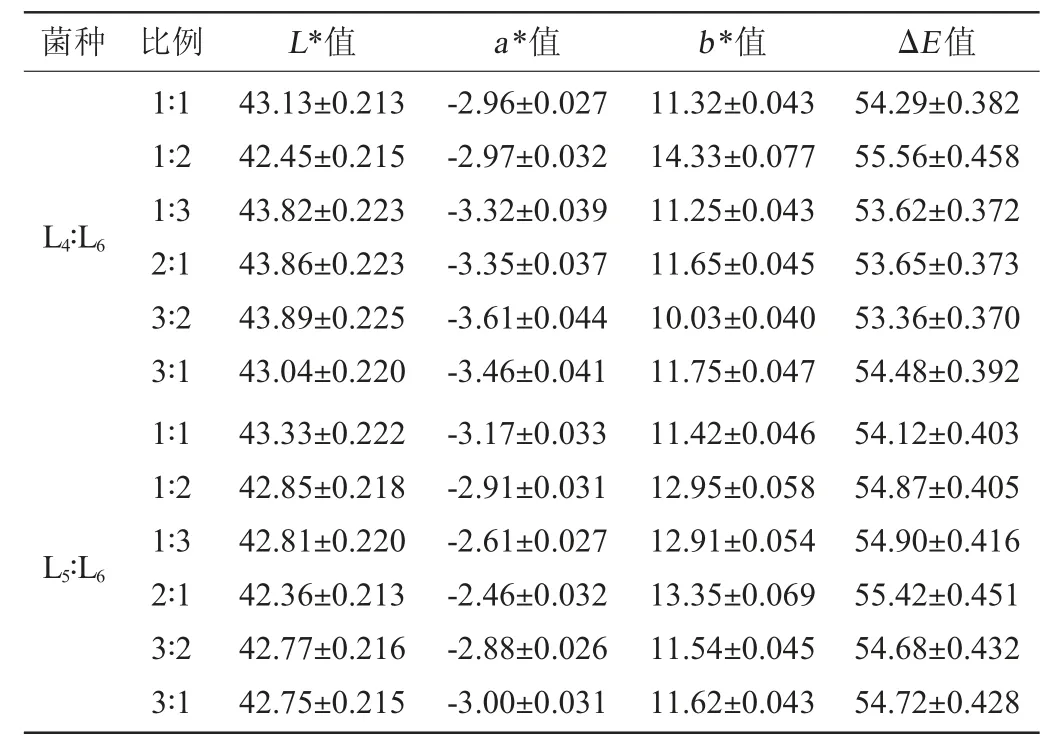
植物乳杆菌(L4)、短乳杆菌(L5)、干酪乳杆菌(L6)3株乳酸菌按不同比例接种到毛酸浆中进行发酵,发酵结束后发酵液色泽的变化结果见表7。
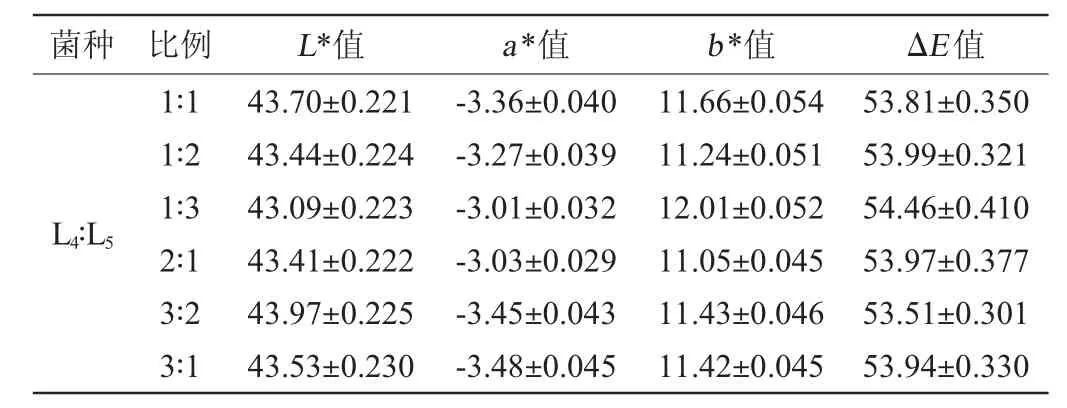
表7 复合乳酸菌发酵结束后发酵液色值测定结果Table 7 Determination results of color value of fermentation broth after fermentation by compound lactic acid bacteria
续表
由表7可知,与未接种乳酸菌的毛酸浆果汁空白对照相比,在发酵结束后,各种处理的发酵液L*值均变小,ΔE值均变大,说明各种处理的发酵液颜色变化趋势相似,即复合乳酸菌发酵后对毛酸浆发酵液色泽的影响基本一致。
3 讨论
近年来,随着乳酸菌研究的深入和在发酵果蔬汁应用的不断增多,发现各种乳酸菌在不同果汁中发酵特性存在明显差异。刘欣等[18]研究显示,植物乳杆菌(Lactobacillusplantarum)和德氏乳杆菌(Lactobacillus delbrueckii)发酵荔枝汁48 h时活菌数最高,达9.0 lg(CFU/mL);嗜热链球菌(Streptococcusthermophilus)在荔枝汁发酵液中活菌数略低,为8.0 lg(CFU/mL);而嗜酸乳杆菌(Lactobacillus acidophilus)和发酵乳杆菌(Lactobacillus fermentum)的活菌数最低,为7.0 lg(CFU/mL),显著低于其他乳酸菌活菌数(P<0.05)。发酵中不同菌株发酵荔枝汁的酸度均呈上升趋势,其中,乳酸乳球菌(Lactococcus lactis)、嗜热链球菌和副干酪乳杆菌(Lactobacillus paracasei)发酵荔枝汁的酸度较低,短乳杆菌(Lactobacillus brevis)的酸度最高,为140.9°T,显著高于其他发酵液的酸度。陈晓维等[14]研究不同乳酸菌在冬瓜汁中的发酵特性表明,干酪乳杆菌、保加利亚乳杆菌和双歧杆菌(Bifidobacteria)在开始发酵8 h时生长缓慢,嗜热链球菌、植物乳杆菌、嗜酸乳杆菌、鼠李糖乳杆菌(Lactobacillus rhamnosus)等4种乳酸菌的生长速率接近。此外,干酪乳杆菌、嗜热链球菌、植物乳杆菌于30 ℃发酵40 h时,冬瓜汁中可滴定酸和色差值均呈上升趋势。束文秀等[21]研究发现,植物乳杆菌和发酵乳杆菌在胡柚汁中生长良好,活菌数>8.0 lg(CFU/mL),pH值显著降低,酸度显著提高,L*值呈下降趋势,a*值、b*值呈上升趋势。本试验中6种乳酸菌在毛酸浆汁中繁殖能力较好,乳酸菌活菌数均能稳定维持在8.0 lg(CFU/mL)以上,但是,仅植物乳杆菌(L4)、短乳杆菌(L5)和干酪乳杆菌(L6)的产酸量较高;嗜热链球菌(L1)、保加利亚乳杆菌(L2)和瑞士乳杆菌(L3)在毛酸浆果汁中生长速率较慢,产酸效果较差,发酵液的色差值ΔE较高。该结果与上述刘欣等[18,14,21]的研究结果不完全一致,说明在不同的果汁中,各种乳酸菌的适应性和发酵性能存在较大的差异。
4 结论
本研究通过对6种不同乳酸菌在毛酸浆中发酵特性的比较可知,6种乳酸菌在毛酸浆汁中繁殖能力较好,乳酸菌活菌数均能稳定维持在8.0 lg(CFU/mL)以上,其中,嗜热链球菌(L1)、保加利亚乳杆菌(L2)和瑞士乳杆菌(L3)在毛酸浆汁中产酸效果较差,总酸含量均<4.80 g/L,发酵液ΔE值均>56.48,更趋近于红色;而植物乳杆菌(L4)、短乳杆菌(L5)和干酪乳杆菌(L6)在毛酸浆汁中的活菌数和总酸含量相对较高,并且发酵液ΔE值均<54.51,均能很好地保持发酵液本身的颜色。当乳酸菌L4、L5和L6按不同组合比例接种到毛酸浆中发酵时,各处理间活菌数和发酵液颜色变化基本一致,当乳酸菌L4∶L6为3∶2(V/V)时,最终毛酸浆发酵液的总酸含量最高,为17.91 g/L,明显优于单一乳酸菌以及其他复合乳酸菌的发酵结果。

