CeO2修饰Mn-Fe-O复合材料及其NH3-SCR脱硝催化性能
黄秀兵, 王鹏, 陶进长, 席作帅
CeO2修饰Mn-Fe-O复合材料及其NH3-SCR脱硝催化性能
黄秀兵1, 王鹏1, 陶进长2, 席作帅1
(1. 北京科技大学 材料科学与工程学院, 北京 100083; 2. 广东省稀土开发及应用研究重点实验室, 广州 510310)
氨选择性催化还原(NH3-SCR)技术需要进一步研发在相对较低温度(<300 ℃)下具有良好催化活性、高稳定性及环境友好的脱硝催化材料。本工作采用草酸共沉淀法制备Mn-Fe-O催化材料, 并对其进行不同含量CeO2修饰, 用于低温NH3-SCR脱硝催化反应。通过X射线衍射(XRD)、扫描电子显微镜(SEM)、氮气吸附–脱附、X射线光电子能谱(XPS)、程序升温还原或脱附(H2-TPR、NH3-TPD)等手段对催化剂进行了表征。催化结果表明, 在相同反应条件下适量CeO2修饰后的Mn-Fe-O样品比纯Mn-Fe-O表现出更优异的NH3-SCR脱硝催化性能, 在80 ℃时NO转化率在95%以上, 且具有较高的N2选择性。CeO2修饰提高了Mn-Fe-O氧化物表面的Fe3+、Mn3+和Mn4+含量及表面酸性位点数量, 从而有助于NH3的吸附及催化反应的进行, 并且Fe2+/Fe3+、Mn2+/Mn3+/Mn4+以及Ce3+/Ce4+电子对之间的相互氧化还原反应提高了催化剂的氧化还原能力及稳定性。
二氧化铈; 修饰; 铁锰氧化物; 脱硝
在众多大气污染物中, NO的减排对缓解酸雨、光化学烟雾、臭氧层破坏等有重要作用。NO控制技术包括氨选择性催化还原(NH3-SCR)、选择性非催化还原(SNCR)、活性炭吸附等。其中, NH3-SCR因其净化效率高(90%以上)、工艺设备较为紧凑、运行可靠等优点, 在脱硝领域得到了青睐[1]。目前, NH3-SCR技术主要使用的催化剂是以V2O5为主要活性组分, WO3或MoO3为助催化剂, TiO2为载体的体系, 在300~450 ℃具有良好的催化效果, 但仍需克服V2O5的生物毒性、操作温度高、催化剂使用寿命低等问题[2]。因此, 在相对较低温度(<300 ℃)下具有良好催化活性、高稳定性及环境友好的脱硝催化材料引起了广泛关注[3]。
近年来, 锰基催化剂因其多重价态及强氧化还原能力, 表现出出色的低温脱硝活性[4]。You等[5]报道了具有优异低温NH3-SCR性能的MnO-CeO2/石墨烯复合催化材料, 同时还发现该催化材料由于含有较多的高价锰、表面吸附氧及MnO-CeO2与石墨烯之间强的相互作用力, 从而具有良好的耐H2O和耐SO2性能。与此同时, 广泛报道的还有不同金属(如铁、铈、钴、钛、镁等)掺杂或修饰的MnO催化剂[6-10]。引入的金属元素改善了催化剂表面氧化还原性能, 提高了催化剂表面酸性, 最终改变了MnO催化剂的脱硝性能和稳定性等。铁基催化剂由于具有优异的氧化还原性能, 良好的Fe3+/Fe2+切换能力以及廉价、环保等特性, 得到了广泛研究[11-13], 但是其表面酸性比较弱, 因此人们经常将一些酸性物质(例如WO3)负载到Fe2O3表面以提高其NH3–SCR脱硝催化性能及抗水抗硫性[14-15]。
近年来, Mn-Fe-O复合氧化物被广泛用于低温NH3-SCR脱硝反应中。Tong等[16]研究了介孔二氧化硅负载不同Mn/Fe比例的Fe-Mn-O复合氧化物的低温NH3-SCR脱硝催化性能, 发现通过调控Mn-Fe-O的组成及焙烧温度可获得较好的催化性能。Yang等[17]研究发现Mn-Fe尖晶石氧化物在低温NH3-SCR脱硝反应中反应物空速和浓度对N2O的选择性有重要影响。另外, Fe-Mn-O复合氧化物Fe3Mn3O8中Fe+和Mn+之间的电子传递有助于提高催化剂的使用寿命, 但SO2和H2O会大大降低催化活性[18-19]。这是由于H2O与NH3、NO等反应物在催化剂表面存在竞争吸附, 也可使催化剂表面羟基化, 减弱催化材料的氧化能力, 抑制NH3的氧化活化; 而SO2经过催化氧化及与H2O和NH3反应后生成的(NH4)2SO4和NH4HSO4会沉积在催化剂表面, 从而占据活性中心, 堵塞孔道结构, 阻碍反应物吸附等[20-21]。因此, Fe-Mn-O复合氧化物的低温NH3-SCR脱硝催化性能还有待提高。
二氧化铈以其杰出的储氧能力与环境友好的特点在脱硝催化剂领域得到了广泛关注, 例如Ce-Ti、Ce-W以及Ce-Mn等复合氧化物催化剂[22-25]。相关报道显示Ce元素的掺杂或修饰可以提高MnO催化剂的抗硫中毒性能[26], 但CeO2修饰对Mn-Fe-O复合氧化物在低温NH3-SCR脱硝催化反应中的影响规律还有待研究。本工作采用草酸共沉淀法制备得到Mn-Fe-O复合氧化物, 并研究了不同CeO2含量修饰对其在低温NH3-SCR脱硝催化反应中的影响规律。
1 实验方法
1.1 实验材料
无水乙醇、七水硫酸亚铁(分析纯, 北京化工厂);六水硝酸铈、四水醋酸锰、二水草酸(Acros Organics公司)。
1.2 催化材料的制备
采用草酸共沉淀法制备Mn-Fe-O催化材料[27]。分别称取3 mmol FeSO4·7H2O和1.5 mmol Mn(CH3COO)2·4H2O溶解在75 mL去离子水中,再将配置好的金属盐溶液迅速倒入含有10 mmol二水合草酸、75 mL 去离子水和75 mL乙醇的混合溶液中, 常温搅拌6 h后在50 ℃下静置10 h, 去离子水清洗3次后在80 ℃干燥12 h。干燥后, 以2 ℃·min–1的速率升温至500 ℃, 并在空气气氛中保温4 h, 得到Mn-Fe-O氧化物。电感耦合等离子体原子发射光谱(Inductively coupled plasma optical emission spectrometry, 简称ICP-OES)测量结果显示Mn-Fe-O的锰离子和铁离子的摩尔比接近1 : 2。
称取四份0.3 g的Mn-Fe-O氧化物分别加入到150 mL去离子水和150 mL乙醇的混合溶液中, 超声分散30 min并常温磁力搅拌30 min后, 将10 mL分别含有0.01、0.05、0.1和0.3 g Ce(NO3)3·6H2O的水溶液滴加到上述溶液中, 常温搅拌2 h后滴加氨水, 调节溶液pH=10。室温条件下磁力搅拌3 h后, 离心、去离子水清洗3次及80 ℃烘箱干燥12 h, 然后在400 ℃马弗炉中保温2 h, 得到Ce()/Mn-Fe-O样品,代表实验过程中所加入Ce(NO3)3·6H2O的质量。
1.3 催化材料的表征
使用Zeiss Evo 18 型扫描电子显微镜观察催化剂表面形貌。使用日本理学Ultima IV多功能射线衍射仪对催化剂的晶体结构进行分析。使用美国麦克ASAP2020 综合吸附仪测定样品的比表面积及孔隙度。通过BET法计算样品的比表面积, 使用BJH方法计算得到孔容和平均孔径大小。采用ESCALab220i-XL型电子能谱仪测定催化材料的X射线光电子能谱(XPS)。使用Quantachrome Autosorb- iQ-C化学吸附仪和日本岛津GC-214 C型气相色谱仪的TCD完成H2的程序升温还原(H2-TPR)。使用麦克Autochem2920仪器完成NH3的程序升温脱附(NH3-TPD)实验, 用来分析催化剂表面酸度和对NH3的吸附能力。使用Agilent ICPOES730电感耦合等离子体原子发射光谱仪测定催化剂的元素含量。
1.4 催化性能的测试
使用电阻加热炉进行催化反应, 石英管的内径为8 mm。入炉前, 在钢制气路外缠加热带用来预热气体, 以确保气体温度达到设定值。催化反应条件为: 500×10–6NO、500×10–6NH3、5% O2、10% H2O(需使用时)和100×10–6SO2(需使用时), 总气路流量为300 mL/min。用奥地利madur photonⅡ型红外烟气分析仪分析烟气的气体成分及浓度。
2 结果与讨论
2.1 催化剂的结构
Ce()/Mn-Fe-O样品的XRD图谱如图1所示, 结果显示Ce()/Mn-Fe-O样品的衍射峰主要为Fe2O3的特征峰, 未检测到锰氧化物的衍射峰, 说明Mn与Fe相互作用形成Fe2O3相固溶体或不定型MnO均匀地分布在Fe2O3晶体表面。随着CeO2修饰量的增加, Fe2O3的衍射峰强度逐渐减弱, 除了Ce(0.3)/ Mn-Fe-O样品外, 其余各样品均未检测到明显的CeO2衍射峰, 这可能是由于分布在Mn-Fe-O氧化物表面的CeO2纳米颗粒降低了Mn-Fe-O氧化物的衍射强度。
2.2 催化材料的结构分析
Ce()/Mn-Fe-O样品形貌如图2所示, 由图2(a)可知, Mn-Fe-O样品呈长条状且长度不均匀, 而长条状物又由Mn-Fe-O纳米小颗粒组成, 并且颗粒与颗粒之间形成了纳米孔。表面修饰不同量CeO2以后, Ce()/Mn-Fe-O样品的相貌和Mn-Fe-O基本一致, 但吸附在Mn-Fe-O氧化物表面的CeO2纳米颗粒分布越来越密集。在Ce(0.01)/Mn-Fe-O样品中, CeO2在Mn-Fe-O表面分布稀疏, 且CeO2颗粒的粒径均匀性较好, 颗粒间未存在明显的黏连现象(图2(b))。随着CeO2修饰量的增加, CeO2在Mn-Fe-O表面的分布更加密集, 而且颗粒粒径均匀性变差, 颗粒间出现了轻微的黏连现象(图2(c))。随着CeO2修饰量进一步增加, CeO2颗粒粒径均匀性更差, 颗粒间的黏连现象更明显, 特别是在Ce(0.3)/Mn-Fe-O样品中, CeO2几乎完全包裹了Mn-Fe-O表面, CeO2颗粒间严重黏结, 团簇成不规则块状。
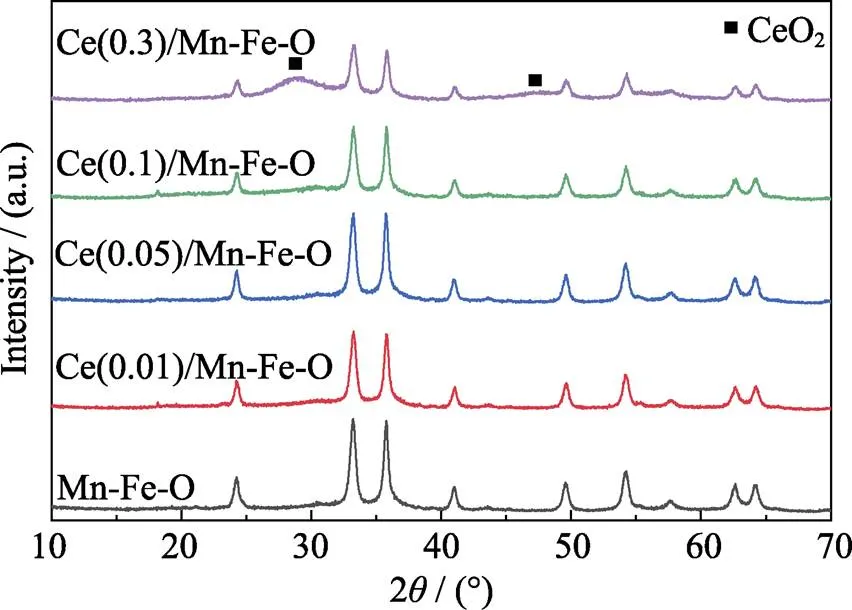
图1 复合氧化物的XRD图谱

图2 Ce(x)/Mn-Fe-O的SEM照片
图3是所制备样品的N2吸脱附曲线。Ce()/ Mn-Fe-O样品的N2等温吸附–脱附曲线均为H3滞后环的IV型曲线, 从图中可以看到, 样品在低压段与N2吸附作用较弱, 说明目标样品中微孔数量较少;相对压力超过0.9后, 样品的N2吸附体积迅速增加, 说明样品中介孔(2~50 nm)较多, 可能是由于纳米颗粒堆积而出现的介孔, 这与样品的SEM微观结构相吻合。样品的结构特性如表1所示, 所有样品的比表面积在140~150 m2·g–1之间, 表明采用草酸共沉淀法制备的Mn-Fe-O氧化物具有较高的比表面积。随着CeO2修饰量的增加, 样品的比表面积、孔体积以及平均孔径整体呈降低趋势, 这是由于CeO2在表面团聚并进入到Mn-Fe-O的孔道内。Ce()/Mn-Fe-O样品的平均孔径在7~9 nm之间, 属于介孔材料。
2.3 催化材料的表面活性物种分析
Fe-Mn-O和Ce(0.1)/Fe-Mn-O的Raman谱图如图4所示。Fe-Mn-O样品在645 cm–1处出现的振动峰可归属于MnO的Mn–O–Mn键弯曲振动以及[MnO6]八面体中Mn–O键的伸展[28], 但峰强度较低, 说明Mn元素均匀分布在Fe2O3晶体表面或晶格中。Fe-Mn-O样品在300 cm–1处的振动峰是由Fe2O3的Fe–O–Fe弯曲振动形成的。经CeO2表面修饰后, Ce(0.1)/Fe-Mn-O样品在465 cm–1处出现了CeO2较强的振动峰, 说明CeO2成功修饰在Fe-Mn-O样品表面。修饰CeO2后, 在200~400 cm–1范围内几乎观察不到Fe–O振动峰。另外, Mn–O的振动峰移至615 cm–1, 而且振动峰强度大大降低, 这可能和修饰CeO2后Mn–O键的对称性发生了改变及MnO晶粒尺寸降低有关[29]。
Mn-Fe-O及Ce(0.1)/Mn-Fe-O样品的XPS谱图如图5所示。由XPS全谱可知(图5(a)), Ce(0.1)/ Mn-Fe-O样品只包含Mn、Fe、Ce和O, 其中C可能来源于表面吸附的CO2。由Ce 3d XPS谱图可知(图5(b)), u、u2和u3对应于Ce(0.1)/Mn-Fe-O表面上的Ce4+3d5/2的特征峰, v、v2和v3对应于Ce4+3d3/2的特征峰, 而u1和v1则对应于Ce3+的XPS特征峰[30]。因此, Ce(0.1)/Mn-Fe-O表面存在Ce4+和Ce3+的混合价态, 使得表面易形成Ce4+/Ce3+的氧化还原电子对。其中, Ce3+的存在有利于氧空位的形成及氧气的吸附与活化, 从而促进NO低温氧化成为NO2, 并与NH3反应生成N2和H2O。Mn-Fe-O和Ce(0.1)/ Mn-Fe-O的Mn 2p和Fe 2p XPS谱图分别如图5(c, d)所示, 其中640.0~641.5、642.0~642.5和643.0~ 643.5 eV的峰分别来自于Mn2+、Mn3+和Mn4+[31], 而710.0~710.3和711.5~712.0 eV处的特征峰分别来自于Fe2+和Fe3+。所有样品的元素组成都由ICP-OES测得, 但不同价态元素组成通过各元素的XPS特征峰面积计算得到, 如表2所示。随着Ce(NO3)3·6H2O的添加量逐渐增加, 复合物中Ce的含量逐渐增加。CeO2修饰后, Mn-Fe-O氧化物中Fe3+、Mn3+及Mn4+的含量逐步增加, 其中Ce(0.1)/Mn-Fe-O表面Mn3+和Mn4+所占的比例总和为五个样品中最高, 达到83%, 而70%的Fe3+含量也较高。进一步增加CeO2后, Ce(0.3)/Mn-Fe-O样品中的Mn3+及Mn4+含量降低至74%。因此, Ce()/Mn-Fe-O样品中同时存在的Fe2+/Fe3+、Mn2+/Mn3+/Mn4+以及Ce3+/Ce4+电子对之间的相互氧化还原反应可以促进电子、离子传输, 将有可能促进低温下NH3选择性还原NO的进行。
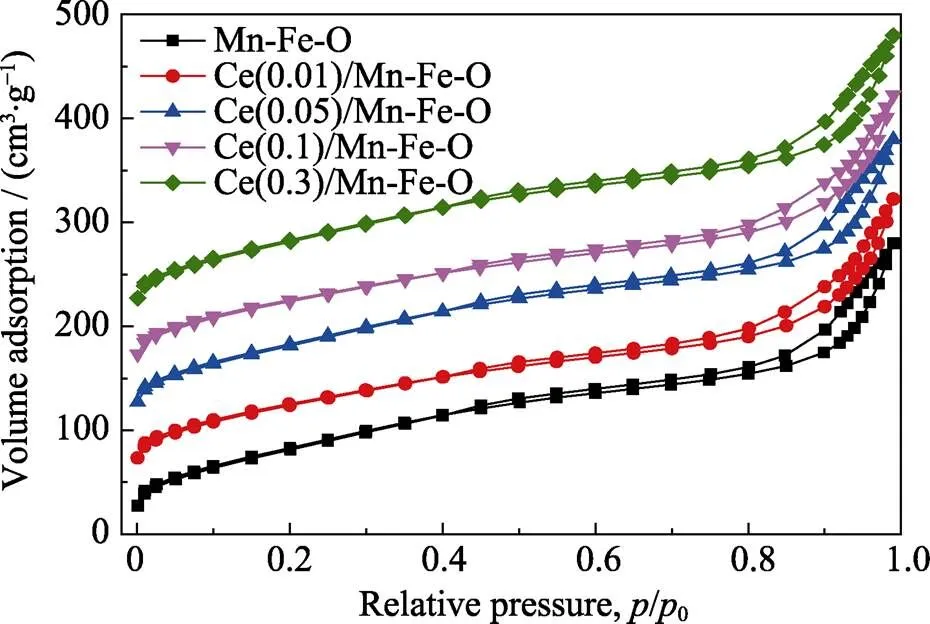
图3 催化材料的N2吸脱附曲线
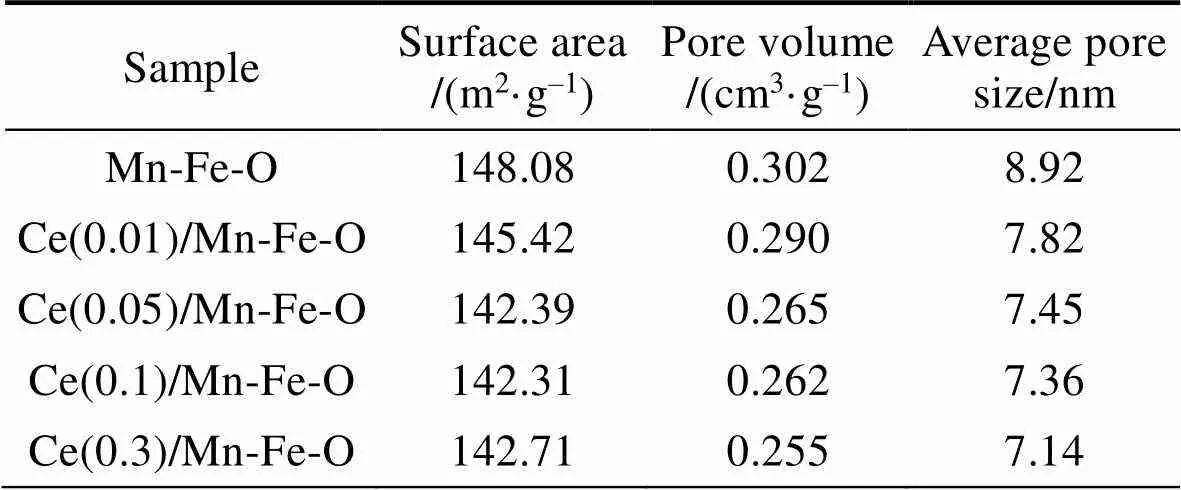
表1 Ce(x)/Mn-Fe-O的结构属性
2.4 催化材料氧化还原能力分析
为了更好地分析材料表面不同酸性位点及其相应强度, 对Mn-Fe-O和Ce(0.1)/Mn-Fe-O样品进行了H2-TPR和NH3-TPD测试。图6(a)的H2-TPR结果显示, Mn-Fe-O和Ce(0.1)/Mn-Fe-O样品在100~ 800 ℃范围内均出现三个较为明显的还原峰, 但各个峰的位置及峰面积略有不同。Mn-Fe-O样品的第一个还原峰(约310 ℃)可归属于Mn4+→Mn3+以及Fe2O3→Fe3O4的还原峰, 390 ℃的还原峰对应于Mn3+→Mn2+以及Fe3O4→FeO的还原, 而650 ℃的还原峰对应于FeO→Fe。相比Mn-Fe-O, Ce(0.1)/ Mn-Fe-O样品的三个还原峰分界不太明显, 分别为380、425和550 ℃, 但Ce(0.1)/Mn-Fe-O的起始还原温度及其在550 ℃的还原峰位置比Mn-Fe-O更低, 而且其还原峰面积大大增加, 说明CeO2的修饰有助于低温下Mn-Fe-O的还原。
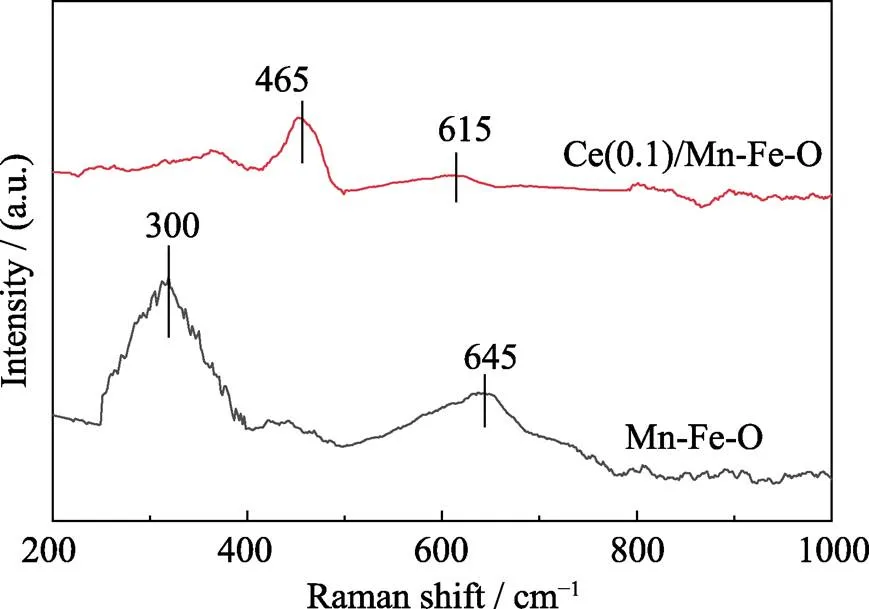
图4 Mn-Fe-O和Ce(0.1)/Mn-FeO样品的Raman图谱
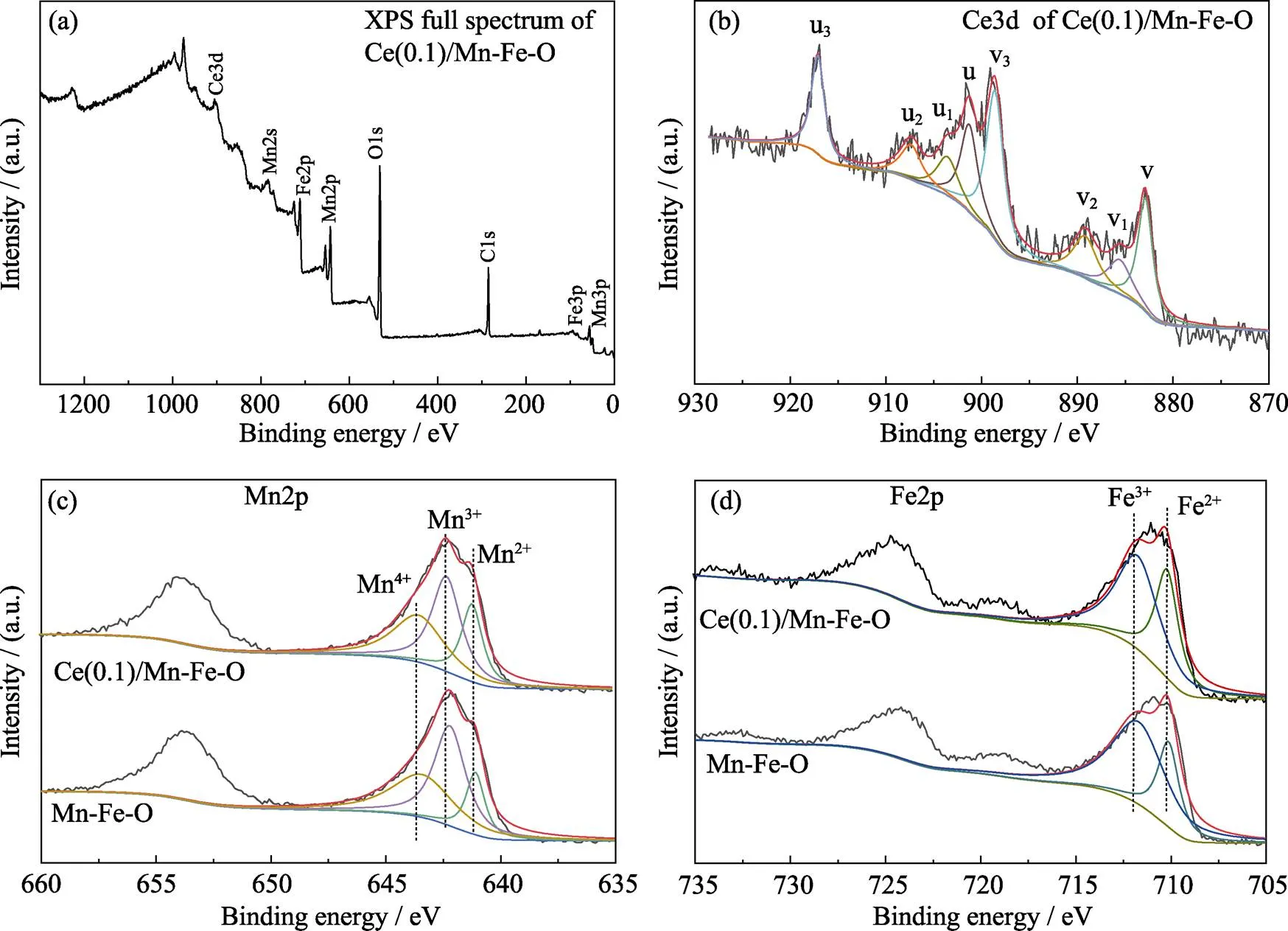
图5 Mn-Fe-O及Ce(0.1)/Mn-Fe-O样品的XPS谱图
(a) Full spectrum; (b) Ce3d; (c) Mn2p; (d) Fe2p
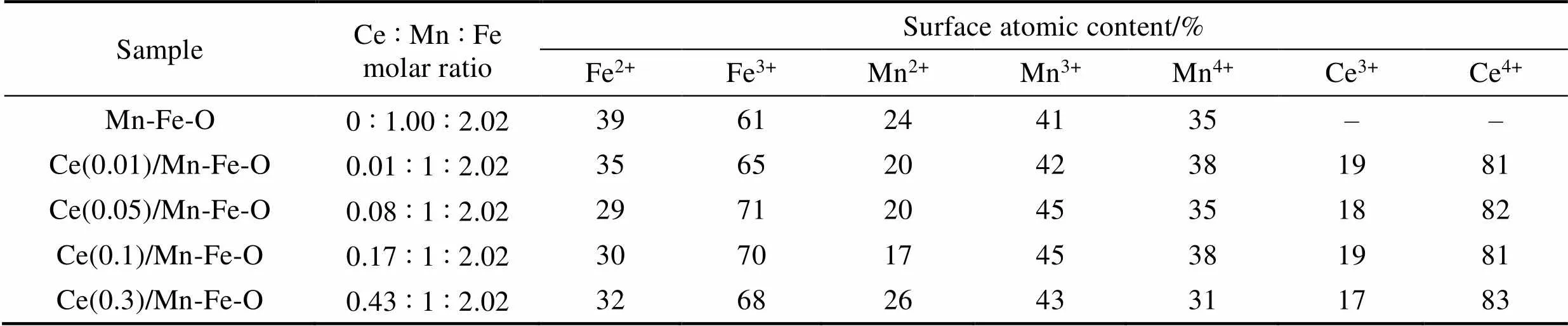
表2 Ce(x)/Mn-Fe-O复合材料表面离子含量
Mn-Fe-O和Ce(0.1)/Mn-Fe-O样品的NH3-TPD测试结果如图6(b)所示, 从图中可以看出, 相比Mn-Fe-O, Ce(0.1)/Mn-Fe-O样品在125~300 ℃存在较宽的NH3脱附峰, 因此在Ce(0.1)/Mn-Fe-O样品表面存在更多的酸性位点, 有利于NH3的吸附和脱附, 从而有可能提升其低温下的脱硝催化性能。由于吸附在布伦斯特(Bronsted)酸性位上的离子态NH4+热稳定性弱于吸附在路易斯(Lewis)酸性位上的配位态NH3的热稳定性, 因此低于200 ℃的脱附峰属于Bronsted酸性位点, 高于200 ℃的脱附峰属于Lewis酸性位点。Ce(0.1)/Mn-Fe-O样品在500 ℃具有更为明显的脱附峰, 说明其还具有大量的Lewis酸性位点, 这可能是由修饰的CeO2引起的。
2.5 催化剂活性测试
对Ce()/Mn-Fe-O催化材料进行脱硝催化性能测试, 如图7(a)所示。Ce(0.1)/Mn-Fe-O和Ce(0.05)/ Mn-Fe-O样品在80 ℃时已表现出非常好的脱硝性能, 其NO转化率均在95% 以上, 而此温度下Mn- Fe-O样品的NO转化率仅为70%。Ce(0.1)/Mn-Fe-O和Ce(0.05)/Mn-Fe-O在120 ℃以下仍表现出95%以上的NO转化率, 比同温度下的Mn-Fe-O样品高15%, 而且Mn-Fe-O对NO的转化率从170 ℃开始下降, 因此Mn-Fe-O的活性温度窗口比Ce(0.1)/ Mn-Fe-O和Ce(0.05)/Mn-Fe-O样品更窄。但Ce(0.3)/ Mn-Fe-O样品的NO转化率反而比Mn-Fe-O更低, 说明修饰过量的CeO2会降低Mn-Fe-O的脱硝催化性能。NO转化率排序为: Ce(0.1)/Mn-Fe-O>Ce(0.05)/ Mn-Fe-O>Ce(0.01)/Mn-Fe-O>Mn-Fe-O>Ce(0.3)/Mn- Fe-O。由图7(b)可知, 随着反应温度的升高, 氨氧化等副反应的发生会使N2选择性发生不同程度的降低, 但Ce(0.1)/Mn-Fe-O样品比其余样品有更高的N2选择性。考虑到Ce(0.1)/Mn-Fe-O的比表面积和孔体积较小, 但其具有最优的NO转化率及N2选择性, 说明在Mn-Fe-O氧化物表面修饰适量的CeO2能够改善Mn-Fe-O的表面活性, 从而提高其低温下的脱硝催化性能, 但修饰过多CeO2后, CeO2会阻碍气体与催化活性中心的接触, 造成催化性能降低。
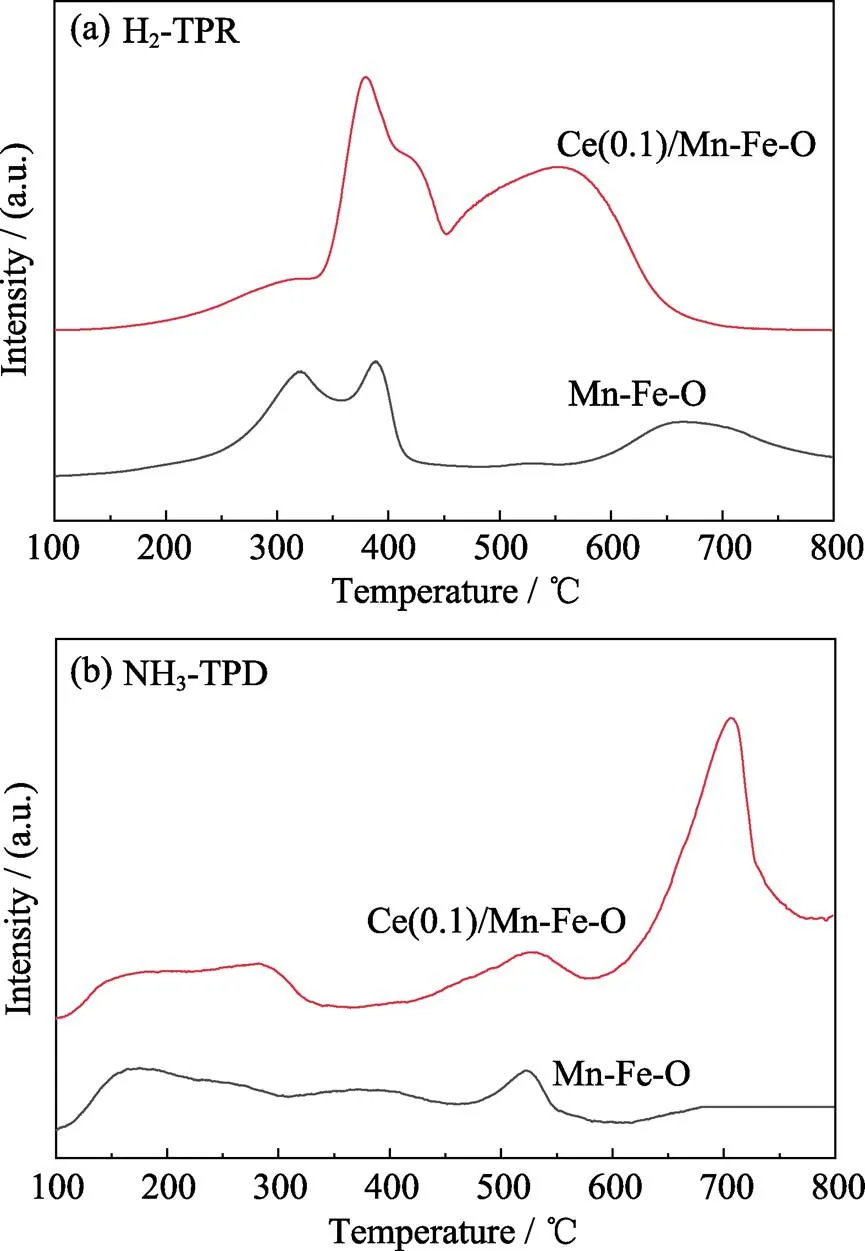
图6 Mn-Fe-O和Ce(0.1)/Mn-Fe-O的(a)H2-TPR和(a)NH3-TPD曲线
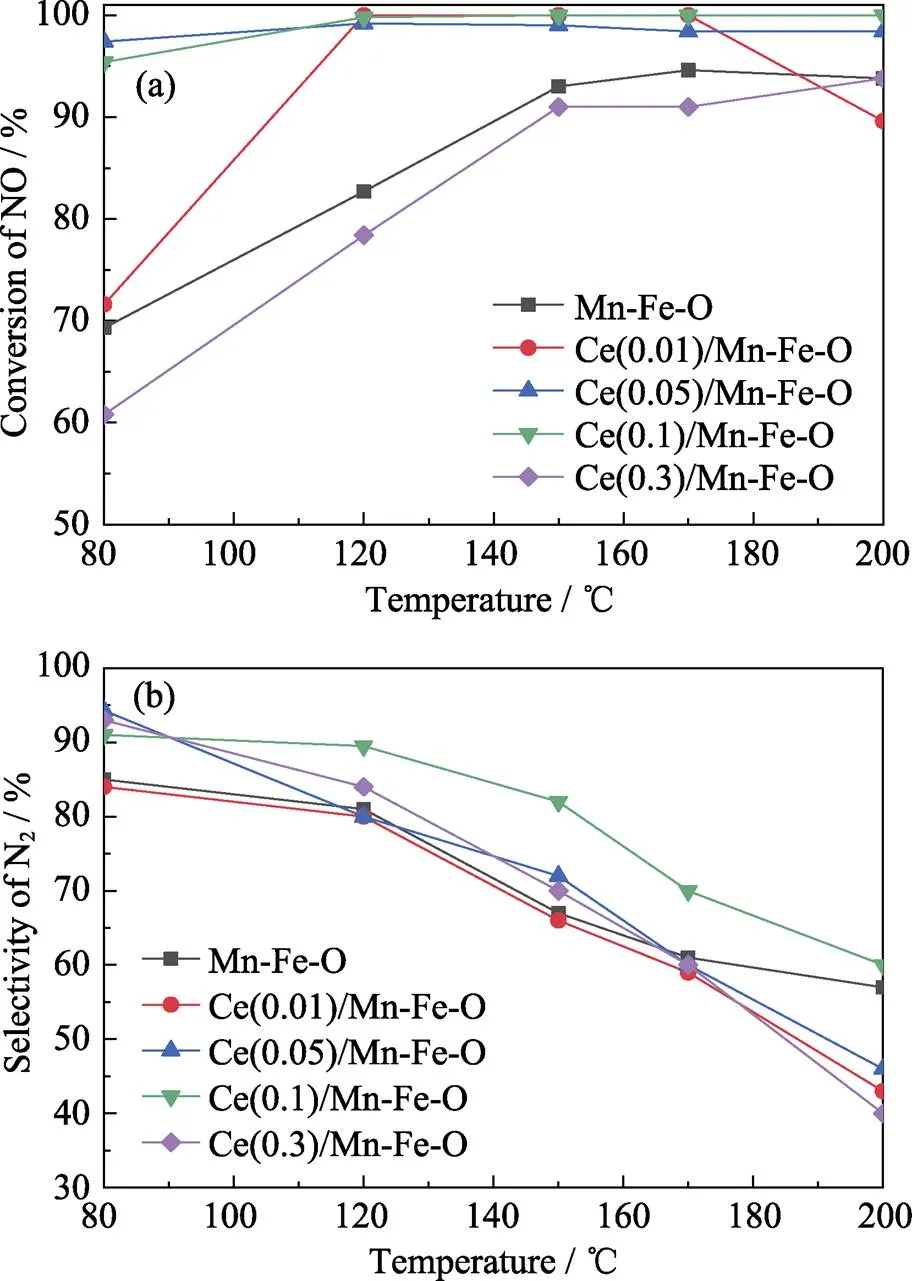
图7 不同催化材料的NH3还原NO的催化性能
(a) Conversion of NO; (b) Selectivity of N2
在NH3-SCR反应中, 被普遍接受的反应路径是: NH3首先吸附在催化活性位上, 然后与吸附在相邻或相同活性位上的NO(L-H机理)或者直接与气相NO或催化剂表面弱吸附的NO(E-R机理)反应生成中间物, 中间物进一步分解为N2和H2O。同时还原催化剂表面的金属离子, 而还原的金属离子再被O2氧化, 形成了一个氧化还原循环[32]。低温下(<200 ℃)主要遵循L-H机理, O2可将吸附在催化剂表面的NO氧化为NO2或HNO2, 并且进一步与吸附的NH3反应形成NH4NO2, 最终分解为N2和H2O。随着反应温度的升高, 吸附在催化剂表面的NH3会被O2过度活化, 从而生成大量的N2O, 导致N2选择性地下降。室温下(30 ℃)的脱吸附平衡结果也发现混合气体尾气中可以检测到较多的NO2, 说明低温下NO在所制备催化剂表面能被氧化成NO2, 而且它更容易与NH3结合生成中间产物, 从而有利于提高低温下的脱硝催化性能。
在120 ℃条件下通入100×10–6的SO2和10%的H2O, 对Ce(0.1)/Mn-Fe-O样品进行耐水耐硫测试。通入SO2或H2O前, 样品先在120 ℃下放置2 h 以达到稳定反应的条件。从图8中可以看到, 通入SO2后, Ce(0.1)/Mn-Fe-O样品的NO转化率出现下降, 经过2 h 后, Ce(0.1)/Mn-Fe-O样品的NO转化率稳定在87%左右; 停止通入SO2后, NO转化率迅速回升至95%, 稍低于通入SO2前的99%, 说明Ce(0.1)/ Mn-Fe-O具有较好的耐硫性能。通入10% H2O后, Ce(0.1)/Mn-Fe-O样品的NO转化率下降至83%; 停止通入H2O后, 样品能够恢复到初始活性, 说明H2O只是暂时降低样品的脱硝活性。通入SO2和H2O的混合气体后, Ce(0.1)/Mn-Fe-O样品的脱硝活性急剧下降, NO转化率迅速降低至65%, 但停止通入后, 样品能够恢复到90%的NO转化率, 这主要是因为H2O分子会与气体竞争吸附活性位点, 并且SO2在样品表面生成低温下难以分解的硫酸盐等物质也会覆盖部分活性点位, 从而导致催化活性的降低[28]。
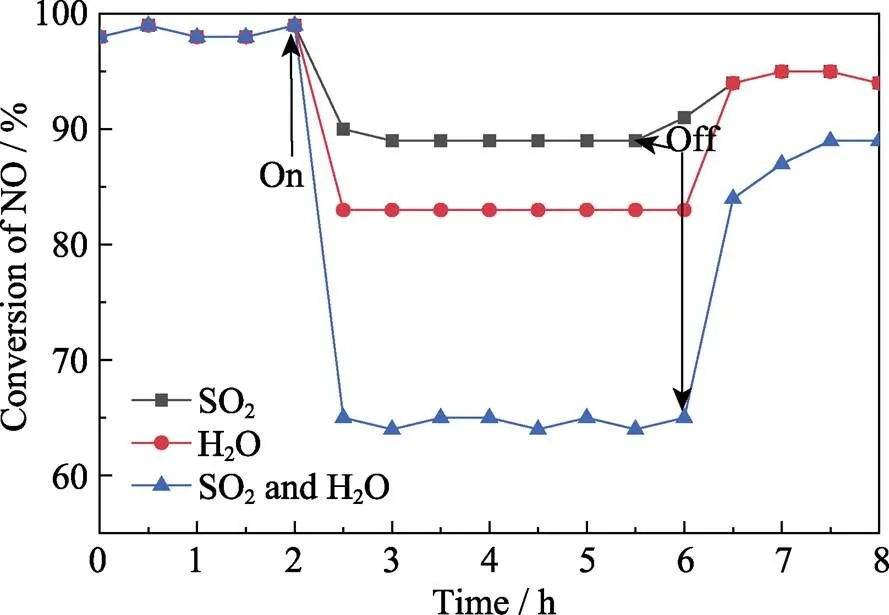
图8 Ce(0.1)/Mn-Fe-O的SO2和H2O阶跃应答实验
3 结论
1) 修饰适量的CeO2可提高Mn-Fe-O氧化物表面的Fe3+、Mn3+和Mn4+含量及低温下的还原能力, 同时可增加表面酸性位点数量, 从而有助于NH3的吸附及催化反应的进行, 并且Fe2+/Fe3+、Mn2+/Mn3+/ Mn4+以及Ce3+/Ce4+电子对之间的相互氧化还原反应提高了催化剂的氧化还原能力及稳定性。
2) 相比纯Mn-Fe-O催化剂, Ce(0.1)/Mn-Fe-O的低温脱硝性能最好, 在80 ℃时, NO转化率可达95%以上, 且有很高的N2选择性及较宽的活性温度窗。同时, Ce(0.1)/Mn-Fe-O具有较好的耐水耐硫性能。但修饰过多CeO2反而不利于反应气与催化活性中心的接触, 造成催化性能下降。
因此, 修饰CeO2适量可改善过渡金属氧化物表面活性物质的含量及氧化还原能力, 这是提高催化活性的一种有效途径, 在环境治理、石油化工等领域具有重要的研究价值和应用前景。
[1] ZHANG H L, LONG H M, LI J X,. Research progress in iron-based catalysts for the selective catalytic reduction of NOby NH3., 2019, 35(5): 753–768.
[2] ZHENG Y J, JENSEN A D, JOHNSSON J E. Deactivation of V2O5-WO3-TiO2SCR catalyst at a biomass-fired combined heat and power plant., 2005, 60(3/4): 253–264.
[3] JI J H, CHANG H Z, MA L,. Low-temperature selective catalytic reduction of NOwith NH3over metal oxide and zeolite catalysts—a review., 2011, 175(1): 147–156.
[4] CHEN J, ZHENG Y Y, ZHANG Y B,. Preparation of MnO2/ MWCNTs catalysts by a redox method and their activity in low- temperature SCR., 2016, 31(12): 1347–1354.
[5] YOU X C, SHENG Z Y, YU D Y,. Influence of Mn/Ce ratio on the physicochemical properties and catalytic performance of graphene supported MnO-CeO2oxides for NH3-SCR at low temperature., 2017, 423: 845–854.
[6] CHEN H P, QI X, LIANG Y H,. Effect of Fe reduced‑modifcation on TiO2supported Fe–Mn catalyst for NO removal by NH3at low temperature., 2019, 126(1): 327– 339.
[7] GONG P J, XIE J L, FANG D,Effects of surface physicochemical properties on NH3-SCR activity of MnO2catalysts with different crystal structures., 2017, 38(11): 1925– 1934.
[8] WANG F M, SHEN B X, ZHU S W,Promotion of Fe and Co doped Mn-Ce/TiO2catalysts for low temperature NH3-SCR with SO2tolerance., 2019, 249: 54–60.
[9] FANG D, HE F, LIU X Q,Low temperature NH3-SCR of NO over an unexpected Mn-based catalyst: Promotional effect of Mg doping., 2018, 427(B): 45–55.
[10] YANG Y R, WANG M H, TAO Z L,Mesoporous Mn-Ti amorphous oxides: a robust low-temperature NH3-SCR catalyst., 2018, 8(24): 6396–6406.
[11] XIONG Z B, WU C, HU Q,Promotional effect of microwave hydrothermal treatment on the low-temperature NH3-SCR activity over iron-based catalyst., 2016, 286: 459–466.
[12] DU T Y, QU H X, LIU Q,Synthesis, activity and hydrophobicity of Fe-ZSM-5@silicalite-1 for NH3-SCR., 2015, 262: 1199–1207.
[13] GAO F, KOLLAR M, KUKKADAPU R K,Fe/SSZ-13 as an NH3-SCR catalyst: A reaction kinetics and FTIR/Mössbauer spectroscopic study., 2015, 164: 407–419.
[14] LIU Z M, SU H, CHEN B H,Activity enhancement of WO3modified Fe2O3catalyst for the selective catalytic reduction of NOby NH3., 2016, 299: 255–262.
[15] LIU F D, SHAN W P, LIAN Z H,. The smart surface modification of Fe2O3by WOfor significantly promoting the selective catalytic reduction of NOwith NH3., 2018, 230: 165–176.
[16] HUANG J, TONG Z, HUANG Y,. Selective catalytic reduction of NO with NH3at low temperatures over iron and manganese oxides supported on mesoporous silica., 2008, 78(3/4): 309–314.
[17] YANG S J, XIONG S C, LIAO Y,Mechanism of N2O formation during the low-temperature selective catalytic reduction of NO with NH3over Mn-Fe spinel., 2014, 48(17): 10354–10362.
[18] CHEN Z H, WANG F R, LI H,Low-temperature selective catalytic reduction of NOwith NH3over Fe-Mn mixed-oxide catalysts containing Fe3Mn3O8phase., 2012, 51(1): 202–212.
[19] XIONG S C, LIAO Y, XIAO X,The mechanism of the effect of H2O on the low temperature selective catalytic reduction of NO with NH3over Mn-Fe spinel., 2015, 5(4): 2132–2140.
[20] JIANG B Q, WU Z B, LIU Y,DRIFT Study of the SO2effect on low-temperature SCR reaction over Fe-Mn/TiO2., 2010, 114(11): 4961–4965.
[21] JIN R B, LIU Y, WU Z B,Relationship between SO2poisoning effects and reaction temperature for selective catalytic reduction of NO over Mn-Ce/TiO2catalyst., 2010, 153 (3/4): 84–89.
[22] TANG C J, ZHANG H L, DONG L. Ceria-based catalysts for low- temperature selective catalytic reduction of NO with NH3., 2016, 6(5): 1248–1264.
[23] LI J, PAN L, WANG J T,Low-temperature removal of NO by spherical activated carbon loaded with MnO-CeO2and melamine., 2016, 31(11): 1205–1211.
[24] ZHAO K, HAN W L, LU G X,Promotion of redox and stability features of doped Ce-W-Ti for NH3-SCR reaction over a wide temperature range., 2016, 379: 316–322.
[25] MA Z R, WENG D, WU X D,A novel Nb-Ce/WO-TiO2catalyst with high NH3-SCR activity and stability., 2012, 27: 97–100.
[26] CHANG H Z, CHEN X Y, LI J H,Improvement of activity and SO2tolerance of Sn-modified MnO-CeO2catalysts for NH3- SCR at low temperatures., 2013, 47(10): 5294–5301.
[27] HUANG X B, LIU L P, GAO H Y,Hierarchically nanostructured MnCo2O4as active catalysts for the synthesis of N-benzylideneaniline from benzyl alcohol and aniline., 2017, 19(3): 769–777.
[28] FRANCE L J, YANG Q, LI W,Ceria modified FeMnO—Enhanced performance and sulphur resistance for low-temperature SCR of NO., 2017, 206: 203–215.
[29] SUN M, LAN B, YU L,Manganese oxides with different crystalline structures: Facile hydrothermal synthesis and catalytic activities., 2012, 86: 18–20.
[30] HUANG X B, ZHENG H Y, LU G L,Enhanced water splitting electrocatalysis over MnCo2O4introduction of suitable Ce content., 2019, 7(1): 1169–1177.
[31] HUANG X B, WANG P, ZHANG H,CeO2–δ–modified CuFe2O4with enhanced oxygen transfer as efficient catalysts for selective oxidation of fluorene under mild conditions., 2019, 2019(1): 91–97.
[32] XU L, LI X S, CROCKER M,A study of the mechanism of low-temperature SCR of NO with NH3on MnO/CeO2., 2013, 378: 82–90.
CeO2Modified Mn-Fe-O Composites and Their Catalytic Performance for NH3-SCR of NO
HUANG Xiubing1, WANG Peng1, TAO Jinzhang2, XI Zuoshuai1
(1. School of Materials Science and Engineering, University of Science and Technology Beijing, Beijing 100083, China; 2. Guangdong Provincial Key Laboratory of Rare Earth Development and Application, Guangzhou 510310, China)
The ammonia selective catalytic reduction (NH3-SCR) technology is still necessary to further develop denitration catalytic materials which have good catalytic activity, high stability and environmental friendliness at relatively low temperature (<300 ℃). In this work, the Mn-Fe-O catalyst was prepared by oxalate co-precipitation method and modified with different contents of CeO2for low temperature NH3-SCR of NO. The catalysts were characterized by X-ray diffraction (XRD), scanning electron microscopy (SEM), nitrogen adsorption-desorption, X-ray photoelectron spectroscopy (XPS), temperature programmed reduction or desorption (H2-TPR, NH3-TPD). The catalytic results show that as compared with pure Mn-Fe-O sample, Mn-Fe-O modified with suitable CeO2content shows much better performance for NH3-SCR with 95% conversion of NO and a high N2selectivity at 80 ℃under the same reaction conditions. CeO2modification increases the content of Fe3+, Mn3+and Mn4+, and the number of surface acid sites on the surface of Mn-Fe-O oxide, which contribute to the adsorption of NH3and the catalytic reaction. In addition, redox reactions among Fe2+/Fe3+, Mn2+/Mn3+/Mn4+and Ce3+/Ce4+pairs improve the redox ability and stability of the catalyst.
ceria; modification; Fe-Mn oxide; NO removal
TB34
A
1000-324X(2020)05-0573-08
10.15541/jim20190266
2019-05-31;
2019-07-25
国家重点研发计划项目(2018YFB0605900); 国家自然科学基金青年基金(51802015); 广东省稀土开发及应用研究重点实验室开放基金(XTKY-201803)
National Key Research and Development Progran of China (2018YFB0605900); National Natural Science Fundation of China (51802015); Open Fund of Guangdong Provincial Key Laboratory of Rare Earth Development and Application(XTKY-201803)
黄秀兵(1985–), 男, 副教授. E-mail: xiubinghuang@ustb.edu.cn
HUANG Xiubing (1985–), male, associate professor. E-mail: xiubinghuang@ustb.edu.cn

