氧化应激因子、甲状腺激素和血尿酸水平与痛风病情相关性研究*
沈斯瑶,张静雯,邱红霞,邵锦华
西安市第五医院(西安710082)
痛风(Gout)是血尿酸升高和沉积引起关节及周围软组织发生的急性炎症反应,最常见的类型为急性痛风关节炎,临床上表现为数小时至一天内突然出现的关节、软组织局部红肿,疼痛明显,部位以第1跖趾关节、踝部及膝关节多见,起病常为单侧或者单个关节。研究表明高尿酸血症与多种因素相关,包括内分泌和代谢失调、肾脏损害、药物诱发、饮食结构异常以及基因等[1],除血清尿酸(UA)水平明显升高,还有高脂血症等情况[2]。痛风呈间断发作,起病急促,疼痛难忍。病情控制不佳者,疾病迁延反复,尿酸沉积在关节部位可见骨组织结构破坏、骨侵蚀呈“虫蚀样”改变,最终发生关节畸形及功能的丧失。实验室检测急性炎症反应指标:血沉(ESR)、C-反应蛋白(CRP)、血常规中白细胞数均见明显升高。痛风与代谢疾病有关,但以往文献报道痛风与甲状腺功能异常具有一定相关性,而疾病中氧化应激水平与病程、痛风合并骨破坏的相关性研究少见,为进一步验证痛风患者合并甲状腺功能情况、分析氧化应激水平与痛风病程、合并骨破坏的相关性,本文进行了相关研究,从而深入探讨痛风的发病机制,现报告如下。
对象与方法
1 研究对象 收集2016年11月至2019年10月西安市第五医院门诊和住院治疗的72例痛风患者的临床资料。所有入选患者均符合痛风的诊断标准。病例排除标准:排除多发性骨髓瘤、排除慢性肾功能不全者、合并严重心血管疾病、合并类风湿关节炎、干燥综合征等其他自身免疫性疾病、合并淋巴瘤等系统恶性肿瘤等的患者。72例痛风患者男性62例,女性10例,年龄26~74岁,平均年龄(41.5±17.6)岁。同时选取同时期在我院进行体检年龄匹配的正常健康人30例为对照组,其中男26 例,女4 例,年龄25~75岁,平均年龄(42.9±18.6)岁。两组对象的年龄、性别等一般资料比较差异无统计学意义(P>0.05)。本研究获得西安市伦理委员会批准(20160201),进入临床观察的所有参与者均填写知情同意书。
2 研究方法 收集76例痛风患者临床资料,包括病程、疼痛部位、发作次数和影像学结果等情况。痛风患者与正常对照组均晨起抽取静脉血3 ml检测以下指标:①肾功指标、血尿酸(UA)、C-反应蛋白(CRP)在本院检验科完成;②外周血清中晚期氧化蛋白产物(AOPP)检测,抽取外周血后应用EDTA 抗凝,经PBS比例混悬、冰醋酸再悬,在340 nm 光度进行测量;③促甲状腺激素(TSH)、游离三碘甲状腺原氨酸(FT3)、游离甲状腺素(FT4)、超氧化物歧化酶(SOD)水平检测,应用酶联免疫法进行测定,自西安壮志生物技术有限公司购买以上试剂盒,操作按试剂盒规范和步骤完成实验。各指标正常范围值:TSH(0.27~4.2 mIU/L),FT3(3.1~6.8 pmol/L),FT4(12~22 mol/L)。甲状腺功能减退症(甲减)及亚临床甲减诊断主要根据以上三项指标确定[3],甲减为:TSH 大于正常值上限合并FT3或FT4低于正常值下限;亚临床甲减症为:TSH 大于正常值上限合并FT3或FT4指标正常范围。
3 统计学方法 应用SPSS 19.0统计学软件进行分析,计量资料以(±s)表示,进行t检验;计数资料以[例(%)]的形式表示,进行χ2检验;应用Pearson相关性分析AOPP与各指标的相关性,以P<0.05表示差异有统计学意义。
结 果
1 研究对象一般资料 痛风患者根据影像学是否出现骨破坏,分为单纯痛风组与痛风合并骨破坏组,其中单纯痛风组36例,男30例,女6例;年龄26~70岁,平均(44.7±16.6)岁。痛风合并骨破坏组36例,男32例,女4例;年龄27~74岁,平均(46.2±17.3)岁。两组患者的年龄、性别等一般资料对比差异无统计学意义(P>0.05)。
2 痛风组与对照组甲状腺功能异常发生情况比较 与对照组对比,痛风组亚临床甲减发病率显著升高,两组比较差异有统计学意义(P<0.05),见表1。

表1 痛风组与对照组甲状腺功能异常发生情况比较[例(%)]
3 痛风组与对照组UA、CRP及氧化应激因子指标对比 与对照组对比,痛风组患者的UA、CRP 和AOPP显著升高,而SOD 显著降低,差异有统计学意义(P<0.05),见表2。
4 单纯痛风组与痛风合并骨破坏组氧化应激因子等指标水平对比 与单纯痛风组对比,痛风合并骨破坏组患者的AOPP、CRP 水平显著升高,SOD 水平显著降低,差异有统计学意义(P<0.05),两者血清UA 指标比较差异无统计学意义(P>0.05)。见表3。
表2 痛风组与对照组UA、CRP及氧化应激因子水平对比(±s)

表2 痛风组与对照组UA、CRP及氧化应激因子水平对比(±s)
注:与对照组比较,*P<0.05
组 别 n UA(μmol/L) CRP(mg/L) AOPP(μmol/L) SOD(U/ml)痛风组 78 494.1±56.9* 17.2±11.6* 160.7±14.2* 42.9±3.7*对照组 30 341.1±88.5 3.98±3.6 89.6±7.3 51.8±3.2
表3 两组病程、UA、CRP和氧化应激水平对比(±s)

表3 两组病程、UA、CRP和氧化应激水平对比(±s)
注:与单纯痛风组比较,*P<0.05
组 别 n 病程(月) UA(μmol/L) CRP(mg/L) AOPP(μmol/L) SOD(U/ml)单纯痛风组 36 12.8±6.2 473.6±45.9 10.5±4.6 151.6±5.5 44.1±2.5痛风合并骨破坏组 36 30.7±18.6* 519.9±59.6 18.4±10.4* 163.3±7.6* 40.9±1.3*
5 AOPP与各指标的相关性分析 经Person相关性分 析,AOPP 与病程、CRP、UA 及TSH 呈显著正相关(P<0.05),AOPP与SOD呈显著负相关,见表4。
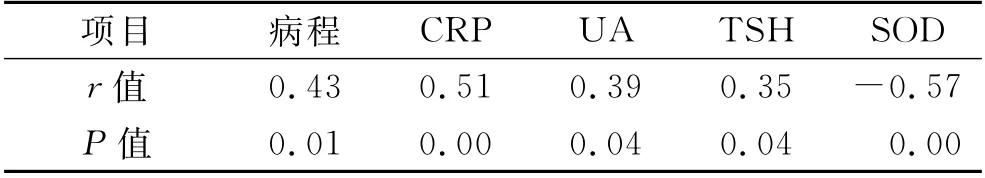
表4 AOPP与各指标的相关性
讨 论
痛风是尿酸盐晶体聚集沉积而诱导的关节炎,导致这种晶体沉积的病因有多种,主要与机体代谢性疾病、内分泌失常、饮食失衡等相关。最终导致关节和关节旁组织局部炎症发生,引起皮肤、软组织炎症、肿胀。随着病程的发展,晶体沉积部位可侵蚀骨和软骨,造成关节结构破坏,引起关节畸形和活动受限,更为严重者关节功能丧失,因反复局部皮肤破溃,软组织坏死引起肢体感染者需要截肢,最终造成严重的不良后果。
高尿酸血症是痛风诊断重要的血清学依据,尿酸水平升高可能与机体内分泌失调、甲状腺功能异常相关。甲状腺功能减退症是甲状腺激素合成分泌减少引发的一组综合征,TSH 分泌异常影响到甲状腺摄碘、络氨酸碘化、三碘和四碘原氨酸的合成以及甲状腺球蛋白的合成。FT3、FT4与甲状腺激素释放激素具有相互调节作用。甲状腺功能异常等相关疾病依靠于TSH、FT3及FT4联合分析来判断。当TSH 升高,FT3、FT4指标正常,但无症状和体征,诊断为亚临床型甲状腺功能减退症。本研究资料表明,痛风患者发生亚临床甲减发病率为12.5%,健康志愿者发生率为0%,提示痛风与亚临床甲状腺功能减退具有相关性。另外一方面,黄金重等[4]研究发现,甲状腺激素与机体血脂变化可能存在相互调节,部分痛风患者TSH 水平升高,对痛风的发生发展具有一定作用,与本研究结果相符。
正常机体将处于稳定而缓慢的氧化平衡状态,一旦因某种因素造成反应性氧化物浓度升高,发生局部或全身系统性损伤,通过相关作用因子而造成了氧化应激反应。致炎性细胞因子释放、T 淋巴细胞亚群失衡,细胞组织学病理损伤均与参与氧化应激的自由基过度产生相关,提示了自身免疫疾病发生发展过程中同时并存氧化应激[5-7]。而痛风是一种具有多项免疫因子参与的常见的自身免疫性炎症疾病,因此痛风发病与继发氧化应激可能相关。近年来研究也发现,痛风患者关节炎症的发病与介导炎症的氧化应激有关[8]。SOD 是天然的氧自由基清除剂,能够阻断脂质过氧化连锁反应,催化自由基发生歧化反应,从而起到保护细胞的作用。氧化应激过程中生成的重要产物是晚期氧化蛋白产物(Advanced oxidation protein products,AOPP),其升高的具体过程为:体内的变质蛋白质、DNA 和游离脂质等可被活性氧破坏,诱发机体的炎症反应后氧化应激终末产物AOPP 升高。有研究发现急性痛风发作与尿酸盐异常沉积相关外,炎症细胞因子释放和氧化应激作用可能在痛风急性发作机制中同样起着推动作用[9]。本研究发现,与对照组对比,痛风组患者的UA、CRP 和AOPP 显著升高,而SOD显著降低。由此提示了氧化应激反应参与了痛风疾病发作的过程。任广伟等[10]研究报道通过非布司他治疗急性痛风和高UA 水平过程中,氧化应激产物指标AOPP逐步下降,SOD 逐步升高,也说明随着痛风病情的改善,氧化应激反应逐步减轻的病理过程,与本文研究结论一致,均提示氧化应激也参与了痛风发作,是重要的发病机制。
有研究显示,实验通过AOPP 刺激骨细胞,骨细胞增值显著提高,并释放大量炎性细胞因子等介质促进骨质破坏发生,据此推测骨破坏的发生机制中氧化应激作用具有重要意义。本文进一步研究发现,与单纯痛风组对比,痛风合并骨破坏组患者的AOPP 水平、CRP显著升高,SOD 水平显著降低,差异有统计学意义,两者血清UA 指标无统计学差异。研究表明,痛风患者机体的骨代谢失衡与氧化应激参与有关,且严重的患者会诱发骨破坏加速[11]。同时,本研究还发现,病程较长的中晚期痛风患者,长期尿酸盐结晶沉积造成骨质破坏过程中,AOPP 指标水平对比有明显升高,提示氧化应激反应是痛风合并骨破坏的一个作用机制。同时发现痛风合并骨破坏组的患者SOD 减低,即氧化应激中SOD 保护作用减低,氧化应激终末产物升高,氧化应激参与了痛风合并骨破坏的发生。有研究发现,痛风性关节炎患者血清中异常升高的DKK-1能够引起关节骨质破坏、炎症反应及氧化应激反应激活,支持本项研究的结果[12]。
随着病程的延长,尿酸盐结晶的沉积,痛风发作的频率和严重程度逐渐增加,多项研究发现痛风发作期CRP明显升高,CRP与痛风病情具有一致性,同时,甲状腺激素指标升高会导致内分泌与代谢紊乱,从而促进骨吸收与抑制成骨,增加了骨破坏的风险[13-14]。有研究发现亚临床甲减在一定程度上存在腰椎、髋关节部位骨密度降低,甚至骨质疏松的发生,促甲状腺激素(TSH)水平的升高可能是骨质疏松症的危险因素[15-16]。AOPP是氧化应激过程中的晚期重要的代谢产物,本研究通过Person相关性分析显示,AOPP 与SOD 呈显著负相关,与CRP、UA、TSH 及病程呈显著正相关,提示氧化应激反应与痛风疾病中的病程、病情严重程度,UA 和TSH 水平均有一定联系。
综上所述,亚临床甲状腺功能减退症在痛风患者的发病率显著高于正常人,氧化应激反应与痛风病程、CRP水平及合并骨破坏存在显著相关性。氧化应激参与可能是痛风发作的一项重要机制,氧化应激反应与合并骨破坏、病程更长的痛风患者的发病具有相关性。

