沉默TUG1基因对肝门部胆管癌QBC939细胞增殖、凋亡及周期的影响
车 宇,梁 静,杨怡萍,廖 娟,王 蒨,蔡英全,邵 帅
陕西省肿瘤医院放疗科(西安710061)
肝门部胆管癌起源于肝门部胆管内皮,具有高度的侵袭性,其发病率占胆管癌总体发病率的50%~80%[1]。流行病学研究显示,近些年来肝门部胆管癌发病率呈现逐年增高的趋势,是恶性程度最高的肿瘤之一[2]。根治性手术为目前治疗肝门部胆管癌最有效的方法。然而,肝门部胆管癌起病隐匿,大多数患者就诊时已处于中晚期,由于肿瘤已发生远处转移,导致患者失去最佳治疗时机。此外,尽管中西医结合的综合治疗方案能显著延长肿瘤患者生存周期[3]。但是,肝门部胆管癌术后易发生局部复发,即使患者接受了根治性手术治疗和中西医结合综合治疗方案,术后5年生存率仍小于30%[4]。为了改善肝门部胆管癌的治疗效果,寻找与肝门部胆管癌发生、发展相关的分子靶点也显得尤为迫切。微小RNA(microRNA,miRNA)和长链非编码RNA(Long noncoding RNA,Lnc RNA)是非编码RNA 家族的两个主要成员。已有大量研究表明miRNA 在胆管癌发生、发展中起着至关重要的作用[5]。然而,关注LncRNA 在胆管癌发生发展中作用的相关研究尚不多见。Lnc RNA 为转录本长度大于200 nt 不具备蛋白编码功能的一类RNA[6]。研究表明,Lnc RNA 作为染色体组装、转录层面以及转录后层面的关键调控因子而参与几乎所有的生理进程[7-8]。牛磺酸上调基因1(Taurine-upregulated gene 1,TUG1)是大小为7.1 kb的LncRNA,首次发现于牛磺酸处理的小鼠视网膜细胞上调表达的基因中[9]。研究表明肝内胆管癌织中上调的TUG1 可通过竞争性结合miR-145 而促进肿瘤细胞增殖及转移[10]。然而,另有研究表明TUG1在乳腺癌中表达下调,并通过调控CyclinD1和CDK 的表达而抑制肿瘤细胞增殖[11]。但在肝门部胆管癌中TUG1的功能和潜在机制尚不清楚。本研究拟深入阐明肝门部胆管癌细胞系QBC939中TUG1表达及其对细胞增殖及凋亡的影响。
材料和方法
1 实验材料 TRIzol试剂购于碧云天生物技术研究所,RNA 反转录试剂购于Ta KaRa公司,TUG1-siRNA 由上海吉玛公司设计并合成,LipofectamineTM2000 试 剂 购 于Invitrogen 公 司,MTT 试 剂 盒 购 于Promega公司;FITC标记的Annexin-V及PI试剂购于BD公司,人肝内胆管上皮细胞系HIBEpic和肝门部胆管癌细胞系QBC939均购于中国科学院上海细胞库。
2 实验方法
2.1 细胞培养和转染:人肝内胆管上皮细胞系HIBEpic和肝门部胆管癌细胞系QBC939 采用1640培养液进行培养,其中含胎牛血清浓度为100μl/ml。细胞培养条件设置为温度37℃,CO2浓度设置为5%。当细胞汇合度至70%~80%行细胞转染操作。转染试剂为LipofectamineTM2000。配置转染反应液A:5 μl TUG1-siRNA 或TUG1 NC+250μl无血清培养基;配置转染反应液B:5μl转染试剂+250μl无血清培养基。将转染反应液A 与B混合,孵育15 min,逐滴滴加至QBC939细胞中。继续培养48 h后,收集细胞进行后续实验。将转染TUG1 siRNA 的QBC939细胞命名为TUG1-siRNA 组,将转染TUG1 NC 的QBC939细胞命名为TUG1-NC组。
2.2 TUG1表达水平检测:待肝门部胆管癌细胞转染TUG1-siRNA 及TUG1-NC 48 h后,收集细胞,用TRIzol裂解TUG1-siRNA 组、TUG1-NC 组细胞,分别提取各组细胞总RNA,反转录为cDNA 作为qRT-PCR 模板。配置qRT-PCR 反应液,TUG1正向引物及反向引物各1μl、2×qRT-PCR 反应液10μl、热启动Taq 酶1μl、cDN 模 板1μl、去 离 子 水6μl。qRT-PCR 的反应条件设置为:95℃5 min预变性,而后进行35个循环的95℃20 s变性,60℃30 s退火,68℃20 s延伸。根据2—ΔΔCt计算各组细胞中TUG1的表达水平。
2.3 MTT 法检测QBC939的增殖:QBC939 细胞转染TUG1-siRNA 及TUG1-NC 48 h 后,取对数生长期的TUG1-siRNA 组和TUG1-NC组细胞,吹散细胞至单细胞悬液,PBS清洗细胞后离心。离心机转速设定为1000 r/min,离心时间设定为5 min。再次重悬细胞,细胞计数后接种细胞至96孔板,每孔接种细 胞5000 个,每 组 细 胞 各 接 种9 孔,共 铺6 个96 孔板。将接种细胞后的96孔板置于同一细胞培养箱后分别培养1~6 d。在第1~6天相同时间点,分别取出一板细胞,加入20μl MTT 溶液(浓度预先调整为1.5 g/L)。将滴加MTT 溶液的细胞再次放回培养箱继续培养4 h。而后,加入120μl DMSO 溶液。细胞变色后,酶标仪读取TUG1-siRNA 组和TUG1-NC组吸光度值,绘制细胞生长曲线。
2.4 流式细胞仪检测QBC939细胞凋亡:取转染48 h 后 的TUG1-siRNA 组 和TUG1-NC 组QBC939细胞。胰酶消化后,吹散细胞至单细胞悬液,PBS 清洗细胞后离心。离心机转速设定为1000 r/min,离心时间设定为5 min。重复清洗及离心步骤3 次后,加入100μl流式洗液重悬细胞。在避光状态下向细胞中加入100μl 流式洗液和10μl Annexin-V 抗体(FITC标记,浓度预先调整为20μg/ml)。室温条件下避光反应30 min。而后,再次加入5μl的PI染料(浓度预先调整为50μg/ml),室温条件下避光反应15 min。加入2 ml流式洗液后离心,离心条件同前。重复清洗及离心步骤3 次后,加入500μl流式洗液,重悬细胞后,上流式细胞仪检测TUG1-siRNA 组和TUG1-NC组细胞凋亡情况。
2.5 流式细胞仪检测QBC939细胞周期:取转染TUG1-siRNA 及TUG1-NC 48 h后的TUG1-siRNA组和TUG1-NC组QBC939细胞。胰酶消化后,吹散细胞至单细胞悬液,PBS清洗细胞后离心。离心机转速设定为1000 r/min,离心时间设定为5 min。重复清洗及离心步骤3次后,加入100μl流式洗液重悬细胞。在避光状态下向细胞中加入5μl PI染料(浓度预先调整为50μg/ml)。在避光环境反应10 min后,加入400 μl 流式洗液。立即利用流式细胞仪检测TUG1-siRNA 组和TUG1-NC组细胞周期。
3 统计学方法 应用IBM SPSS 22.0统计学软件对本研究所得数据进行统计分析,计量资料以(±s)表示,应用t检验分析两组间数据的差异,以P<0.05视为差异具有统计学意义。
结 果
1 TUG1在人肝内胆管上皮细胞系与肝门部胆管癌细胞系中的表达 分别提取人肝内胆管上皮细胞系HIBEpic和肝门部胆管癌细胞系QBC939 细胞的总RNA,各自反转录为cDNA,荧光实时定量RTQPCR 检测各组间TUG1的表达,发现在QBC939细胞中TUG1表达较HIBEpic中明显上调(t=10.936,P<0.01),见图1。
2 TUG1-siRNA 下调QBC939细胞中TUG1的表达 转染TUG1-NC 及TUG1-siRNA 于肝门部胆管癌QBC939细胞48 h后,分别提取TUG1-NC组及TUG1-siRNA 组细胞总RNA,各自反转录为cDNA,荧光实时定量RT-QPCR 检测TUG1-NC 组及TUG1-siRNA 组中TUG1的表达,发现在QBC939细胞中,TUG1-siRNA 组中TUG1表达较TUG1-NC组明显下调(t=8.827,P<0.01),见图2。

图1 HIBEpic和QBC939细胞中TUG1表达水平
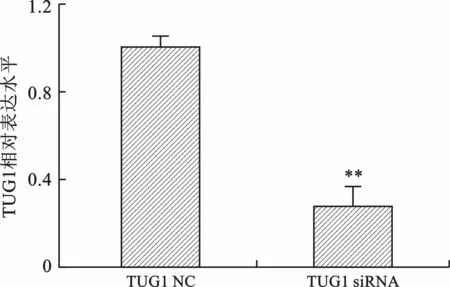
图2 qRT-PCR 检测TUG1 siRNA 的沉默效率
3 TUG1-siRNAs抑制QBC939 细胞的增殖 MTT 检测分别转染TUG1-NC与TUG1-siRNA 的QBC939细胞的细胞增殖能力差异,TUG1-siRNA 组细胞的增殖能力明显弱于TUG1-NC 组细胞,两组细胞增殖能力比较差异具有统计学意义(F=10.827,P=0.014),TUG1可显著促进QBC939细胞增殖,见图3。
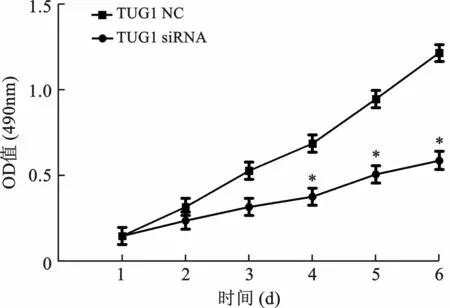
图3 TUG1-siRNA 抑制QBC939细胞增殖能力
4 TUG1-siRNAs促进QBC939 细胞的凋亡 流式细胞术检测分别转染TUG1-NC 与TUG1-siRNA 的QBC939 细胞的细胞凋亡水平差异,TUG1-siRNA 组细胞的细胞凋亡比例明显高于TUG1-NC组(t=3.291,P=0.028),提示TUG1可抑制QBC939细胞的凋亡,见图4。
5 TUG1-siRNAs阻滞QBC939细胞于G1期 流式细胞术检测分别转染TUG1-NC 与TUG1-siRNA 的QBC939 细胞的细胞周期分布差异,转染TUG1-siRNA 细胞的G1期细胞比例明显高于TUG1-NC组(t=3.293,P=0.023),而转染TUG1-siRNA细胞的S期细胞明显少于TUG1-NC组(t=2.892,P=0.027),见图5。
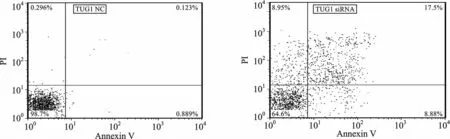
图4 TUG1-siRNA 增强QBC939细胞凋亡水平
讨 论
Lnc RNA 的发现已经极大的改变了我们对于肿瘤发病机制的认识。近来,越来越多研究表明肿瘤中异常表达的Lnc RNA 在肿瘤的发生、肿瘤细胞增殖、肿瘤侵袭等多方面扮演着重要的作用[12-13]。LncRNA MALAT1可通过竞争性结合miR-204 表达而调控CXCR4的表达,从而促进肝门部胆管癌细胞增殖、侵袭 及 转 移[14]。LncRNA-PVT1 通 过 与PCR2 复 合 体结合而调控ANGPTL4组蛋白甲基化水平,从而抑制其表达的表达,进而促进胆管癌细胞增殖抑制其凋亡[15]。另有研究发现Lnc RNA EPIC1在胆管癌患者组织中表达异常上调,并可通过抑制Myc的表达而促进胆管癌细胞增殖及克隆形成能力[16]。然而,目前肝内胆管癌发生及进展过程中LncRNA 所发挥功能的相关报道尚不多见。

图5 TUG1 siRNA 阻滞细胞周期于G1期
本研究检测了人肝内胆管上皮细胞HIBEpic与肝门部胆管癌细胞系QBC939中TUG1的表达,实验发现TUG1 在QBC939 中的表达显著高于HIBEpic中的表达,提示TUG1可能在肝门部胆管癌发生发展中发挥着重要的作用。最新研究显示,LncRNA 的表达可被一些转录因子调控。TUG1被证实作为肿瘤抑制LncRNA 并 被p53 调 控[17]。然 而,另 有 研 究 报 道TUG1 可作为致癌LncRNA 被转录因子SP1 调控[18]。为了进一步明确TUG1在肝门部胆管癌发生、发展中的作用,我们利用RNA 干扰技术沉默QBC939细胞中TUG1的表达,研究TUG1对肝门部胆管癌细胞增殖、凋亡、周期的影响。实验发现沉默QBC939细胞TUG1的表达可导致细胞增殖能力明显降低,以上结果提示TUG1 可以增强肝门部胆管癌肿瘤细胞生长。与此同时,本研究还发现细胞凋亡水平的增加、G1期细胞比例增多、S 期细胞比例减少,可能是TUG1-siRNA 抑制肝门部胆管癌细胞的潜在机制。以上结果提示TUG1可能通过调控细胞凋亡和周期而促进肿瘤细胞增殖。
综上所述,本研究检测了正常肝内胆管上皮细胞与肝门部胆管癌细胞中TUG1 的表达差异,并利用RNA 干扰技术沉默QBC939 细胞中TUG1 的表达,检测TUG1 在QBC939 细胞增殖、凋亡、周期中的作用。研究发现沉默TUG1 表达可以抑制肝门部胆管癌细胞增殖,促进肝门部胆管癌细胞的凋亡,并诱导细胞周期阻滞于G1期。本研究为进一步研究肝门部胆管癌发生及进展过程中TUG1所发挥的调控作用的潜在机制奠定了初步的理论基础,也同时有望为肝门部胆管癌的分子治疗提供潜在靶点。

