超声造影参数成像在甲状腺微小乳头状癌鉴别诊断中的应用价值*
王双龙,吕 镔,李 龙,马香玲,赵 蕊,高小红,庞 慧
山东省济宁市第一人民医院超声科(济宁272011)
近年来,随着国内健康体检的广泛开展、甲状腺高分辨率超声检查的普及,甲状腺癌的检出率明显上升,其中以甲状腺微小乳头状癌(Papillary thyroid microcarcinoma,PTMC)增长为主且最快[1],PTMC 是指肿瘤最大直径不大于1 cm 的甲状腺乳头状癌,大部分PTMC 预后良好,但仍有部分具有明显的侵袭性[2],如颈部淋巴结转移、远处转移、术后复发等,因此早期明确诊断并给予相应临床建议或治疗具有重大社会和经济效益。本文应用超声造影参数成像检测≤1.0 cm 甲状腺结节,并与手术病理结果对照,旨在探讨超声造影参数成像在PTMC鉴别诊断中的应用价值。
资料与方法
1 一般资料 回顾性分析2018 年1 月至2019年12月在本院术前行超声造影检查的45 个患者共60个甲状腺小结节的超声造影及临床资料,其中男性14例,女性31例,年龄20~71岁,平均年龄(47.6±14.7)岁。病例纳入标准:甲状腺结节最大径≤1.0 cm;实性或实性为主结节;经手术病理结果确诊;签署超声造影知情同意书。排除标准:超声造影图像不满意;囊性或囊性为主结节;内含粗大钙化结节。依据病理结果将结节分为良性组与恶性组。
2 研究方法
2.1 超声造影检查:患者仰卧位,充分暴露颈部。使用百胜Esaote Mylab Twice彩色多普勒超声诊断仪,常规及彩色多普勒超声检查应用线阵探头LA523,频率4~13 MHz,超声造影采用LA332,频率3~11 MHz,首先行常规及彩色多普勒超声检查,选择病灶内部血流最为丰富切面,打开超声造影成像模式,设定机械指数(MI)<0.1,经肘静脉团注造影剂(声诺维,Sono Vue)2.0 ml,随机快速注入生理盐水5 ml,同时存储超声造影图像时间大于2 min,整个过程中嘱患者平静呼吸并避免吞咽,超声造影切面保持不变。如果患者为多个结节,对符合纳入标准的结节分别进行超声造影检查。
2.2 图像处理与分析:将甲状腺结节超声造影形成的医学数字成像和通信(DICOM)标准图像数据导入QontraXt软件,对每个结节进行后处理分析。手动勾勒出结节外缘选定为感兴趣区(Region of interest,ROI),选择造影剂注入方式为快速团注Gammavariate(bolus),得到整个结节的时间-强度曲线(Time intensity curve,TIC),并可得到如下参数:灌注峰值(Peak,%)、达峰时间(TP,ms)、灌注率(Shapness,1/s)、曲线下面积(AUC,1/s),见图1。
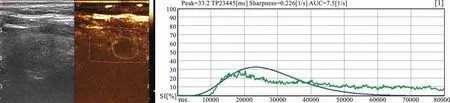
图1 超声造影感兴趣区的勾勒及时间强度曲线(TIC)
3 统计学方法 使用SPSS 17.0统计学软件进行数据的分析和处理,计量资料以均数±标准差(±s)表示,计量资料的比较采用独立样本t检验,ROC 曲线分析获取诊断PTMC最佳截断值(Cutoff值),以P<0.05 为差异有统计学意义。
结 果
1 良恶性组超声造影定量参数对比 恶性组Peak、AUC显著小于良性组,差异有统计学意义(P<0.05),TP、Shappness良恶性组之间差异无统计学意义(P>0.05),见表1。
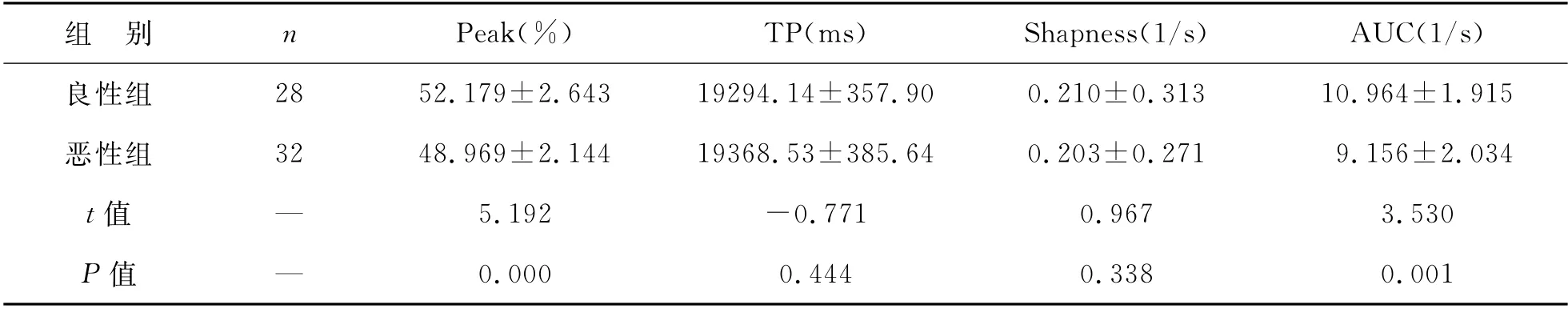
表1 良恶性组超声造影TIC曲线定量参数比较
2 超声造影定量参数诊断甲状腺癌的诊断效能 以Peak、AUC 参数分别为诊断PTMC 标准时,Peak、AUC 诊 断PTMC 的ROC 曲 线 下 面 积 分 别 为0.819和0.738,最佳截断值(Cutoff值)分别为50.25和9.5,Peak 诊断PTMC 的敏感性、准确度高于AUC,见图2、表2。
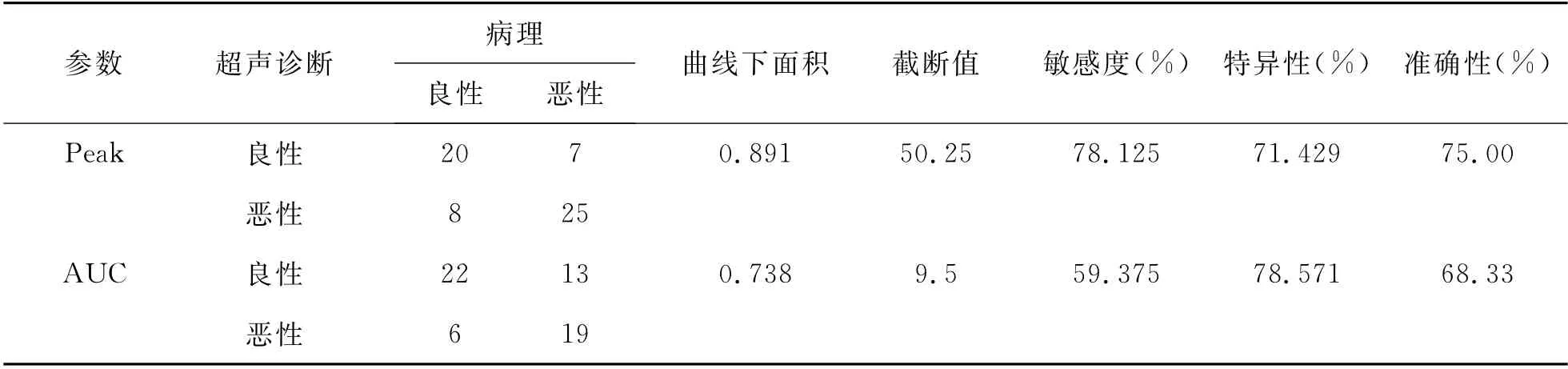
表2 CEUS造影参数Peak、AUC诊断甲状腺微小乳头状癌效能

图2 CEUS参数诊断甲状腺微小乳头状癌ROC曲线
3 病理结果 45例患者中,单发结节患者35例(77.8%),多发结节患者10 例(22.2%)。60 个结节中,良性结节28个(46.7%),其中结节性甲状腺肿22个,甲状腺腺瘤2个,桥本氏甲状腺炎3个,亚急性甲状腺炎1个;恶性结节32个(53.3%),均为甲状腺乳头状癌。
讨 论
甲状腺癌是最常见的内分泌恶性肿瘤,其中又以PTMC发病率最高[3],国内专家共识认为甲状腺结节的大小并非评判肿瘤侵袭和转移的唯一指标,临床常见PTMC侵出被膜或侵犯周围重要组织,也可出现中央区甚至颈侧区淋巴结转移,因此专家共识认为>5 mm 的PTMC为手术切除的相对适应证,虽然对于<5 mm 的PTMC建议可以选择密切观察,但有众多限制条件,并且在观察过程中肿瘤直径增大超过3 mm、发现临床淋巴结转移时应尽早手术[4]。因此,对于≤1.0 cm 的甲状腺结节,早期、准确的明确结节性质具有重要临床意义,明确诊断将有助于医生根据临床特点制定相应治疗方案,决定手术亦或密切观察,以期使患者获益最大化。
超声造影技术是一种真正意义上的血池造影,经静脉注射的造影剂能够到达各个器官的微血管,但不会像CT、MRI一样进入组织间隙,即超声造影没有实质相[5],同时,超声造影利用背向散射原理,能够明显提高进入组织微血管内造影剂显示效果,因此可以很好的评估器官内微循环情况,这亦是其可以评估肿瘤良恶性的病理基础[6]。目前超声造影技术已广泛应用于肝、肾、前列腺、乳腺等肿瘤的定性定量诊断[7-9],评估肿瘤消融、化疗的治疗效果[10-11],有学者研究亦发现可用于器官缺血再灌注的评估等[12]。超声造影目前亦已应用于甲状腺结节良恶性的鉴别诊断,对甲状腺良恶性的鉴别诊断具有较好的临床应用价值[6,13]。
超声造影参数成像是利用软件对超声造影图像进行定量分析,获得时间-强度曲线(TIC)曲线及参数,可直观的显示病灶不同区域的增强时间及强度等参数,避免了主观因素的影响[14]。本研究的研究对象为≤1.0 cm 的甲状腺结节,结节较小,其评判易受主观因素影响,因此应用客观的TIC 曲线及其参数能够得到更好的研究结果。
Peak指灌注峰值,是结节感兴趣区造影剂进入的峰值量,能够反映结节内部微血管的分布情况。本研究恶性结节Peak值较良性结节明显低,分析原因可能是甲状腺乳头状癌新生血管内皮分化程度低,功能不成熟,走形紊乱,其内较多乳头分支及夹杂着纤维组织压迫新生血管使新生血管储存血液功能减低;同时,肿瘤细胞生长旺盛并具有侵袭性,但功能不成熟的新生血管无法满足肿瘤细胞对血液的需求,导致细胞缺血坏死,局部形成微小栓子阻塞血管,使新生血管功能丧失[15],这两种原因导致结节内微血管恶性较良性结节分布少。
AUC指TIC 曲线下面积,是一定时间内通过结节感兴趣区造影剂的量,能够反映结节内血流灌注总量。本研究恶性结节AUC 值虽然较良性结节低,两者间差异有统计学意义,对鉴别良恶性有一定价值,但其诊断效能不如Peak,敏感性、准确度均低于AUC,分析其原因可能是AUC 与灌注和廓清时间的有关,容易受造影剂在结节内灌注和廓清快慢的影响。因此PI对PTMC的诊断效果最好。
TP、Shapness分别指达峰时间、灌注率,这两个指标均与结节内造影剂灌注快慢有关,本研究分析显示,这两个参数良恶性结节间差异无统计学意义,不能用于PTMC的鉴别诊断,分析其原因可能是受灌注快慢患者个体差异差异影响,从而导致无明确鉴别诊断。
本研究的研究对象不包含囊性或囊性为主以及含钙化结节,是因为CEUS为血池造影,反应结节内部血供情况,而囊性或囊性为主结节囊壁或者实质部血供较少,含粗大钙化结节在预实验时发现造影剂进入后影响结节实性部分显像,CEUS无法明确反应这两种结节内部情况,因此将这两种结节排除在外。
综上所述,超声造影参数Peak、AUC在PTMC在鉴别诊断中均具有重要价值,并且均有其病理学基础,相比而言,Peak鉴别诊断PTMC 的敏感性、准确性更高,具有更大的价值,有望在临床推广应用,指导临床治疗方案的选择。

