不同时间锁骨下动脉缺血对大鼠臂丛神经损伤电生理研究
贾晓川 颜继英 李毅 刘振武
锁骨下动脉损伤在临床工作中并不少见,而且近年来有逐渐上升的趋势。致伤原因多为车祸伤、机器挤压、枪击或锐器伤所致,且多为多发伤,可能合并失血性休克、血气胸、颅脑损伤、肩部骨折等[1,2]。在救治早期,临床处理的重点为救治失血性休克、颅脑损伤等危及生命的病症和修复肢体血管的保存肢体,往往忽视了对臂丛损伤的早期诊断及处理。锁骨下动脉损伤后,上肢可通过侧支循环代偿来获得部分血液供给,虽然一般不会造成上肢坏死,但由于供血不足,上肢呈不全缺血的表现:(1)动脉搏动减弱或消失;(2)远端肢体疼痛;(3)皮肤苍白青紫,皮温降低;(4)感觉麻木;(5)肌肉麻痹。随着缺血时间的延长,肌肉可逐渐出现纤维化,常可表现为前臂皮温降低、肌力下降[3]、耐力减弱,进而产生肌肉部分坏死、渐进性纤维化等[4]。上肢神经也逐渐呈现缺血变性的表现,造成肢体遗留严重的功能障碍。本研究根据大鼠与人上肢神经、血管结构的相似性,通过建立不同时间下大鼠锁骨下动脉损伤的动物模型,观察锁骨下动脉损伤后臂丛神经损伤电生理改变,希望能够为临床医生治疗血管高位损伤及神经慢性缺血变性性疾病提供有力的理论支持。
1 材料与方法
1.1 动物模型及分组 实验动物为健康(SD)大鼠,清洁级,体重250~300 g。实验过程中对动物处置符合2006年科学技术部发布的《关于善待实验动物的指导性意见》。随机分为2组,每组50只。所有大鼠均按35 ml/kg水合氯醛腹腔麻醉,麻醉满意后,将大鼠固定于实验台上,颈肩部备皮,碘伏消毒。对照组大鼠于锁骨下行长约1 cm切口,暴露并切断胸大肌、胸小肌,显露臂丛神经及锁骨下动脉,显微镜下分离锁骨下动脉,注意保护臂丛神经,将锁骨向上牵拉显露锁骨下动脉第2、3段交界处,于该段锁骨下动脉和臂丛神经之间放置血管夹,但不阻断动脉,保持动脉血流量在正常范围。逐层缝合胸大肌及皮肤。实验组基本操作同对照组。但是血管夹完全夹闭锁骨下动脉,阻断锁骨下动脉血流,分别于第1小时、3小时、6小时、12小时、30小时分5个时段随机抽取10只实验动物,进行电生理检查,处死后取材神经组织固定后行组织学检查。
1.2 主要仪器 Viking Quest肌电仪(丹麦Dantec公司),手术显微镜(德国麦迪塞姆仪器公司),光学显微镜(日本OLYMPUS)。
1.3 检测指标
1.3.1 神经电生理测量:分别于阻断锁骨下动脉血流第1小时、3小时、6小时、12小时、30小时分5个时段,再次麻醉后打开伤口,暴露臂丛神经及血管,游离正中神经约2 cm,用Viking Quest肌电仪检测正中神经神经干潜伏期、振幅。本实验标本取材长度有限,刺激电极和接受电极相距较近,易受到容积导电的影响,若测定传导速度误差较大,故采用潜伏期和最大运动诱发电位两项指标检测神经再生。潜伏期的测定避免了测量表面距离的误差,而振幅的检测能反映出传导兴奋的轴突数量。
1.3.2 光镜检查:于前臂中远端取正中神经制作标本。采用1%锇酸、4%多聚甲醛液固定后包埋,超薄切片机切片,厚4 μm,在40倍视野下观察视野内髓鞘的数目、着色深浅以及髓鞘的完整性。
1.3.3 肌肉Na+-K+-ATP酶活性测定:切取部分前臂屈肌,并剔除肌膜,冰冻保存。配置基质液及显色剂,按重量体积比制成10%的匀浆,再取一定量的10%的匀浆加9倍的0.9%氯化钠溶液制成1%的组织匀浆,同时用考马斯亮懒试剂测定组织蛋白。测定Na+-K+-ATP酶活性,Na+-K+-ATP酶活力=(测定管OD值-对照管OD值)/(标准管OD值-空白管OD值)×标准管浓度(0.02 μmol/ml)×6×7.8÷匀浆蛋白含量。

2 结果
2.1 潜伏期及最大运动诱发电位振幅 实验组不同时段正中神经潜伏期较对照组均延长,差异有统计学意义(P<0.05)。实验组缺血第6小时与第12小时、30小时组组间无明显差异,其余组间差异有统计学意义(P<0.05)。实验组振幅较对照组均降低,差异有统计学意义(P<0.05),实验组不同时间两两比较,缺血第12小时组与缺血第30小时组组间无明显差异,其余组间差异有统计学意义(P<0.05)。见表1、2。

表1 不同缺血时间潜伏期比较
注:与第1小时比较,*P<0.05;与第3小时比较,#P<0.05

表2 不同缺血时间最大运动诱发电位振幅比较
注:与第1小时比较,*P<0.05;与第3小时比较,#P<0.05;与第6小时比较,△P<0.05
2.2 神经组织学观察 光镜检查:40倍光镜下对每个标本随机摄取五个视野,实验组与对照组相比,有髓神经排列整齐,形态规则,髓鞘薄厚均匀,无水肿。实验组的有髓神经数目与对照组相比,无明显改变。见图1。
2.3 肌肉Na+-K+-ATP酶活性测定 实验组不同时间肌肉组织Na+-K+-ATP酶活性较对照组明显降低(P<0.05)。实验组不同时间两两数据比较,差异有统计学意义(P<0.05)。见表3。
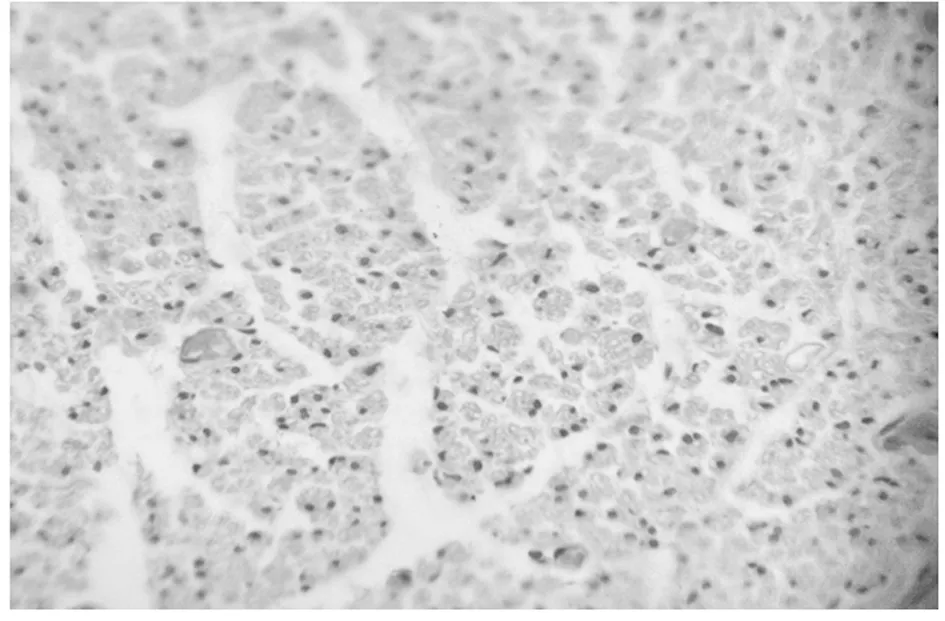
图1 光镜检测有髓神经排列整齐,形态规则,髓鞘薄厚均匀(HE×40)

表3 不同缺血时间Na+ -K+-ATP酶活性比较
注:与第1小时比较,*P<0.05;与第3小时比较,#P<0.05;与第6小时比较,△P<0.05;与第12小时比较,☆P<0.05
3 讨论
锁骨下动脉有胸骨及锁骨的保护,即使损伤,由于肩关节周围具有丰富的血管网,患侧肢体的血运仍可通过侧支循环网实现代偿,肢体仍可存活[5],且因手术探查及修复存在相当的困难和风险,故临床医生对修复血管的必要性缺乏重视。然而锁骨下动脉损伤后局部血肿或继发性出血也可导致胸廓出口处神经受压,继发臂丛神经损伤。在急诊抢救过程中,由于经验不足,可能会忽视了对锁骨下动脉及臂丛神经损伤的早期诊断及处理,二期修复不仅增加了手术难度,而且失去了最佳治疗时机[6]。后期手术行神经松解效果差,故早期发现并处理锁骨下动脉的损伤尤为重要[7,8]。
根据动脉供应不同可将臂丛神经椎管外区域分为3个区:Ⅰ区为经由臂丛神经根延伸至上、中、下干及其前后股区域。该区以椎动脉及颈深动脉供血为主,肋颈干及甲状颈干也参与部分供血。椎动脉供血以颈5~7根部为主,肋颈干、颈深动脉的供血以C7~T1为主。Ⅱ区为股与束的大部分区域,该区供血以肩胛背动脉分支及锁骨下动脉营养支为主。Ⅲ区为束的小部分区域及终末支,该区供血以腋动脉直接营养支为主。胸肩峰动脉、肩胛背动脉及肩胛下动脉等也参与供血。各个区域无严格界限,三个区域之间血供相互代偿[9,10]。臂丛神经[11]和锁骨下动静脉在胸廓出口处解剖关系紧密,在行经胸廓出口处经过2个连续的狭窄通道,(1)斜角肌间隙,呈三角形结构,前方为前斜角肌,后方为中斜角肌,下为第一肋骨;(2)肋锁间隙,由锁骨、肩胛骨和第一肋构成,通过臂丛神经、锁骨下血管、淋巴管、胸大肌、胸小肌等。严重创伤致锁骨、第一肋或肩胛骨骨折后,容易致锁骨下血管损伤,血管破损后出血量大,使胸廓出口内容物增加,容积相对减少,压迫臂丛神经,可继发臂丛神经损伤。本实验依据大鼠与人体解剖的相似性,以血管夹阻断右侧锁骨下动脉第二段,出现肢体发凉,颜色苍白,红白反应迟缓等缺血的表现,但肢体未发生坏死。肌电图证实神经传导受到抑制[12,13],证明该段血管损伤可造成肢体不完全缺血。但本实验研究的是短时间内缺血对大鼠臂丛神经电生理影响的变化,今后可设计长时间缺血对臂丛神经电生理的影响。
周围神经缺血将导致神经发生退行性改变。神经干对缺血的反应灵敏,短时间即可出现神经传导功能障碍,神经所支配的肢体末端感觉减退、肌力减弱。Guve等[14]报道了SD大鼠的神经传导功能变化:阻断血流30s即有传导速度减慢,缺血1 h后再灌注的复合肌肉动作电位的波幅迅速恢复,缺血第3小时再灌注时复合肌肉动作电位的波幅异常持续存在。周围神经缺血可导致其相关神经元胞体逆行性变性甚至死亡,其病理组织学检查表现为线粒体肿胀、高尔基复合体扩张、粗面内质网脱颗粒、变性严重的细胞体积缩小、核膜溶解濒于死亡。有研究表明:神经营养因子对神经纤维的生长、发育、再生和神经元胞体功能的维持有重要的调控作用[15]。这些营养因子通过逆向轴浆运输至胞体发挥其生物学效应,所以神经纤维受损后所发生的逆行性胞体变性是由神经营养因子供给障碍导致。当神经的血液供应被阻断后,神经纤维能量供应不足,神经纤维轴浆运输速度减慢、停止,造成轴索维持和再生的物质来源中断[16]。在本实验中,上肢缺血第1小时,正中神经潜伏期延长,波幅降低,传导速度减慢。随着缺血时间的延长,神经传导速度继续降低。但缺血一段时间后,神经传导速度维持在一个较低的水平,说明神经对缺血有一定的耐受性。本实验缺血第12小时组与缺血第30小时组神经潜伏期与波幅虽较对照组降低,证实缺血第12小时、第30小时有显著性差异。但缺血第12小时组与第30小组2组组间比较无显著性差异。本实验设计时主要研究短时间的缺血对臂丛神经的影响,未研究长时间缺血对臂丛神经影响的变化。由于观察时间较短,本试验中缺血后短时间内神经组织学观察无明显变化。
缺血对骨骼肌的影响:周围神经缺血损伤后,骨骼肌失去神经营养因子及废用而逐渐发生萎缩,肌肉的形态结构、生理生化以及新陈代谢等方面也随之发生改变。臂丛神经损伤位置较高,到靶肌肉的距离较长,且神经再生速度缓慢,靶肌肉长时间得不到有效的神经营养和支配,将发生不可逆的结构改变和功能障碍,如肌肉萎缩和纤维化、运动终板变性甚至消失等。缺血可加速失神经支配骨骼肌肌细胞线粒体、肌质网及细胞核的退变,骨骼肌由于缺血缺氧,细胞膜和线粒体功能障碍,使能量代谢失调,ATP生成不足,依赖于ATP供能的Na+-K+-ATP及Ca2+-ATP酶活性下降,能加速失神经支配肌肉萎缩的进程;而肌肉组织缺血缺氧,成纤维细胞和胶原纤维增生明显,阻碍再生神经重新支配骨骼肌,使神经无法与变细的骨骼肌纤维接触,不利于骨骼肌获得神经再支配后的功能恢复[17,18]。本实验中,实验组骨骼肌Na+-K+-ATP酶活性较对照组降低,有显著性差异。证实肢体缺血后,可导致线粒体功能障碍,ATP生成不足,使依赖于ATP供能的Na+-K+-ATP酶活性下降。
本实验中锁骨下动脉损伤后,大鼠患肢未发生坏死,但患肢皮温低,红白反应迟缓,证明锁骨下动脉损伤后,肩关节网等侧支循环不能为上肢提供足够的供血,肢体呈现不完全缺血的表现。锁骨下动脉损伤后,神经潜伏期延长,波幅降低,肌肉Na+-K+-ATP酶活性减低,证明锁骨下动脉损伤可导致臂丛神经缺血,影响神经传导功能,但随着缺血的时间进一步延长,神经传导速度不会进一步减慢,说明神经对缺血有一定的耐受性。对于血管高位损伤,不应以肢体远端能否成活为标准,提倡应早期修复修复损伤血管,恢复患肢血供,有利于患肢的功能恢复[19]。

