大田不同水分条件对蒙古黄芪生长及品质的影响
胡娅婷 徐志超 田亚


摘要 目的:探讨不同水分条件对蒙古黄芪生长发育及次生代谢物含量的影响,为研究蒙古黄芪品质提升及代谢调控机制奠定基础。方法:以蒙古黄芪为试验材料,开展大田试验,设置常规水分条件(CK)、轻度干旱胁迫(A1)、重度干旱胁迫(A2)3个不同处理,考察了不同水分胁迫下蒙古黄芪的株高、根长、商品根长、根鲜重等性状,并采用高效液相色谱法分析蒙古黄芪有效成分含量的变化规律。结果:轻度干旱胁迫时,黄芪株高较对照组降低7.60%、但根长提高11.23%,根鲜重提高26.07%,商品根长提高10.40%;在重度干旱胁迫下,株高、根长、商品根长、根鲜重较对照组均降低,分别为13.67%、12.60%、17.05%、5.5%;HPLC结果显示轻度干旱胁迫下毛蕊异黄酮葡萄糖苷含量比对照组高11.74%;重度干旱胁迫下毛蕊异黄酮葡萄糖苷含量比对照组低19.93%。而在干旱胁迫下毛蕊异黄酮含量与对照组差异不大。结论:轻度干旱胁迫能够有效促进黄芪幼苗生长并提高黄芪药材品质,为蒙古黄芪规范化种植技術提供参考。
关键词 蒙古黄芪;干旱胁迫;生长;次生代谢物;毛蕊异黄酮;毛蕊异黄酮葡萄糖苷;品质;HPLC
Abstract Objective:To explore the effects on the growth and development and secondary metabolite content of Astragalus membranaceus var.mongholicus under under different water contents,and to lay a foundation for quality improvement of Astragalus membranaceus var.mongholicus and metabolism regulation mechanism.Methods:By using Astragalus membranaceus var.mongholicus as the test material,the test was conducted in the field.A total of 3 different drought treatments[regular soil-water content (CK),mild drought stress (A1),and strong drought stress (A2)]were applied to investigate the plant height,root length,commercial root length,fresh root weight and other characteristics of Astragalus membranaceus var.mongholicus under above different water stress.And the High Performance Liquid Chromatography(HPLC)was used to analyze the law of change of active components in Astragalus membranaceus var.mongholicus.Results:Under mild drought stress,the plant height of Astragalus membranaceus var.mongholicus was significantly reduced by 7.60% compared with the control group.But the root length was significantly increased by 11.23% and the fresh root weight was significantly increased by 26.07%.The commercial root length was significantly increased by 10.40%; under severe drought stress,plant height,root length,commercial root length and root fresh weight were significantly reduced compared with the control group,which were 13.67%,12.60%,17.05% and 5.5%,respectively.HPLC results showed that,the content of Calycosin-7-glucoside was 11.74% higher than that of control group under mild drought stress,however,the content of Calycosin-7-glucoside was 19.93% lower than that of control group under severe drought stress.The content of calycosin was not significantly different from that of the control group under drought stress.Conclusion:Mild drought stress can effectively promote the growth of Astragalus membranaceus var.mongholicus seedlings growing and improve the quality of the Radix Astragali seu Hedysari medicinal materials,so as to provide reference for the standardized planting technology of Astragalus membranaceus var.mongholicus.
Keywords Astragalus membranaceus var.mongholicus; Drought stress; Growth; Secondary metabolites; Calycosin-7-glucoside; Calycosin; Quality; HPLC
植物的生长往往会受到不同程度的环境胁迫。在长期的进化过程中,植物通过形态结构的改变、生理和生化上的策略调整来适应逆境条件对植物自身带来的不利影响[1-2]。干旱是影响植物生长、发育乃至生存的重要环境因子,通常会造成植物的各项生理指标大幅度降低,并进一步降低作物产量[3]。对药用植物来说,干旱是自然界危害最大的非生物胁迫,对药用植物的品质、生长发育和各项生理生化指标有重要影响[4]。药用植物的品质由药效活性成分的含量和外观性状决定,从生理生化方面已有研究证实不同程度的干旱胁迫能够有效提高或抑制药用植物活性成分的积累。根系是吸收水分的主要器官,对于根类药材来讲,水分是影響药材产量和质量的重要环境因子。研究表明,适宜的干旱胁迫能促进根系生长,并能诱导次生代谢过程,提高药效成分含量。当水份亏缺时可严重影响植物生长和代谢过程,进而影响产量和体内次生代谢产物的积累[5-6]。
黄芪是我国传统补益类中药材,本品为豆科植物蒙古黄芪Astragalus membranaceus (Fisch.)Bge.var.mongholicus(Bge.)Hsiao或膜荚黄芪Astragalus membranaceus (Fisch.)Bge.的干燥根[7]。黄芪主产于我国北方地区,如东北、华北、西北和内蒙古等地区[8]。黄芪主要含黄芪皂苷类、黄酮类和多糖类等多种生物活性物质,毛蕊异黄酮和毛蕊异黄酮葡萄糖苷是当前我国黄芪质量评价的主要参考物质[8]。化学成分决定药用价值,现代药理学研究[9-10]表明,黄芪具有提高机体免疫力、强心降压、降血糖、抗肿瘤、抗病毒、抗氧化等多种药理功效,能促进免疫器官功能和抗体生成。黄芪不仅在临床治疗上发挥重要作用,在保健品、食品、化妆品等其他领域也得到广泛使用[11-12]。当前市场对黄芪最大需求主要体现在各类黄芪制剂及以黄芪为原料的各种保健品生产等方面,以黄芪为主的新药研发不断取得新突破,且野生资源遭到严重破坏不能满足市场需求,只能通过大量的人工栽培黄芪满足市场需求。干旱影响黄芪生长发育与药材品质,本试验旨在研究不同程度的干旱胁迫对蒙古黄芪生长以及主要活性成分含量的影响,为黄芪规范化种植提供参考。
1 材料与试药
1.1 仪器 高效液相色谱仪(Shimadzu公司,日本,型号:LC-20A);高通量粉粹机(宁波新芝生物科技股份有限公司,型号:SCIENTZ-48);微量移液器(Eppendorf公司,型号:Eppendorf Research Plus);台式离心机(Sigma公司,型号:1-14);万分之一电子天平[赛多利斯科学仪器(北京)有限公司,型号:BSA3202S];数控超声波清洗器(昆山市超声仪器有限公司,型号:KQ5200DV);电热鼓风干燥箱(天津市泰斯特仪器有限公司,型号:WGL-65B)。
1.2 试剂 色谱乙腈(Fisher Chemical公司,批号:155805),色谱甲醇(Fisher Scientific公司,批号:110939),分析纯甲醇(北京化工厂,批号:20190106),娃哈哈纯净水、毛蕊异黄酮(Solarbio公司,批号:SC9010)、毛蕊异黄酮葡萄糖苷(Solarbio公司,批号:SM9370)。
1.3 分析样品 2年生蒙古黄芪,由内蒙古呼和浩特市和林格尔县盛齐堂黄芪种植基地提供。
2 方法与结果
2.1 试验地概况 设试验田位于内蒙古呼和浩特市和林格尔县盛齐堂黄芪种植基地(40°21′N,111°56′E),海拔1 000~1 500 m。当地属于中温带半干旱大陆性季风气候,其主要特征是干旱、多风、寒冷,日光充足,温差大。年平均气温在6.2 ℃左右。1月平均气温为-12.8 ℃,极端气温为-31.7 ℃,7月平均气温为22.1 ℃,极端最高气温为37.9 ℃。历年平均降水量为392.8 mm,1天内降水量为99.1 mm[13]。根据实验田土壤质检报告,试验田土壤质地为沙壤土,有良好的排灌条件,土壤基础理化性质:有机质为0.40%;氮含量为25~87 mg/kg;磷为20 mg/kg;钾为61.0 mg/kg,含量最高可达220 mg/kg;钙为1 259.1 mg/kg;土壤的pH值检测均为微碱性。
2.2 试验材料处理 蒙古黄芪种子于2016年9月采收自内蒙古呼和浩特市和林格尔县盛齐堂黄芪种植基地。存放在通风、阴凉、干燥的储藏环境。蒙古黄芪种子千粒重(6.92±0.10)g,品种纯度及净度等其他指标均达到《中华人民共和国种子法》的相关要求。2017年4月下旬,对种子进行催芽,先将种子浸于50 ℃温水中搅动,待水温降至40 ℃后浸泡24 h,涝出洗净用湿布覆盖,种子膨大或种皮破裂时进行播种。5月上旬将种子拌适量细沙,均匀撒入3 cm深的播种沟内,覆土1~1.5 cm,稍加镇压。5月下旬出苗,正常供水2个月后,选择生长良好,大小一致的幼苗移至大棚,大棚温度常年控制在25~28 ℃,湿度40%左右,培育1年。选择根茎饱满,主根长且直,生长良好,大小一致的一年生幼苗于2018年4月20日起苗移栽至大田,平垄种植,垄面宽60 cm,垄间距25 cm,每垄3行,株距27 cm,种植密度为16 500株/hm2。缓苗后于7月1日开始进行控水处理,至11月上旬黄芪地上部枯萎结束试验。
2.3 试验设计 试验采用完全随机区组设计。共设3种水分处理,包括常规水分条件(CK:浇灌时间为正常灌溉时间的100%)、轻度干旱胁迫(A1:浇灌时间为正常灌溉时间的50%)、重度干旱胁迫(A2:雨养不浇水)3个不同处理,每个处理3次重复,共9个小区,小区面积为40 m2(5 m×8 m),各小区间设置1~1.5 m隔离带。移栽前统一浇足底墒水,缓苗后根据试验设计的水分处理时间开展试验,正常灌溉处理1月1次,分别在7月中旬、8月中旬、9月中旬、10月中旬、11月中旬各浇水1次(直到土壤含水深度为30 cm左右)。每次每小区取样3个重复,自7月起逐月取样,共取5次。
2.4 生长量的测定 选择生长势良好的植株测定。分别测定5个采收时期黄芪植株的生长情况[株高、根长、商品根长(要求美观,可用于市面上销售)、根鲜/干重、根径]。株高为植株基部往上到最高部位的距离,采用直尺测量;根长度为基部往下到不定根末端长度,商品根长为植株基部到根分叉部,采用直尺测量;根茎是指延长横卧的根状地下茎,采用游标卡尺测定;根鲜重为黄芪在自然状态下测得的重量。
2.5 有效成分含量测定
2.5.1 色谱条件 Agilent分析柱SB-C18(250 mm×4.6 mm,5 μm);流速1 mL/min;柱温35 ℃;检测波长254 nm;流动相:乙腈-0.3%甲酸溶液梯度洗脱。见表1。
2.5.2 对照品溶液制备 分别精密称取毛蕊异黄酮和毛蕊异黄酮葡萄糖苷对照品于10 mL容量瓶中,加甲醇配制成每毫升含毛蕊异黄酮0.136 mg、毛蕊异黄酮葡萄糖苷0.175 mg的混合物对照品溶液,摇匀备用。
2.5.3 供试品溶液的制备 取本品适量,研细(过四号筛),精密称取5 g,置500 mL圆底烧瓶中,精密加入分析甲醇50 mL,称定质量,超声处理1 h,放冷补重,过滤,滤液蒸干,残渣加色谱甲醇溶解,转移至5 mL量瓶中,加甲醇至刻度,摇匀,用微孔滤膜(0.22 μm)滤过,即得。
2.6 线性关系考察 分别精密吸取对照品溶液2、5、10、15、20、30 μL,注入液相色谱仪,以进样量(C)横坐标,以峰面积(A)为纵坐标,绘制标准曲线,得毛蕊异黄酮葡萄糖苷回归方程为:A=3 142.3C+89.642,r=0.999 8;毛蕊异黄酮线性回归方程为:A=4 536.7C+69.763,r=0.999 7。结果表明毛蕊异黄酮葡萄糖苷在0.175~3.50 μg/mL毛蕊异黄酮在0.136~2.72 μg/mL范围内,进样质量浓度与峰面积呈良好线性关系。
2.7 数据分析方法
数据以“平均值±标准差”表示,用Excel 2010软件处理数据并绘图,用 Prism 6.0软件进行数据统计分析,用最小显著极差法(LSD)进行差异显著性检验和多重比较(P<0.01)。
2.8 样品测定结果
2.8.1 干旱胁迫对黄芪地上部分生长的影响 黄芪株高随株苗生长一直处于增长趋势,缓苗后头两月(7~9月)株高增长最快;缓苗后到10月株高增长减缓,缓苗后至试验结束(11月5日)株高达到最大值。见图1。干旱胁迫后对株高产生显著影响,随着胁迫强度增大,黄芪株高随株苗生长递减,与常规水分条件(CK)比较,轻度干旱胁迫(A1)下株高降低了7.60%(P<0.01),重度干旱(A2)下株高降低了13.67%(P<0.05)。说明水分胁迫抑制了幼苗地上部分的生长,且干旱胁迫愈强影响愈大。
2.8.2 干旱胁迫对黄芪地下部分生长的影响 根长随株苗的生长而增加,茎叶枯萎时达最大值;缓苗后至10月根鲜重增长迅速,以后增长缓慢,至试验结束达到最大值。见图1。轻度干旱胁迫后,促进了根的生长,总根长、商品根长与和根鲜重分别比对照增加11.23%(P<0.01)、10.40%(P<0.01)、26.07%(P<0.01);重度干旱下根长比对照降低12.60%(P<0.01),根鲜重与商品根长分别显著降低5.50%(P<0.05)和17.05%(P<0.01)。见图1。说明轻度干旱有助于根系生长;而胁迫加重后根系的正常生长受到抑制。
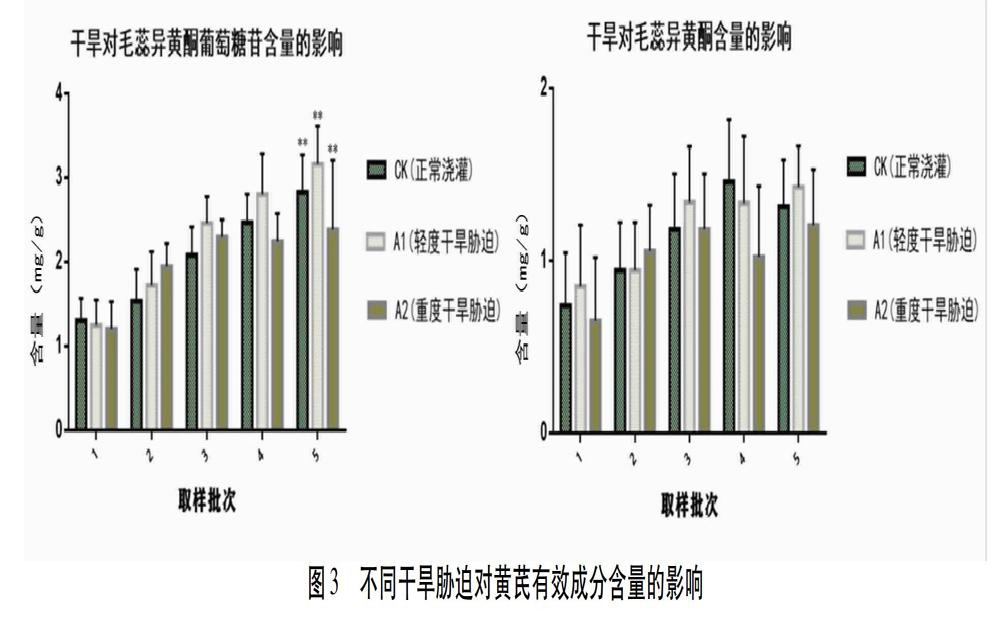
2.8.3 干旱胁迫对黄芪根中2种次生代谢物含量的影响 在上述色谱条件下,分别吸取混合对照品溶液、供试品溶液各10 μL,注入液相色谱仪,记录色谱图。毛蕊异黄酮葡萄糖苷和毛蕊异黄酮的保留时间分别约为15.293、24.382 min。上述2种成分均峰形良好且与相邻组分达到基线分离。见图2。
通过对黄芪中毛蕊异黄酮和毛蕊异黄酮葡萄糖苷的含量测定,发现轻度干旱胁迫下,不仅促进了黄芪生长发育,而且也显著增强了毛蕊异黄酮葡萄糖苷含量的积累,较对照组提高11.74%(P<0.01),毛蕊异黄酮含量与对照品比较差异无统计学意义(P>0.05);而重度干旱胁迫下,根生长受到抑制,有效成分含量积累也会受影响,毛蕊异黄酮葡萄糖苷含量比对照极显著降低19.93%(P<0.01),毛蕊异黄酮含量与对照品比较差异仍无统计学意义(P>0.05)。见图3。
3 讨论
水分对植物根系的生长发育具有调控作用,尤其与根类药材的生长和药效成分的合成积累关系密切。在适宜水分条件下,根系生长良好,构型合理,产量高,但不利于药效成分的合成;而适度的水分胁迫能诱导防御与适应反应,促进植物生长发育,增强体内次生代谢[2,14],从而提高药效成分含量。本研究发现,轻度干旱胁迫下黄芪株高降低,根鲜重等生长因素明显得到提高,显著促进了根的生长和有效成分的积累;重度干旱胁迫下显著抑制了黄芪株高,根长,根鲜重及藥效成分积累。这与梁建萍等[6]设计的干旱胁迫对生长于盆栽中蒙古黄芪的研究结果相类似,充分证明轻度干旱胁迫不仅对植于盆栽中的植物生长具有促进作用,对移栽于大田中的植物也同样具有促进作用。而大田更接近实际农田复杂环境,为蒙古黄芪的大量种植提供规范化技术参考。
植物在受到水分限制时,通常会调整根系形态或分布以适应外部干旱环境[15],在轻度干旱条件下,黄芪为了满足对水分的需求,将生长中心向根系转移,试图从土壤中吸收更多的水分,从而促进了根的生长,而地上部因受水分限制生长减弱;当土壤干旱加重时,根系吸水受阻,影响同化物的合成[16],因而根长、根重,根药效成分积累显著降低。内蒙古自治区和林格尔县地处我国乌兰布和沙漠东北缘,是蒙古黄芪的道地产区之一,该地区气候干旱,降水稀少,水资源短缺是阻碍该地区植物正常生长的重要因素之一,当植被受到干旱胁迫时会产生很多抗逆性反应[17]。特殊的气候原因给蒙古黄芪的栽培种植增加了难度,如何解决此类问题是蒙古黄芪当前面临的重大挑战。因此,研究水分与蒙古黄芪生长及药效成分合成积累之间的关系,寻找既能提高质量又不影响产量的灌溉水量,对实现水的高效利用以及黄芪规范化种植具有不可忽略的作用。
综上所述,轻度干旱胁迫能促进黄芪生长及有效成分积累,但重度干旱胁迫超过了黄芪所能承受的抗逆能力,次生代谢物含量也大大降低。这一结果可为黄芪种植中药效成分的定向培育提供水分调控理论依据和技术指导,但本研究中毛蕊异黄酮的含量没有得到明显提高,证明干旱胁迫不是毛蕊异黄酮合成的的适宜环境因子,因而探讨黄酮合成的适宜环境因子有待进一步研究。从生理生化方面而言,已有不少研究证实不同程度的干旱胁迫能够有效提高或抑制药用植物活性成分的积累,如适宜的土壤干旱有利于高山红景天地下部分的生长及红景天甙含量的积累[18];中度干旱胁迫可以促进菘蓝根部生长和靛玉红的积累[19]等,但具体的分子机制研究薄弱,因此将本草基因组学前沿组学技术引入中药研究中,从分子层面更系统地研究药用植物品质与干旱胁迫之间的关系及其分子机制[20],从根本上解决因自然干旱环境影响药用植物生长发育与品质的重大问题。
参考文献
[1]张争,杨云,魏建和,等.环境因子导致的植物防御反应与药用次生代谢物的合成和积累[J].植物生理学通讯,2009,45(9):919-924.
[2]王亚星,臧埔,马琳,等.药用植物次生代谢影响因素研究进展.中国医药生物技术[J],2011,6(4):291-294.
[3]Castroluna A,Ruiz OM,Quiroga AM,et al.Effects of salinity and drought stress ongermination,biomass and growth in three varieties of Medicago sativa L[J].Avances En Investigación Agropecuaria,2014,18(1):39-50.
[4]Wang X,Cai X,Xu C,et al.Drought-responsive mechanisms in plant leaves revealed by proteomics[J].International Journal of Molecular Sciences,2016,17(10):1706-1712.
[5]张迪迪,张亚玉.氮形态对药用植物生长及品质影响的研究进展[J].中药材,2016,39(3):696-698.
[6]梁建萍,贾小云,刘亚令,等.干旱胁迫对蒙古黄芪生长及根部次生代谢物含量的影响[J].生态学,2016,14(1):4415-4422.
[7]国家药典委员会.中华人民共和国药典[M].北京:中国医药科技出版社,2015:283-285.
[8]张蔷,高文远,满淑丽.黄芪中有效成分药理活性的研究进展[J].中国中药杂志,2012,37(21):3203-3207.
[9]李静,王利,彭文,等.黄芪治疗肾脏疾病的研究进展[J].中南药学,2017,15(1):85-87.
[10]王敏杰,金蓉,李慧芳.蒙古黄芪总黄酮对大鼠心肌缺血再灌注损伤的保护作用[J].中南药学.2015,13(2):147-150.
[11]段荣,杨志中.贝那普利联合黄芪治疗2型糖尿病肾病疗效分析[J].中国医药,2006,1(7):401-402.
[12]刘洋,杜婧,沈颜红.10种药用黄芪属植物化学成分及药理作用的研究进展[J].中国实验方剂学杂志,2017,23(18):222-234.
[13]郭璇,张宪毅.浅谈气候变化对呼和浩特地区经济发展的影响及对策[J].内蒙古科技与经济,2014,13(1):38-39.
[14]高扬,梁宗锁.水分对根类中药材根系生长及有效成分积累的影响[J].现代中药研究与实践,2004,18(3):10-15.
[15]安玉艳,梁宗锁,郝文芳.杠柳幼苗对不同强度干旱胁迫的生长与生理响应[J].生态學报,2011,31(3):716-725.
[16]李芳兰,包维楷,吴宁.白刺花幼苗对不同强度干旱胁迫的形态与生理响应[J].生态学报,2009,29(10):5406-5416.
[17]王雪凤.内蒙古地区栽培及野生蒙古黄芪的ISSR遗传多样性研究[D].呼和浩特:内蒙古大学,2014:17-36.
[18]尚辛亥,王洋,阎秀峰.土壤水分对高山红景天生长和红景天甙含量的影响[J].植物生理学通讯,2003,39(4):335-336.
[19]谭勇,梁宗锁,董娟娥,等.水分胁迫对菘蓝生长发育和有效成分积累的影响[J].中国中药杂志,2008,33(1):19-22.
[20]陈士林,宋经元.本草基因组学[J].中国中药杂志,2016,41(21):3881-3889.
(2020-02-10收稿 责任编辑:芮莉莉)

