聚胍修饰抗菌型海水提铀材料
李 昊, 文 君, 汪小琳
(1. 中国工程物理研究院核物理与化学研究所, 绵阳 621900; 2. 中国科学技术大学物理学院工程与应用物理系, 合肥 230026)
1 引 言
随着全球经济快速发展, 能源的需求量日益提高, 同时化石燃料的燃烧也带来了日益严重的环境问题, 因此, 发展核能等清洁可持续能源势在必行. 铀是核能发展的基础资源, 但现有的陆地铀矿储量较为贫乏, 预计仅够人类使用一百年左右[1]. 海水中含有超过45亿吨的铀, 几乎是陆地铀矿储量的1 000倍, 海水提铀有望成为保证核能可持续发展的一种可行方案[2-3]. 近几十年来, 有多种方法用于海水提铀: 吸附法[4]、萃取法[5]、离子交换法[6]、沉淀法[7]、生物转换法[8]和电化学提取法[9]等, 其中吸附法具有操作简单、高效和成本低等优点, 是应用最广泛的海水提铀方法. 吸附剂则是吸附法的核心, 无机材料[10]、高分子材料[11-15]、纳米结构材料[16]和生物材料[17]等多种材料都已用于制备海水提铀吸附剂. 其中偕胺肟基(AO)吸附剂具有制备简单和物化稳定性高, 以及在海水pH值(8.3)下与铀进行强配位结合的优点, 且偕胺肟基吸附剂已在21世纪初被用于大规模工程化试验, 证明了其实用性[18].
海水中铀浓度很低(约为3.3 μg/L), 导致吸附剂在海水中需要较长的时间才能完成提铀过程. 材料在吸附过程中, 海水中大量存在的微生物会附着在材料表面, 形成生物污损, 对材料产生腐蚀和破坏, 导致材料的吸附性能和耐用性发生大幅度地降低[19]. 因此, 近年来有学者开始着手制备抗菌型海水提铀材料, 赋予材料抗生物污损性能, 有效提高材料在海水提铀过程中的稳定性和耐用性[20-24]. 但是, 现阶段抗菌型海水提铀材料多采用引入无机纳米颗粒(如纳米TiO2、纳米锌和纳米银等)或单分子抗菌基团(如新霉素和胍基等). 其中无机纳米颗粒在长期海水冲刷的条件下有可能发生脱落, 耐用性不足, 而单分子抗菌基团抗菌性有限, 所以采用这两种途径所制备的材料, 其抗菌性和耐用性不足以满足长期的海水提铀过程. 因此, 开发一种具有高效、稳定抗菌性, 以及良好吸附性能的海水提铀材料, 仍然是一个重要的挑战.
聚六亚甲基盐酸胍(PHGC)是一种通过单分子抗菌基团聚合而成的聚合物抗菌材料, 由于多个抗菌基团之间产生共价键和协同效应, 因而聚合物抗菌材料相比其它抗菌材料, 具有高效、广谱、稳定的抗菌性[25]. 聚六亚甲基盐酸胍是一种制备简单、低成本的抗菌材料, 广泛应用于材料的改性方向[26], 如微球[27]、薄膜[28]和纳米复合材料[29]等. 同时, 聚胍中含有大量的胺基, 可以用于提高材料的铀吸附性能[30]. 因此, 聚六亚甲基盐酸胍有望赋予海水提铀材料高效、稳定的抗菌性和良好的吸附性能. 本文依次通过氧化还原聚合反应、胺基在戊二醛中的交联反应和氰基在羟胺中的肟化反应, 制得了一种聚胍和偕胺肟基双功能化新型海水提铀材料(PAM-AO-PHGC). 随后, 我们对该材料进行了铀的水溶液和含铀模拟海水等多种体系的吸附性能测试, 探究各组分含量、吸附时间、铀溶液pH和铀溶液盐离子浓度对材料吸附性能的影响. 此外, 本文还在不同类型的细菌条件下, 对该材料进行了抗菌性能方面的测试.
2 实 验
2.1 试 剂
材料制备所用的盐酸胍、1,6-己二胺、丙烯酰胺(AM)、丙烯腈(AN)、(NH4)2S2O8、NaHSO3、乙醇、戊二醛、NH2OH·HCl、NaOH和甲醇, 配置铀溶液所用的UO2(NO3)2·6H2O、NaHCO3、HNO3和NaCl, 以及抗菌测试所用的牛肉膏、蛋白胨、琼脂、Na2HPO4·12H2O和KH2PO4均购自阿拉丁试剂. 校准电感耦合等离子体发射光谱(ICP-OES)所采用的1 000 μg/mL铀标准溶液购自西格玛奥德里奇试剂. 所有原料均为化学纯级别或以上且不做任何纯化处理.
2.2 制 备
首先采用减压熔融聚合的方法, 制备聚六亚甲基盐酸胍(PHGC): 将等摩尔量的盐酸胍和1,6-己二胺加入三颈圆底烧瓶中并搅拌, 接着在减压条件下将反应体系加热至120 ℃并维持2 h, 待放出大量氨气后, 将温度提高至155 ℃左右, 维持12 h后, 得到高粘度共聚产物PHGC. 反应过程如图1所示. 接着通过三步化学合成制备出PAM-AO-PHGC材料, 合成路线如图2所示.
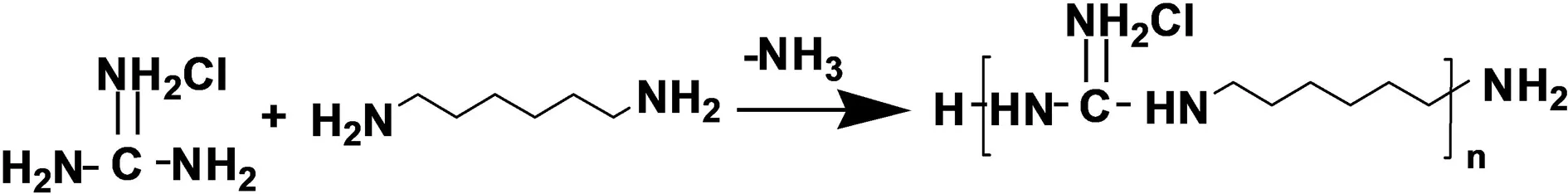
图1 聚六亚甲基盐酸胍(PHGC)的合成Fig.1 Synthesis of Polyhexamethylene guanidine hydrochloride (PHGC)

图2 PAM-AO-PHGC的合成Fig.2 Synthesis of PAM-AO-PHGC
PAM-AN的合成: 将7 g AM和3 g AN投入圆底烧瓶内, 溶于30 mL去离子水中. 反应溶液在氮气氛围下进行磁力搅拌, 并于50 ℃加热0.5 h. 随后向烧瓶中加入总质量20 mg且质量比为1∶1的NaHSO3和 (NH4)2S2O8, 继续加热12 h, 使混合物充分聚合. 反应结束后使用乙醇和去离子水对产物进行提纯和洗涤, 最后在50 ℃下进行真空干燥后得到产物PAM-AN(标记为样品7, AM: AN质量比6∶4则标记为样品6, 样品8、9同理).
PAM-AN-PHGC的合成: 称取10 g PAM-AN和10 g PHGC加入三颈圆底烧瓶, 并加入100 mL超纯水加热至50 ℃, 同时搅拌混合均匀后, 加入0.5 g 50 %戊二醛溶液, 交联反应8 h后, 用乙醇和去离子水反复提纯和洗涤, 最后在50 ℃下真空干燥, 得到淡黄色交联产物PAM-AN-PHGC.
PAM-AO-PHGC的合成: 配制100 mL质量分数为10%的盐酸羟胺溶液, 溶剂为体积比为1∶1的水和甲醇混合溶剂;接着在溶液中加入氢氧化钠调节pH值至弱碱性, 将配制好的溶液和20 g PAM-AN-PHGC同时加入圆底烧瓶, 在80 ℃油浴中搅拌回流8 h, 得到蓬松固体产物, 用乙醇和水反复提纯和洗涤后得到终产物PAM-AO-PHGC.
同时采用相同的肟化方法, 将PAM-AN直接肟化, 制得PAM-AO作对照组.
2.3 表 征
使用Bruker Tensor II傅立叶转换红外光谱仪(FT-IR), 通过 KBr固体压片法测试PAM-AO-PHGC制备过程中各产物在4 000~400 cm-1区间的FT-IR光谱(分辨率4 cm-1). 使用FEI QUANTA250扫描电子显微镜(SEM)观察材料的形貌. 使用Agilent 5110 ICP-OES测定溶液中的铀浓度. 使用PerkinElmer Lambda 650紫外分光光度仪测试菌液吸光度.
2.4 吸附性能测试
溶液配制: (1) 20 ppm铀溶液: 称取适量UO2(NO3)2·6H2O溶于去离子水, 接着用NaHCO3和HNO3调节溶液pH (测试pH对吸附影响时pH = 3~9, 其余情况pH = 8.0;测试盐离子强度影响时, 分别称取0~0.5 mol/L NaCl加入溶液体系);(2) 8 ppm含铀模拟海水[11]: 称取适量UO2(NO3)2·6H2O溶于去离子水, 然后加入25 600 ppm NaCl和193 ppm NaHCO3, 含铀模拟海水pH=7.8.
吸附性能测试: 称取一定质量的吸附剂和含铀溶液倒入具塞锥形瓶中, 将锥形瓶置于恒温振荡器中震荡吸附24 h (T= 25 ℃), 以达到吸附平衡. 采用1 000 μg/mL铀标准溶液分别配制五种不同浓度的校准标液 (0~10 μg/mL), 对ICP-OES进行校准得到线性校准曲线, 之后对吸附前和吸附后的溶液进行铀浓度测量. 公式1和2分别为吸附剂的吸附容量Qe(mg·g-1)和吸附效率SE(%)的计算公式:
(1)
(2)
式中V(mL)为溶液体积, m(mg)为吸附剂质量, C0和Ce(μg/mL)分别为吸附前和吸附后溶液中的铀浓度. 所有实验数据均为三次测量的平均值.
2.5 抗菌性能测试
参考国家标准GB/T 20944—纺织品抗菌性能的评价方法, 测试材料的抗菌性能. 测试过程: 首先将细菌在无菌营养肉汤中进行恒温震荡活化(37 ℃、130 rpm、18~22 h);接着采用无菌营养肉汤和无菌0.03 mol/L PBS溶液将菌液稀释至105CFU/mL;随后, 取20 mL稀释后的菌液和10 mg材料放入灭过菌的三角烧瓶中, 在24 ℃和150 rpm条件下, 震荡培养20 h, 并采用相同的方式但不放入吸附材料设为对照样;最后, 采用十倍稀释法将菌液稀释至适当浓度, 取0.2 mL涂布到灭过菌的固体培养基上, 在37 ℃下培养36 h后, 对表面菌落进行计数. 测试选用的细菌包括: 抗菌测试常用的革兰氏阳性菌金黄色葡萄球菌、革兰氏阴性菌大肠杆菌, 以及两种海洋中大量存在的细菌—溶藻弧菌和创伤弧菌. 采用公式(3)计算材料的抑菌率(RI):
(3)
式中C0为对照组细菌浓度(CFU/mL), Ca为实验组细菌浓度(CFU/mL).
此外, 为了进一步验证材料抑制细菌生长的性能, 取20 mL活化后的菌液, 加入200 mL已灭菌的营养肉汤, 同时加入20 mg材料, 同时设置不加入材料的对照组. 随后, 每2 h取样, 并采用紫外分光光度计测试菌液吸光度, 吸光度越低则细菌浓度越低, 材料抑菌性能越好.
3 结果与讨论
3.1 PAM-AO-PHGC的表征
利用FT-IR光谱表征制备过程中各产物的化学结构变化, 结果如图3所示. 材料PAM-AN谱线中2 242 cm-1处的特征峰对应着丙烯腈结构上C≡N的拉伸振动, 1 638 cm-1处的特征峰对应着丙烯酰胺中-NH-CO-的拉伸振动, 这些特征峰表明了PAM-AN聚合成功. PAM-AN-PHGC谱线中2 242 cm-1处的C≡N特征峰明显降低, 证明了PAM-AN与PHGC交联成功, 导致材料整体氰基含量降低. PAM-AO-PHGC谱线中2 242 cm-1处的C≡N特征峰消失, 945 cm-1处出现N-O特征峰, 表明材料中的氰基成功肟化成偕胺肟基. 即PAM-AO-PHGC材料制备成功.

图3 FT-IR光谱: PAM-AN、PAM-AN-PHGC、PAM-AO-PHGC和PAM-AO-PHGC-U
Fig.3 FT-IR spectra: PAM-AN, PAM-AN-PHGC, PAM-AO-PHGC and PAM-AO-PHGC-U
使用SEM对PAM-AO-PHGC以及在铀溶液吸附后的材料形貌进行表征. 如图4所示: 合成的PAM-AO-PHGC呈现出较为松散的片层结构, 松散的结构利于材料吸附;且材料在铀溶液中吸附后, 微观形貌未发生明显变化. 因此, 吸附过程未对材料产生破坏, 材料具有较好的稳定性.

图4 PAM-AO-PHGC吸附前后的SEM图像: (a)吸附前;(b)吸附后
Fig.4 SEM images of PAM-AO-PHGC: (a) before adsorption; (b) after adsorption
3.2 PAM-AO-PHGC的配比优化
通过调控AM和AN的比例, 可以控制材料中PHGC和AO的含量, 进而优化材料的吸附性能和抗菌性能. 不同配比的材料在20 ppm铀溶液中的吸附容量如图5所示. 吸附实验结果表明: 样品7具有最好的吸附性能, 即AM与AN质量比为7∶3时材料吸附性能最佳. 此外样品7的吸附容量为341.0 mg·g-1, 而PAM-AO的吸附容量为262.7 mg·g-1, 证明由于PHGC的引入, 使PAM-AO-PHGC材料的吸附容量相比PAM-AO提高了29.8%. 这可能是因为PHGC中含有大量的胺基, 有效提高了材料的亲水性和吸附性能.

图5 不同配比PAM-AO-PHGC和PAM-AO在20 ppm铀溶液中的吸附容量
(C0=20 ppm, T=25 ℃, t=24 h, V=500 mL, m=15 mg, pH = 8.0)
Fig.5 Adsorption capacities of PAM-AO-PHGC with different ratios and PAM-AO in 20 ppm U solution
(C0=20 ppm, T=25 ℃, t=24 h, V=500 mL, m=15 mg, pH=8.0)
不同配比材料的抗菌性能测试结果如图6所示. 结果表明: 材料6~9对金黄色葡萄球菌(图6a)和大肠杆菌(图6b)抗菌性能均依次递增, 证明材料中丙烯酰胺含量越高, 相对应的PHGC含量也越高, 材料的抗菌性能越好, 材料的性能表现与化学组分相对应. 由上述吸附实验和抗菌测试的初步筛选结果可知, 样品7具有最好的综合性能, 后续均采用样品7作为PAM-AO-PHGC的代表, 进行更深入的实验和研究.

图6 不同配比PAM-AO-PHGC对(a)金黄色葡萄球菌和(b)大肠杆菌的抗菌活性
Fig.6 Antibacterial activities of PAM-AO-PHGC with different ratios to (a) S. aureus and (b) E. coli
3. 3 吸附性能测试
3.3.1 pH对材料吸附性能的影响 由于铀溶液的初始pH影响着铀酰离子在溶液中的种态, 以及材料与铀酰离子的配位能力, 因此pH是影响材料吸附性能的重要因素, 海水提铀材料需在海水pH下具有良好的吸附性能. 为探索pH对PAM-AO-PHGC吸附性能的影响, 采用NaHCO3和HNO3调节铀溶液的pH在2~9之间, 接着分别进行吸附实验, 实验结果如图7所示. 实验结果表明: 材料在pH=2的酸性条件下吸附性能较差, 吸附效率仅68%, 这可能是因为酸性条件下, 材料表面的配体基团发生质子化, 无法有效吸附铀酰离子;但随着pH的升高, 材料表面的质子化程度降低, 材料表面配体基团吸附活性不断提高, 当pH在3~8范围内吸附效率均高于99%, 当pH = 9时, 吸附效率略微下降至97%. 因此, PAM-AO-PHGC吸附剂在弱酸性、中性和弱碱性条件下均保持较高的吸附效率, 可适用于在真实海水条件下进行铀的吸附. 后续的吸附实验均在pH=8.0条件下进行.
3.3.2 盐离子强度对材料吸附性能的影响 海水中NaCl含量很高(0.44 mol/L), 高盐离子强度有可能对材料的吸附性能产生影响. 为了研究盐离子强度对材料吸附性能的影响, 向铀溶液中加入浓度为0.01~0.5 mol/L的NaCl后, 进行吸附实验. 实验结果如图8所示, PAM-AO-PHGC材料在NaCl浓度为0.01~0.5 mol/L范围内, 铀吸附效率始终保持在95%以上. 因此, 盐分对PAM-AO-PHGC的铀吸附性能没有显著影响, 材料具有良好的耐盐离子强度性能.

图7 PAM-AO-PHGC在不同pH下的吸附效率
(C0=20 ppm, T=25 ℃, t=24 h, V=20 mL, m=5 mg)
Fig.7 Adsorption efficiencies of PAM-AO-PHGC at different pH
(C0=20 ppm, T=25 ℃, t=24 h, V=20 mL, m=5 mg)

图8 PAM-AO-PHGC在NaCl浓度铀溶液中的吸附效率
(C0=20 ppm, T=25 ℃, t=24 h, V=20 mL, m= 5 mg)
Fig.8 Adsorption efficiencies of PAM-AO-PHGC in U solutions with different NaCl concentrations
(C0=20 ppm, T=25 ℃, t=24 h, V=20 mL, m=5 mg)
3.3.3 吸附动力学 为了探究材料的饱和吸附时间, 分别测试了材料在8 ppm含铀模拟海水和20 ppm铀溶液中的吸附动力学, 实验结果如图9所示. 实验结果表明, 材料无论是在模拟海水还是铀溶液中, 前240 min材料吸附速率较快, 并在360 min内可完成90%以上的吸附, 在24 h后达到吸附平衡, 在8 ppm模拟海水和20 ppm铀溶液中饱和吸附容量分别为229.6和314.2 mg·g-1. 由于铀的吸附是一种动态平衡过程, 因此在两种不同溶液中饱和吸附容量的差异主要来源于溶液初始铀浓度不同, 高浓度的盐离子也会带来一部分影响. 为了研究PAM-AO-PHGC材料的吸附动力学机理, 采用准一阶动力学模型(4)和准二阶动力学模型(5)拟合吸附过程:
ln(Qe-Qt)=lnQe-k1t
(4)
(5)
式中Qt(mg/g)为时间t时的吸附容量, Qe(mg·g-1)为平衡吸附容量, k1(min-1)和k2(mg·g-1·min-1)分别为准一阶和准二阶动力学的吸附速率常数.
PAM-AO-PHGC吸附剂的动力学参数如表1所示. 结果表明, 在模拟海水和铀溶液体系中, 准二阶动力学模型的相关系数(R2)均大于准一阶动力学模型, 即准二阶动力学模型对该材料的吸附过程拟合程度更高, 表明材料吸附过程为化学吸附. 材料在模拟海水和铀溶液体系下, 准二阶动力学模型拟合所得的饱和吸附容量理论值分别为231.0和310.6 mg·g-1, 与实验结果相近. 此外, 在图3的FT-IR谱图中, 材料吸附后在885 cm-1处产生新的U-O特征峰, 进一步证明了材料吸附过程为化学吸附这一结论.

图9 PAM-AO-PHGC吸附动力学模型拟合
Fig.9 Fits of adsorption kinetic models of PAM-AO-PHGC
(T=25 ℃, t=24 h, V=500 mL, m=15 mg)

表1 准一阶和准二阶动力学模型的动力学参数
3.4 抗菌测试
参考国家标准GB/T 20944—纺织品抗菌性能的评价方法, 测试了材料对金黄色葡萄球菌、大肠杆菌、以及两种海洋中常见细菌—溶藻弧菌和创伤弧菌的抑菌率, 结果如图6和图10所示. 实验
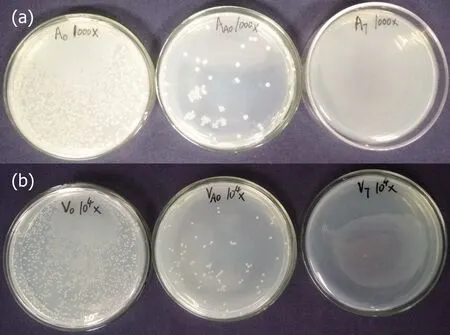
图10 PAM-AO-PHGC和PAM-AO对(a)溶藻弧菌和(b)创伤弧菌的抗菌活性Fig.10 Antibacterial activities of PAM-AO-PHGC and PAO-AO to (a) V. alginolyticus and (b) V. vulnificus
结果表明, PAM-AO-PHGC材料对四种细菌都有较好的抗菌效果, 抑菌率几乎达到了100%, 相比未接枝PHGC的对照样品PAM-AO, 材料的抑菌率有显著的提高. 为了进一步验证材料对海洋细菌具有较好的抑菌性, 在细菌培养过程中取出一部分营养肉汤培养液, 进行紫外吸光度测试, 得到空白对照组、PAM-AO对照组合PAM-AO-PHGC实验组的细菌生长曲线如图11所示, 证明了PAM-AO-PHGC材料对海洋细菌具有极高的抑菌性.
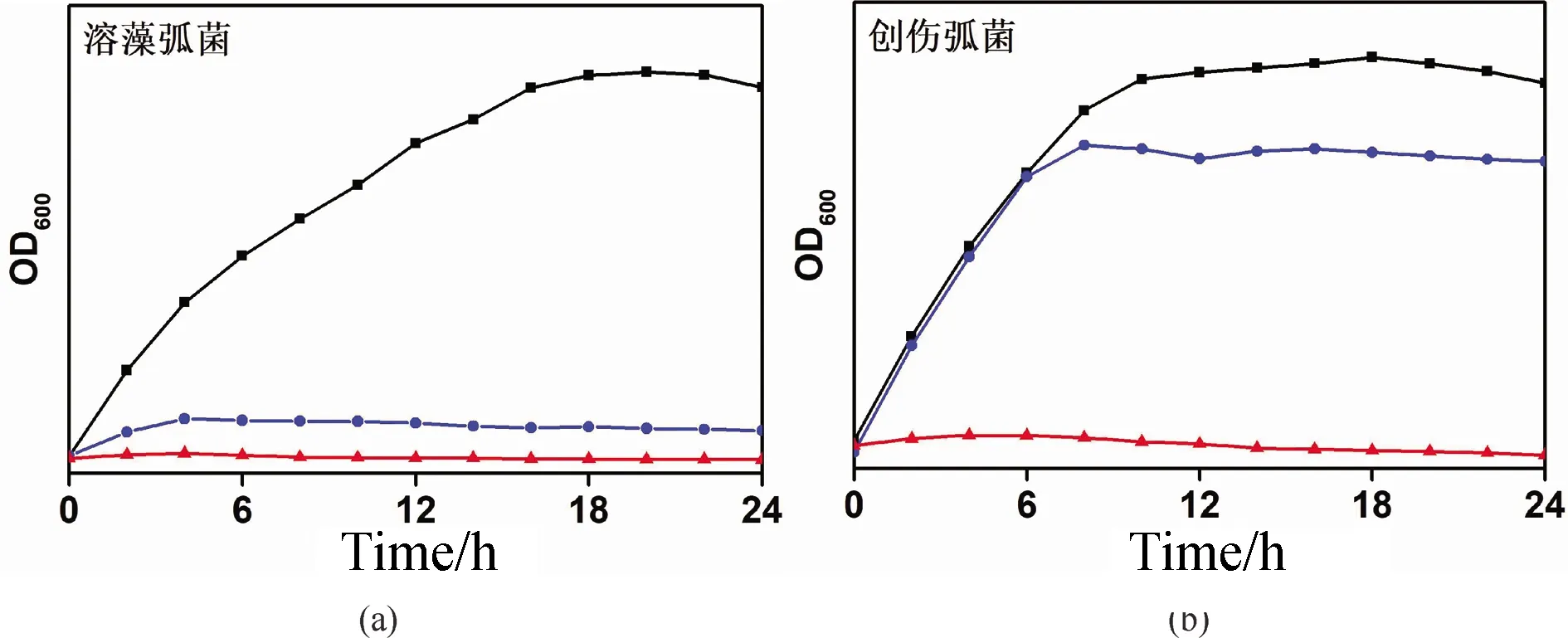
图11 PAM-AO-PHGC(红色,三角)和PAM-AO(蓝色,圆圈)对(a)溶藻弧菌和(b)创伤弧菌生长曲线的影响Fig.11 Effects of PAM-AO-PHGC (red, triangle) and PAM-AO (blue, circle) on growth curves of (a) V. alginolyticusand (b) V. vulnificus
为了进一步验证材料的抗菌性来源于PHGC的引入, 测试每一步反应产物对金黄色葡萄球菌和大肠杆菌的抗菌性能, 结果如图12所示. 实验结果表明: PHGC和PHGC交联后的材料, 均具有良好的抗菌性能, 且材料的抗菌性在肟化反应后, 依然可以得到很好的保持. 因此, 可以得到结论: PHGC的引入赋予了材料优异的抗菌性能.

图12 制备过程中不同阶段PAM-AO-PHGC对(a)金黄色葡萄球菌和(b)大肠杆菌的抗菌活性(0: 对照组, N: PAM-AN, C: PAM-AN-PHGC, 7: PAM-AO-PHGC, G: PHGC)Fig.12 Antibacterial activities of PAM-AO-PHGC at various stages in its synthesis to (a) E. coli and (b) S. aureus(0: 对照组, N: PAM-AN, C: PAM-AN-PHGC, 7: PAM-AO-PHGC, G: PHGC)
4 结 论
1) 通过戊二醛交联胺基的方法可以将PHGC接枝在PAM-AN基体上, 在完成胺肟化处理后, 得到聚胍修饰海水提铀材料PAM-AO-PHGC;PHGC的引入不仅赋予材料优异的抗菌性能, 还有效提高了材料的吸附性能.
2) 聚胍修饰海水提铀材料在广泛pH范围内(pH = 3~9)铀溶液中均保持高吸附效率, 适用于海水提铀研究;且材料表现出良好的耐盐性能, 在含高浓度NaCl (0.5 mol/L)的铀溶液中依然保持95%以上的吸附效率.
3) 聚胍修饰海水提铀材料在8 ppm模拟海水中的平衡吸附容量达到231.0 mg·g-1, 吸附过程符合准二阶吸附动力学模型, 为化学吸附.
4) 聚胍修饰海水提铀材料对金黄色葡萄球菌、大肠杆菌、溶藻弧菌和创伤弧菌具有良好的抗菌性能, 抑菌率接近100%.

