清热化湿方对MNU 联合幽门螺杆菌感染小鼠胃组织中TNF-α、IL-8及TLR-4 水平的影响
钟 婵,张 涛,黄李冰雪,刘 畅,孙艳珍,黄晓燕,陈远能∗
(1.广西中医药大学,广西 南宁530000; 2.广西中医药大学附属瑞康医院消化内科,广西 南宁530000;3.广西医科大学第一附属医院,广西 南宁530000)
胃癌仍然是全球癌症死亡的主要原因之一,属亚洲地区分布最广[1]。胃癌的病理发生机制颇为复杂,受多因素、多基因的影响,而幽门螺杆菌已被公认为致癌的关键因子[2],近几年已被成为研究防治胃癌的重要靶点。非可控性炎症使胃黏膜发生癌变成为必然趋势,因此探讨幽门螺杆菌感染相关胃癌中炎症介质、肿瘤坏死因子的表达情况尤为重要。以中医药理论指导为基础,前期课题组临床研究观察清热化湿方能减轻炎症反应,明显缓解幽门螺杆菌感染相关胃癌的作用反应。为进一步观察其防治胃癌的可能机制,课题组开展清热化湿方对幽门螺杆菌相关胃癌中TNF-α、IL-8 及TLR-4 表达研究。
1 材料
1.1 动物及菌株 SPF 级雄性BALB/c 小鼠90 只,购自湖南斯莱克景达实验动物有限公司,许可证号SCXK (湘)2001-0003,合格证号0060892,实验单位使用许可证编号SCXK (桂) 2010-0001。幽门螺杆菌悉尼菌株SS1 系南昌大学第一附属医院消化疾病重点实验室惠赠。大鼠组织取材于广西中医药大学实验动物中心实验室。
1.2 仪器与试剂 哥伦比亚血琼脂基础(批号CM911)、无菌脱纤维绵羊血(北京索莱宝科技有限公司);N-甲基-N-亚硝基脲 (MNU,美国Sigma 公司,批号N136701);Anti-TLR4 antibody (批号AB13556)、Anti-TNF-α antibody(批号AB6671),均购自英国Abcam 公司;IL-8 antibody(批号38419,美国Sab 公司);RM2135 切片机(德国徕卡公司);倒置光学显微镜(日本Olympus 公司);离心机、BCA 蛋白定量试剂盒(北京华肽先锋生物科技有限公司)。
1.3 药物 清热化湿方(藿香6 g,川厚朴3 g,姜半夏4.5 g,赤茯苓9 g,杏仁9 g,生薏 苡仁12 g,白豆蔻1.8 g,猪茯苓4.5 g,淡豆豉9 g,泽泻4.5 g,黄连12 g,栀子12 g) 购自广西中医药大学第一附属医院仁爱分院。上述药材用蒸馏水煎成药液,浓缩,配制成1 g 生药/1 mL药液,过滤分装4 ℃冰箱保存。兰索拉唑肠溶胶囊(批号H20065186,扬子江药业集团有限公司,15 mg);阿莫西林胶囊 (批 号 H44021351,珠海联 邦制药 有限公 司,250 mg);克拉霉素(批号H20031041,江苏恒瑞医药有限公司,500 mg)。
2 方法
2.1 幽门螺杆菌培养 将幽门螺杆菌悉尼菌株SS1 系复苏后,接种于7%琼脂羊血培养基中,37 ℃细菌培养箱,在厌氧条件下培养48 h,可见菌落长出,将菌落刮下溶于布氏肉汤,制成幽门螺杆菌菌液,紫外分光光度计测浓度,幽门螺杆菌菌液为109CFU/mL。经快速尿素酶试验证实幽门螺杆菌培养成功。
2.2 模型制备 参照文献[3] 将适应性喂养1 周的90 只健康BALB/c 小鼠,随机分成6 组,正常组、模型组、清热化湿方组(低、中、高剂量)、阳性对照组(抗幽门螺杆菌三联药)。除正常组外,剩余各组均予小鼠幽门螺杆菌菌液0.8 mL 灌胃,隔天1 次,共5 次。待幽门螺杆菌定植成功后开始进行分组干预,不同剂量清热化湿方组的小鼠分别按低、中、高(2.71、5.43、10.86 g/kg) 剂量灌胃,1 d/次,持续28 周;阳性对照组(兰索拉唑肠溶胶囊+克拉霉素+阿莫西林) 的小鼠按成人用药的6 倍给药灌胃。同时予干预组小鼠MNU 悬液 [MNU-水 (5 mg ∶3 mL)] 0.3 mL 灌胃,每周1 次,持续10 周;并注意观察各小鼠一般情况。末次给药后处死全部小鼠,沿胃小弯纵轴将胃组织分为两半,一半做快速尿素酶试验,另一半置于10%中性甲醛、电镜固定液中备测。
2.3 小鼠胃组织形态学改变及超微结构变化 常规HE 染色,光镜下观察炎症和癌变情况;使用醋酸铀染色,透射电镜下观察小鼠胃黏膜超微结构变化。
2.4 RT-PCR 检测胃黏膜IL-8、TLR-4 及TNF-αmRNA 表达 以β-actin为内参,检测胃黏膜IL-8、TLR-4 及TNF-αmRNA 表达,采用TRIzol 法提取RNA,然后取2 μg RNA进行逆转录得到cDNA,将逆转录的cDNA 稀释10 倍,作为模板进行PCR 检测。反应条件为95 ℃120 s~95 ℃5 s~60 ℃30 s,35~40 循环。以目的基因与内参的mRNA 表达比值作为目的基因的相对表达量。

表1 引物序列
2.5 Western blot 检测胃黏膜IL-8、TLR-4 及TNF-α 蛋白表达 以GADPH 抗体为内参,检测胃黏膜IL-8、TLR-4 及TNF-α 蛋白表达,采用凝胶成像系统扫描,以特异性条带浓度与面积的乘积为有效值,反映蛋白表达水平。具体步骤为蛋白制备,SDS-聚丙烯酰胺凝胶电泳,转膜、封闭、抗原抗体反应,显色、检测分析。
2.6 统计方法 用SPSS 24.0 软件进行统计学分析,计量资料用() 表示,符合正态分布,采用方差分析;等级资料采用秩和检验。以P≤0.05 表示差异具有统计学意义。
3 结果
3.1 小鼠一般情况 造模第13 周开始,模型组部分小鼠出现精神差、食欲不振、毛发脱落、慵懒嗜睡等现象,有4 只小鼠死亡;正常组小鼠一般情况尚可;清热化湿方组、阳性对照组中各有2 只小鼠死亡。经解剖发现,模型组部分死亡的小鼠腹腔脏器有穿孔、粘连、局部黑变等现象。
3.2 光镜下各组小鼠胃黏膜组织病理学变化 图1 可见光镜下正常组无改变;小鼠胃癌造模成功率约70%,模型组癌变率占66.67%,模型组符合中分化腺癌改变;药物干预后,清热化湿方组散在溃疡改变,未见异型细胞。阳性对照组炎性细胞浸润,符合溃疡改变,可见少许异型细胞。
3.3 吉姆萨染色检测各组小鼠幽门螺杆菌感染情况 图2可见正常组无幽门螺杆菌感染;模型组、阳性对照组、清热化湿方组胃黏膜细胞核呈蓝色或紫色,胞浆呈粉红色,幽门螺杆菌呈平滑的淡蓝色至蓝色,弯曲状或弧形,菌体清楚,主要分布在胃黏膜及胃小凹表面,呈单个散在、片灶状或成团聚集,组织背景清晰,胃黏膜病变易见。提示模型组、阳性对照组、清热化湿方组幽门螺杆菌定植成功。
3.4 各组电镜下小鼠胃黏膜超微结构变化 图3 可知正常组无明显改变;模型组细胞间隙连接结构严重破坏,癌细胞散在于间质中;清热化湿组细胞间隙连接结构破坏,分化较差的上皮细胞和肠化生细胞核质比大于1,见少许凋亡小体。阳性对照组细胞间隙连接结构破坏,分化较差,见少许凋亡小体。
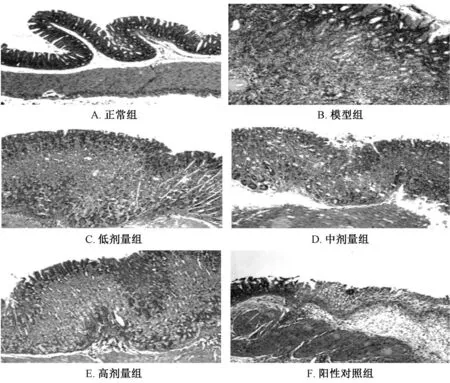
图1 光镜下各组小鼠胃黏膜组织病理学变化
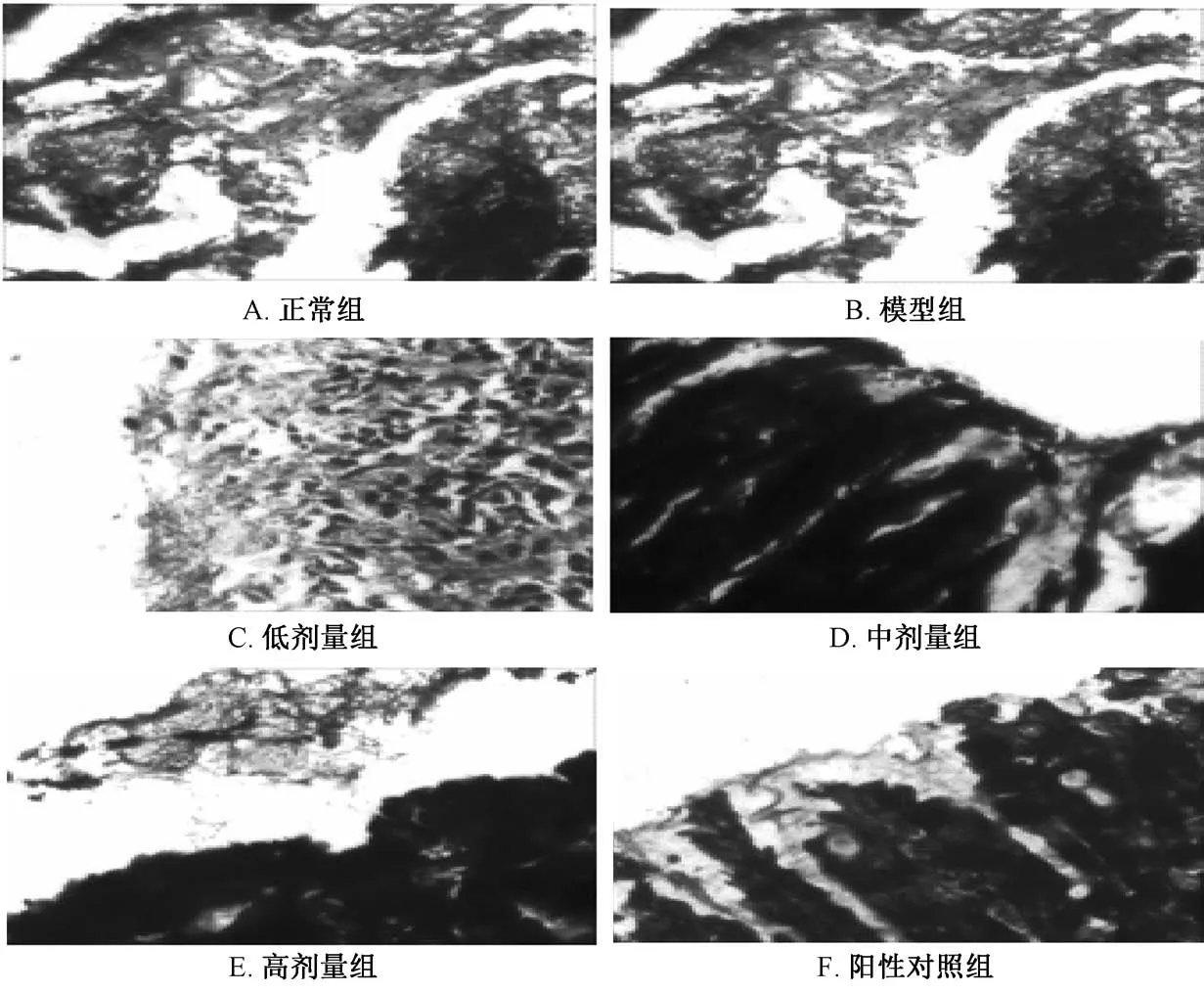
图2 吉姆萨染色检测各组小鼠幽门螺杆菌感染情况(×40)
3.5 各组小鼠胃黏膜IL-8、TLR-4、TNF-α 蛋白表达 与正常组比较,模型组IL-8、TLR-4、TNF-α 表达上升,差异有统计学意义(P<0.05);与模型组比较,清热化湿方组IL-8、TLR-4、TNF-α 表达下降,差异有统计学意义(P<0.05)。
3.6 各组小 鼠胃黏 膜IL-8、TLR-4、TNF-α mRNA 表达 与正常组比较,模型组IL-8、TLR-4、TNF-α 表达上升,差异有统计学意义(P<0.05);与模型组比较,清热化湿方组IL-8、TLR-4、TNF-α 表达下降,差异有统计学意义(P<0.05)。见图5。
4 讨论
以中医理念探讨胃癌病机,祖国医学认为,饮食不节,情志失调,脾胃受损,运化升降失常,使气结痰凝,瘀停热蕴,气、痰、瘀、毒互结胃腑而成。中医胃癌治则始终以保护脾胃正气,推动其运化生气血,条达升降之职。课题组以清热化湿、健脾和胃的治则,选择清热化湿方探讨该方防治胃癌的相关机制;方中淡豆豉、藿香芳香透表湿,开郁阳气;藿香、白蔻仁、厚朴芳香化湿,佐半夏行运脾化湿之功;杏仁开泄肺气于上焦,肺气宣降,水道自调,而治湿宜利小便,水道通调,则湿有去路,故茯苓、猪苓、泽泻、薏苡仁相伍通渗下焦。黄连擅清中焦湿热之邪,栀子清三焦之火。诸药合用,宣化表里湿热,通调上、中、下三焦,奏清热化湿、健脾和胃功效[4-7]。
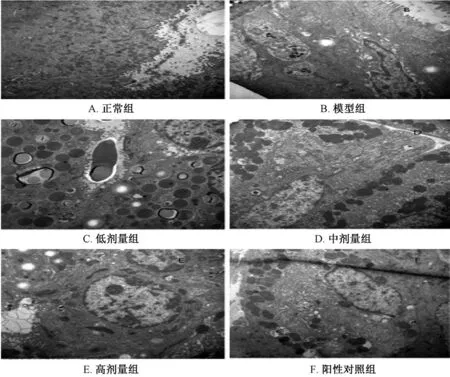
图3 各组小鼠电镜下胃黏膜超微结构变化(×12 000)
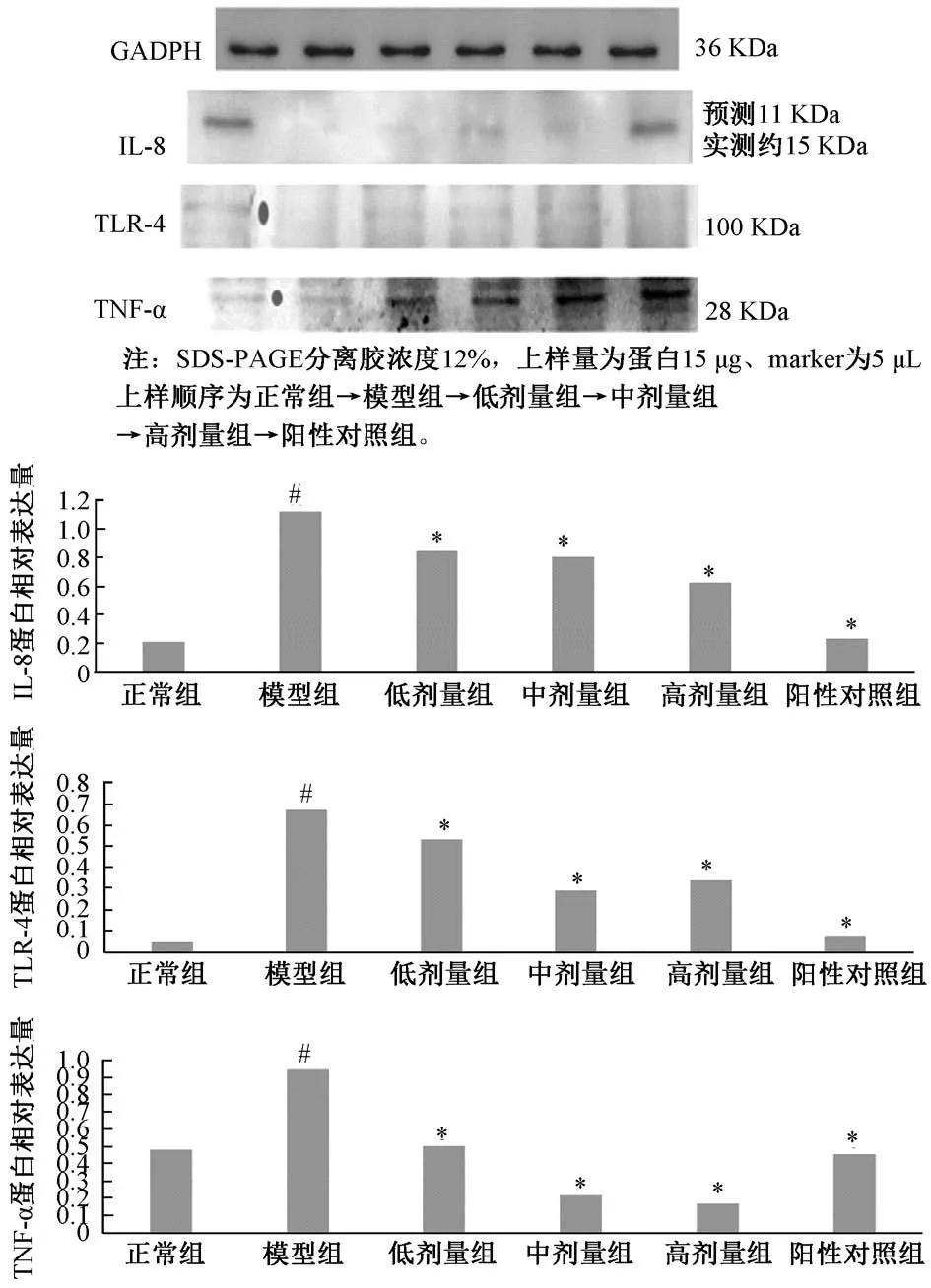
图4 各组小鼠胃黏膜IL-8、TLR-4、TNF-α 蛋白表达
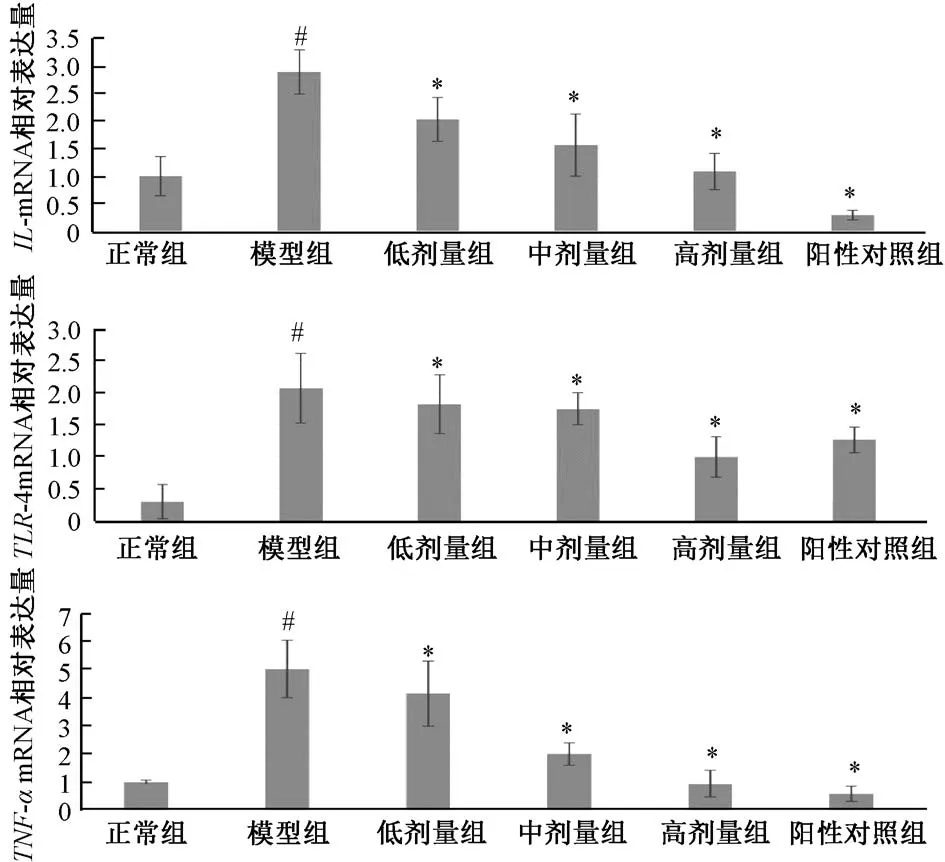
图5 各组小鼠胃黏膜IL-8、 TLR-4、 TNF-α mRNA 表达
研究报道,幽门螺杆菌感染参与了胃癌的演变过程[8],幽门螺杆菌可刺激胃上皮细胞产生炎症因子,如IL-8、TNF-α 等,而幽门螺杆菌要启动炎症因子必须借助TLR-4 受体,该受体参与识别细菌细胞壁中的脂多糖(LPS),几乎所有的TLRs 都能激活MyD88 依赖性的通路而诱发炎症反应,而有相关报道说明,在MiR-155 的多个靶点中,MyD88 被认为是IL-8 调控的靶点,MiR-155 可能通过抑制翻译而下调蛋白MyD88 的表达进而降低IL-8 的产生[9-10]。经研究表明,幽门螺杆菌感染可促进IL-8 在胃黏膜中过度表达,且IL-8 的高表达与胃癌预后不良呈直接相关[11]。相关研究表明IL-8 rs4073 多态性可能作为亚洲人胃癌的遗传生物标记物[12]。相关Meta 分析表明,TNF-α基因多态性与胃癌风险有关,尤其是对亚洲人而言[13]。据研究表明,TNF-α-85 7C/T、IL-8-845 T/C 功能多态性均可明显增加胃癌或慢性胃炎的发生风险,还观察到多态性C 等位基因携带者的IL-8 基因表达水平显著增高[14]。研究发现,TLR-4 中的rs4986790 和rs4986791 多态性可以作为预测幽门螺杆菌诱发胃癌风险的遗传标记[15]。这进一步阐明IL-8、TLR-4、TNF-α 均参与诱导炎症免疫,且在胃癌的进展中起重要作用。由此说明,由慢性胃炎发展至胃癌过程中,必须在幽门螺杆菌感染基础上通过介导TLR-4 信号通路激活下游靶基因MyD88,使AP-1 转录因子产生核易位进而调节IL-8,此时TNF-α 也加速了炎症反应进程。本研究发现,清热化湿方干预MNU 联合幽门螺杆菌感染小鼠后,其胃黏膜组织IL-8、TNF-α 及TLR-4 蛋白和mRNA 表达均呈下降趋势,提示清热化湿类方药可以调控IL-8、TNF-α、TLR-4 表达,发挥防治胃癌的效应。基于本实验结果,下一步可以从胃癌的靶向分子治疗角度,筛选出与TLR-4 信号通路密切相关靶基因,拟采用分子生物技术调控该靶基因下游相关蛋白,并检测相关指标表达。同时结合清热化湿方药进行干预,进一步揭示清热化湿类方药干预胃癌的作用机理与有效靶点,开拓中医药防治胃癌的新领域。

