高耐受酿酒酵母的筛选及酵母曲制备工艺的优化
李晓欢,何宏魁,2,李冬冬,李 兰,曹润洁,周庆伍,2
(1.安徽古井贡酒股份有限公司,安徽亳州 236820;2.安徽省固态发酵工程技术研究中心,安徽亳州 236820)
长期以来,浓香型白酒一直占据着白酒消费的主流市场,但其产能一直深受夏季“压池子”工艺的制约。夏季环境温度高导致入池酒醅温度高,不利于酵母菌的生长繁殖和产酒。同时在白酒的整个发酵过程中窖池的pH 值是逐渐降低的,当窖池酸度下降至pH≤4.5 后,酵母菌的生理代谢活动逐渐受到抑制,对发酵原料的转化利用能力及乙醇的发酵生产能力也逐渐下降,甚至停止[1-2]。因此,选育能够在白酒发酵生产后期的高酸度环境条件下以及在夏季高温高酸度的环境下仍具有旺盛的生理代谢活动、较强原料转化利用及乙醇发酵生产能力的酿酒酵母菌,是传统白酒生产过程中提高原料转化利用率和白酒产量的技术关键。
本研究以大曲为研究对象,通过菌种的分离、纯化、扩培以及筛选、鉴定等相关试验,从大曲中筛选出一株耐酸、耐高温且产酒能力强的酵母菌。对筛选出的优良酵母菌的酵母曲制备工艺进行优化,最终研制成性能良好的酿酒酵母曲,为今后酵母曲的推广应用提供质量保障。
1 材料与方法
1.1 材料、试剂及仪器
1.1.1 耗材及试剂
实验材料:浓香型大曲。
培养基:①孟加拉红培养基,121 ℃灭菌30 min;②种子培养基:葡萄糖20 g,胰蛋白胨20 g,酵母膏10 g,蒸馏水1000 mL,pH5.0~5.5,115 ℃灭菌20 min;③固体培养基:葡萄糖20 g,胰蛋白胨20 g,酵母膏10 g,琼脂20 g,蒸馏水1000 mL;④固态培养基:麸皮、水。
1.1.2 实验仪器
SX-700 高压灭菌锅(日本,TOMY)、Heratherm IMH400-S 生化培养箱、MaxQ-485HP 震荡培养箱、200 L 不锈钢发酵罐系统、3 吨级圆盘制曲机。
1.2 实验方法
1.2.1 菌株初筛
将浓香型大曲制备成菌悬液,进行梯度稀释后涂布到孟加拉红培养基中,挑取单菌落,对浓香型大曲中的酵母菌进行分离纯化,利用TTC法初筛出产酒能力较强的酵母菌[3]。
TTC 法:将TTC(2,3,5-氯化三苯基四氮唑)加入固体培养基中,再将分离纯化出的酵母菌划线至固体培养基,28 ℃恒温培养,TTC 作为显色剂对酵母的代谢产物发生呈色反应,可以判断酵母生长过程呼吸酶活力的大小[4-5](即酵母产酒精能力的强弱)。
1.2.2 菌株复筛
从耐酸性、耐温性、产酒能力等方面对初筛出的酵母菌株进行复筛,最终筛选出产酒能力、耐酸、耐高温性能具佳的酵母菌株。
1.2.3 酵母曲制备单因素条件优化
酵母曲生产工艺见图1。根据酵母菌特性从酵母曲培养时间、培养温度、培养基小麦粉添加量、培养基水分、种子液接种量几个方面进行单因素实验,以制备出的酵母曲中酵母菌活菌数为酵母曲质量判断标准。
1.2.4 酵母曲制备正交实验设计
在单因素试验的基础上,设计L9(33)正交试验对酵母曲圆盘生产工艺进行优化设计。选取培养时间、培养基水分、培养基小麦粉添加量3 个因素进行考察,每个考察因素设立3个水平进行试验。
2 结果与分析
2.1 菌种筛选
2.1.1 TTC初筛
根据酵母在培养基上的菌落特征,挑起具有代表性、出现频率较高的菌落纯化,获得41 株酵母菌。TTC 法初筛,其中产酒能力较强的菌株颜色为深紫色,次之成粉色,如图2所示。
结果显示:编号为YTHG01、GJYD02、NJ-9 的3株菌株颜色较深,呈深紫色。
2.1.2 复筛
2.1.2.1 菌种耐高温性能实验
将种子液接种于液体培养基中,分别置于28 ℃、32 ℃、36 ℃、40 ℃和45 ℃条件下静止发酵24 h,在660 nm 下测定培养液吸光值(OD),以空白培养基为对照,结果如图3所示。
由图3可以看出,初筛出的YTHG01、GJYD02、NJ-9 这3 株菌均能在45 ℃条件下生长,且YTHG01和GJYD02较NJ-9生长较好。
2.1.2.2 菌种耐酒精能力实验
将种子液分别接种于乙醇起始浓度为0%vol、5%vol、10%vol、15%vol、20%vol 的液体培养基中,置于28 ℃恒温培养箱中静止培养24 h,观察菌种生长情况,在660 nm 下测定培养液吸光值(OD),以空白培养基为对照,结果如图4所示。
由图4 可以看出,3 株菌均在酒精含量15%vol时OD 值仍达到0.4 左右,可见菌株可耐受15%vol以上的酒精含量,且GJYD02 菌株的酒精耐受性最强。
2.1.2.3 菌种耐酸能力性能实验
将种子液接入至初始pH 值不同(pH2.0、3.0、4.0、5.0、6.0、7.0)的液体培养基中,在28 ℃振荡培养24 h,利用分光光度计在660 nm 下测定菌液OD值,以空白培养基为对照,结果如图5所示。
由图5 可以看出,在pH 值2~7 范围内,随着pH 值的升高,酵母菌株的生长状况越好,当pH3 时3 株初筛出的酵母菌均能生长,而在pH2 时,只有GJYD02 生长较好,可见GJYD02 菌株可耐受pH2的高酸环境,耐酸性能较好。
2.1.2.4 产乙醇能力实验
种子液按照10%的接种量接种于高粱培养基中,28 ℃培养,分别对发酵3 d、5 d、7 d 的发酵液测定馏出液酒精度,结果如表1所示。
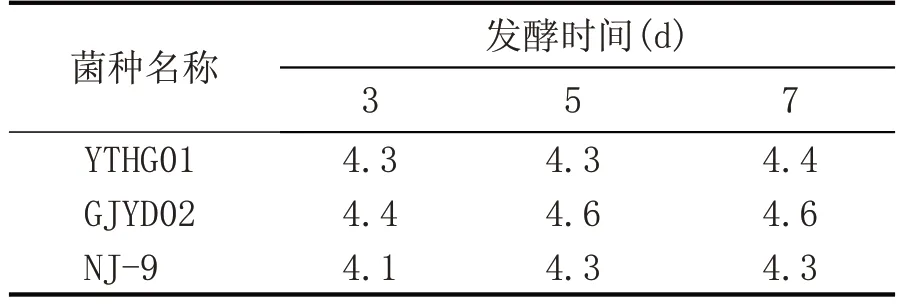
表1 不同菌株随发酵时间产乙醇情况 (%vol)
由表1可以看出,GJYD02菌株产乙醇量最高。
2.1.2.5 杜氏小管乙醇耐受性验证试验
根据以上实验结果,选取耐酸、耐高温性较好、产乙醇能力较强的GJYD02 菌株进行乙醇耐受性验证试验[6],按照10%的接种量将菌株接种到乙醇浓度不同的液体培养基中,培养24 h 后,观察酵母产气情况,结果如表2所示。
从表2 可以看出,酒精浓度低于17%vol 时,都能有明显的产气,17%vol、18%vol 有微弱的产气,19%vol 后产气不明显;综上,GJYD02 酵母菌的乙醇耐受性为18%vol。
2.1.2.6 菌种分子鉴定结果
提取GJYD02 酵母菌的基因片段,测序得到的26S rDNA 基因序列,保留其可靠的587 bp 序列进行系统发育分析,通过NCBI 的BLAST 比对,获得同源性较高的已知分类单元,然后用MEGA6 软件将这些序列构建系统发育树见图6。
GJYD02 的可靠序列与酿酒酵母(Saccharomyces cerevisiae)的序列相似性为100%,因此确定复筛出的耐酸、耐高温、产酒能力强的优良酵母GJYD02为1株酿酒酵母。

表2 菌株乙醇耐受性实验结果
2.2 酵母曲制备单因素试验
将筛选出的优良酿酒酵母用于酵母曲生产,目的就是为了利用原料富集该优良酵母,因此以酵母曲中酵母菌的数量作为酵母曲质量的判断标准[6-8]。
2.2.1 培养基水分对制备酵母曲的影响(图7)
分别制备水分含量为40%、45%、50%、55%、60%的固态培养基,接种相同量的酵母菌液,28 ℃恒温培养24 h,对曲样进行低温风干,测定每克绝干曲中酵母菌活菌数。根据试验结果可以看出,在培养基水分为45%、55%时,酵母曲中活菌数最多。
2.2.2 小麦粉对制备酵母曲的影响
麸皮中淀粉含量较少,不能为酵母的生长提供足够的碳源,小麦是制备浓香型大曲的主要原料,且小麦淀粉含量高,因此本实验考察在固态培养基中分别添加0%、10%、20%、30%、40%的小麦粉对酵母曲制备的影响,结果如图8所示。
根据试验结果可以看出,在固态培养基中添加一定量的小麦粉对酵母曲中的酵母数影响较显著,当添加量为10%时,酵母曲中的酵母菌数较高,然后逐渐下降。
2.2.3 培养时间对制备酵母曲的影响(图9)
将酵母菌液以10%的接种量接入固态培养基中,考察28 ℃情况下,培养时间(24 h、36 h、48 h)对酵母曲制备的影响。结果表明在24 h 时酵母曲中活菌数最多,随着时间的延长,菌量会有所下降。
2.2.4 菌种添加量对酵母曲制备的影响(图10)
接种量的大小可以决定菌种在固态培养基中生长繁殖的速度,采用较大的接种量可以缩短酵母曲的培养时间,并可减少染杂菌的几率,但较大接种量会增加种子液制备的难度,造成生产成本的增加,也会对酵母曲的活性产生一定影响。
接种量在2%~8%范围内,随着接种量的增加,制备出的酵母曲中的活菌数逐渐增加,之后接种量增加,活菌数变化不明显。从实验结果可以看出最佳接种量为8%。
2.3 正交试验设计
如上单因素分析表明,培养时间、培养基水分、培养基中小麦粉的添加量对酵母曲制备影响较为显著,故围绕各因素的最优点,设计正交实验方案,结果如表3。
正交实验结果分析表明,制备酵母曲过程中影响酵母曲质量的3 个因素的主次顺序为培养基小麦粉添加量、培养时间、培养基水分,且最优组合条件为A3B2C2,即小麦粉添加量为10%、培养时间为24 h、培养基水分为60%。该结果与直接分析结果一致。通过实验验证,在最优条件下进行酵母曲制备,酵母曲中酵母菌数验证结果为7.5×108cfu/g,比初始条件下酵母曲中酵母菌数增加了50%。

表3 正交实验方案与结果
3 结论
本试验从浓香型大曲中分离纯化出酵母菌,首先通过TTC 法进行初筛,其次从产酒能力、耐酸性、耐高温性等方面进行复筛,最终筛选出1 株具有产酒能力强、耐酸、耐高温性能特点优良的酵母菌种,经分子生物学鉴定,确定该酵母菌为酿酒酵母(Saccharomyces cerevisiae)。将该株酿酒酵母作为生产菌种用于酵母曲的制备,制备出富含此优良酿酒酵母的酵母曲。对酵母曲的制备工艺进行优化,通过对固态培养基水分、酵母曲培养时间、酵母菌接种量、培养基小麦粉添加量等因素进行单因素试验,并在单因素试验的基础上,选择对酵母曲质量影响较大的固态培养基水分、酵母曲培养时间、培养基小麦粉添加量3 个因素进行L9(33) 正交试验,获得了酿酒酵母制备酵母曲的较优的制备工艺,即小麦粉添加量为10%、培养时间为24 h、培养基水分为60%。在最优条件下进行酵母曲制备,酵母曲中酵母菌数验证结果为7.5×108cfu/g,比初始条件下酵母曲中酵母菌数增加了50%。综上所述,本文将大曲中筛选出的优良酿酒酵母应用于酵母曲生产中,并对酵母曲制备工艺进行优化,制备出的酵母曲发酵能力强,耐高温,耐强酸,生产周期短,适用于白酒生产中。

