丝状真菌改善强化曲品质的研究
霍颖玙,赵 娟,李宪德,何志远,邱树毅
(1.贵州大学贵州省发酵工程与生物制药重点实验室,贵州贵阳 550025;2.贵州大学酿酒与食品工程学院,贵州贵阳 550025;3.山东杨湖酒业有限公司,山东菏泽 274000;4.中粮黑龙江酿酒有限公司,黑龙江哈尔滨 152000)
白酒大曲是一个复杂的含有多菌酶类的曲块。大曲中的物质归纳起来可以分为菌系、酶系、物系。其中微生物是至关重要的一部分。大曲中的微生物主要可以分为3 类:丝状真菌、酵母菌和细菌。丝状真菌在大曲中起着产生糖化动力的作用。大曲里的丝状真菌除了能给大曲提供糖化动力以外,还对大曲的培养起着关键性作用。丝状真菌的菌丝长入大曲坯体,可以引出曲块中的水分使大曲中的水不至于找不到出口而膨胀裂口。丝状真菌的孢子有着色作用,可以使大曲形成五颜六色的曲块,而大曲的颜色也是评定大曲质量的重要标准之一。
在大曲的制作过程中应该让适合于发酵的有益丝状真菌最大限度的生长繁殖。赵盈盈等[1]将多种霉菌接种于不同的原料制曲,探究出利用大米制曲对于玉米清酒的酿酒效果最好,以糖化力与液化力为筛选指标,选出1 株高糖化力、液化力的霉菌,利用此株霉菌制成米曲,验证了该曲可以发酵出品质较好的玉米清酒。严启梅等[2]将1 株高糖化能力的根霉应用于中试绵柔型酒生产,糖化醅糖化效果比原小曲提高15%~25%,同时也提高了基酒质量与出酒率。宫若楠[3]在衡水老白干大曲中筛选出1 株高酯化力的毛霉,将其制作成纯种的麸曲,在最适的培养条件下最高酯化力263.55 mg/g 麸曲(以乙酸乙酯计)。刘畅等[4]将米曲霉、黑曲霉与根霉分别制成酒曲,并通过酒曲α-淀粉酶活力、蛋白酶活力和糖化酶活力的测定最终筛选出米曲霉是最适宜制作酒曲的霉菌菌株。俞剑燊等[5]将两株高产糖化酶和蛋白酶的霉菌混合制曲进行黄酒模拟发酵,发现混合制曲发酵黄酒中还原糖和氨氮的生成速率显著高于纯种制曲。本研究将丝状真菌加入强化曲的制作中,在强化曲的发酵过程中,探究丝状真菌对酵母、芽孢杆菌生长的影响。对强化曲进行理化指标与风味物质成分分析,研究所添加丝状真菌是否对强化曲的制作产生积极作用。
1 材料与方法
1.1 材料、试剂及仪器
1.1.1 菌种来源
实验所用的谢瓦散囊菌FBKL 3.0004、宛氏拟青霉FBKL 3.0005、分枝犁头霉FBKL 3.0009、黄曲霉FBKL 3.0010、皮落青霉FBKL 3.0011、溜曲霉FBKL 2.0018、地衣芽孢杆菌FBKL 1.0199、毕赤酵母FBKL 2.0002 均由本课题组从贵州茅台酱香型白酒生产用曲中分离筛选得到。
1.1.2 主要化学试剂及培养基
干酪素、无水碳酸钠、磷酸二氢钾,天津市海光化学试剂厂;福林-酚,北京索莱宝生物科技有限公司;三氯乙酸、冰乙酸、乙酸钠,重庆北碚精细化工厂;磷酸氢二钾,成都市科龙化工试剂厂。
YEPD培养基、LB培养基、孟加拉红培养基、营养琼脂培养基、察氏培养基等均购于化学试剂商店。
麸皮培养基:将麸皮与蒸馏水以1∶1 混合,用玻璃棒搅匀,121 ℃灭菌20 min。
1.1.3 仪器设备
离心机,美国贝克曼库尔特有限公司;Stable Flex 纤维头(DVB/CAR/PDMS),美国Supelco 公司;7890A-5975C 气相色谱质谱(gas chromatography-mass spectrometer,GC-MS)联用仪,安捷伦科技有限公司;FA1004 电子天平,上海箐海仪器有限公司;KQ-300DE 数控超声波清洗器,昆山市超声仪器有限公司。
1.2 试验方法
1.2.1 糖化酶活力测定
将霉菌在斜面培养基上活化后,接种于斜面培养基上30 ℃条件下培养7 d,在无菌条件下加入5 mL 的灭菌生理盐水,用移液枪反复冲洗孢子呈孢子悬浮液,取1 mL 孢子悬浮液加入已灭菌的麸皮培养基中,使得培养基中有107CFU/g 个孢子。用玻璃棒搅匀,在30 ℃条件下培养72 h,每隔12 h摇匀1 次。72 h 以后,取相当于10 g 的绝干培养物于100 mL 蒸馏水中,在40 ℃水浴锅中保温1 h,每隔15 min 搅拌1 次,过滤,滤液为粗酶液,用于酶活测定。糖化酶的测定参照《白酒生产技术全书》[6]。
1.2.2 还原糖含量的测定
采用DNS法测定还原糖含量[7]。
1.2.3 菌悬液的制备及强化麦曲制备
毕赤酵母菌悬液:从PDA 培养基中挑取1 环活化好的酵母菌菌苔于YPD 培养基中,30 ℃,180 r/min振荡培养48 h。
地衣芽孢杆菌菌悬液:从营养琼脂培养基中挑取1 环活化好的芽孢杆菌菌苔于LB 培养基中,37 ℃,150 r/min条件下培养24 h。
分枝犁头霉孢子菌悬液:从斜面培养基中挑取1 环霉菌孢子于麦芽汁培养基中,麦芽汁培养基中添加少许玻璃珠。30 ℃,180 r/min振荡培养72 h。
将地衣芽孢杆菌、毕赤酵母菌、分枝犁头霉的菌悬液在无菌条件下加入灭菌后的小麦培养基中,用无菌玻璃棒搅拌混匀。接种后地衣芽孢杆菌、毕赤酵母菌、分枝犁头霉的接种比例分别为1∶10∶0.1、1∶10∶0.5、1∶10∶1、1∶10∶5,接种后地衣芽孢杆菌的数量为5×106CFU/g。之后用8 层纱布与牛皮纸密封,放于30 ℃培养箱静置培养,每2 d 进行1次取样。
1.2.4 样品生物量测定
称取10 g 样品放于盛有90 mL 无菌生理盐水的三角瓶中,充分振荡30 min,取1 mL 充分稀释,吸取稀释液涂布于培养基中,培养计数。
1.2.5 大曲理化指标的测定
250 mL 三角瓶中加入10 g 样品,再加100 mL蒸馏水,在40 ℃的条件下水浴1 h,每15 min 搅拌1次,然后用定性滤纸过滤,将开始的5 mL 弃去,之后过滤滤液为测定酶活所需的粗酶液。
参照QB/T 4257—2011《酿酒大曲通用分析方法》中的测定方法对大曲水分、淀粉、酸度、液化力、糖化力、酯化力、发酵力进行测定。
1.2.6 GC-MS分析
采用顶空固相微萃取(HS-SPME)技术结合GC-MS 分析麦曲中挥发性成分[8-11]。样品处理:取麦曲粉0.2 g 加入5 mL 水中,超声波处理30 min。GC-MS 条件:安捷伦6890N 气相色谱配备5975质谱仪。毛细管柱DB-Wax(30 m×0.25 mmi.d.×0.25 μm),进样口和检测器温度均为250 ℃,载气为He,流速2 mL/min。程序升温:起始温度50 ℃,保持2 min,然后以2 ℃/min 的升温速率升温到85 ℃,保留0.1 min,再以5 ℃/min 的升温速率升温到230 ℃,保持2 min。电子轰击能量70 eV,离子源温度230 ℃。质谱分析用数据库为Wiley275.L(Agilent公司)和NIST库。
2 结果与分析
2.1 产糖化酶霉菌的筛选
从本课题组筛选出的丝状真菌中挑选出6 株菌,分别为FBKL3.0004 谢瓦散囊菌、FBKL3.0005宛氏拟青霉、FBKL3.0009分枝犁头霉、FBKL3.0010黄曲霉、FBKL3.0011 皮落青霉、FBKL3.0018 溜曲霉。使其以孢子悬浮液的形式固定添加量添加到麸皮中发酵3 d 后,测定糖化酶的活力,结果如图1所示。
从图1 可以看出,在同样的接种量与培养环境下,分枝犁头霉FBKL3.0009 的糖化酶活力最高为730 U/g。其次是宛氏拟青霉FBKL3.0005 糖化酶活力为660 U/g,皮落青霉FBKL3.0011 糖化酶活力为648 U/g,谢瓦散囊菌FBKL3.0004 糖化酶活力为609 U/g。溜曲霉FBKL3.0018与黄曲霉FBKL3.0010的糖化酶活力低于600 U/g,分别为550 U/g与574 U/g。所以选择分枝犁头霉FBKL3.0009 为功能菌,参与后续强化麦曲中的研究。
2.2 发酵过程中微生物生物量的变化情况
图2、图3 为地衣芽孢杆菌、酵母在发酵过程中的生长情况。
如图3 所示,地衣芽孢杆菌在发酵前期迅速增长,到了发酵中期生长速度下降,但地衣芽孢杆菌的生物量仍在增加,不同比例混合发酵时地衣芽孢杆菌的生物量变化趋势都很一致,呈不断增加的状态,在前期增加速率较快,到发酵末期,地衣芽孢杆菌的生物量都可以维持在3.9×1014~9.4×1014CFU/g,但是不同比例混合发酵时地衣芽孢杆菌的数量存在差异,随着分枝犁头霉生物量的增多,地衣芽孢杆菌的数量减少。而对照组发酵结束时地衣芽孢杆菌的生物量可达1.1×1017CFU/g,远高于混合发酵结束时地衣芽孢杆菌的生物量。对于毕赤酵母菌来说,其不同菌种混合比例发酵时毕赤酵母的生长变化趋势较为一致,主要呈现的是先增长后降低的状态。在发酵的前6~8 d 内,发酵体系的酵母菌在持续增长,酵母菌数量最高可以达到4.0×109CFU/g,在发酵第8 天以后,酵母菌数量开始下降,直到发酵结束时酵母菌生物量可维持在106~107CFU/g。同样,随着分枝犁头霉生物量的增多,毕赤酵母菌的数量也在减少。按照比例1∶10∶5添加分枝犁头霉的毕赤酵母数量最少,为8.7×106CFU/g。对照组发酵结束时酵母菌的生物量可达5.1×109CFU/g,混合发酵时酵母菌的数量远少于对照组。总的来说,分枝犁头霉的加入会影响地衣芽孢杆菌与毕赤酵母的生长,但影响不大。
2.3 发酵过程中糖化酶活力与还原糖含量的变化情况
图4、图5 为混合发酵体系中糖化酶活力及还原糖的变化情况。
如图4 所示,混合发酵体系中糖化酶活力先迅速上升,发酵第2 天时糖化酶活力达到最高,接着随时间的延长而逐渐降低直至发酵结束。各不同接种比例的实验组变化趋势相似。但是,分枝犁头霉添加量的不同,糖化酶活力也不一样。随着分枝犁头霉的增加,糖化酶活力也相应增大。在发酵第2 天时,接种比例为1∶10∶5 时糖化酶活力最高,可以达到252 U/g。接种比例为1∶10∶0.1 时糖化酶活力最低,为70 U/g。分析其原因,可能是因为混合发酵体系中,糖化酶主要来源于分枝犁头霉的代谢产生。分枝犁头霉的添加量与糖化酶的产生相关。混合发酵体系中分枝犁头霉的生长越旺盛,糖化酶的活力也就越高。而后期随着地衣芽孢杆菌与毕赤酵母菌的生长,消耗了混合发酵体系中的部分营养原料,使得分枝犁头霉的生长缓慢,代谢速率降低,糖化酶产量就减少了。除此之外,酵母菌代谢产生的有机酸和乙醇,除了抑制了分枝犁头霉的生长,也影响了糖化酶的活力。
如图5 所示,混合发酵体系中,还原糖含量也随发酵的进行而逐步减少,直到发酵结束。发酵第2天还原糖含量达到最大值。不同的接种比例的实验组,其变化趋势也相似。接种比例为1∶10∶5 的实验组还原糖含量最高可达到78 mg/g,接种比例为1∶10∶0.1的实验组,还原糖含量最低为55 mg/g。还原糖含量随着分枝犁头霉添加量的增加而增加。随着发酵时间的延长,还原糖含量也逐渐降低,在发酵结束时,分枝犁头霉添加量较多的实验组还原糖含量为45 mg/g。还原糖含量的变化趋势与糖化酶活力的变化趋势趋于一致,变化趋势都为先升高,后降低。可能是混合发酵体系中主要原料为小麦,小麦中含有大量的淀粉,淀粉通过地衣芽孢杆菌代谢产生的α-淀粉酶的分解产生糊精,随之分枝犁头霉代谢产生的糖化酶将糊精转化为葡萄糖等还原糖,所以混合发酵体系中的还原糖含量与糖化酶活力有很大的联系。随着糖化酶活力的降低,还原糖含量也会随之下降。除此之外,葡萄糖等还原糖也是发酵过程中糖化过程和乙醇生成过程中的中间产物,由糖化酶分解而成的葡萄糖可以在酵母代谢作用下产生乙醇。过多的葡萄糖可能会抑制糖化酶的生成,而过低的葡萄糖则会降低乙醇的发酵速率。葡萄糖同时被产生和消耗。发酵后期由于酵母菌的生长,生成的葡萄糖被消耗,造成乙醇和有机酸的积累,导致糖化酶活力的降低,减少了葡萄糖的生成,随即还原糖含量逐步减少。
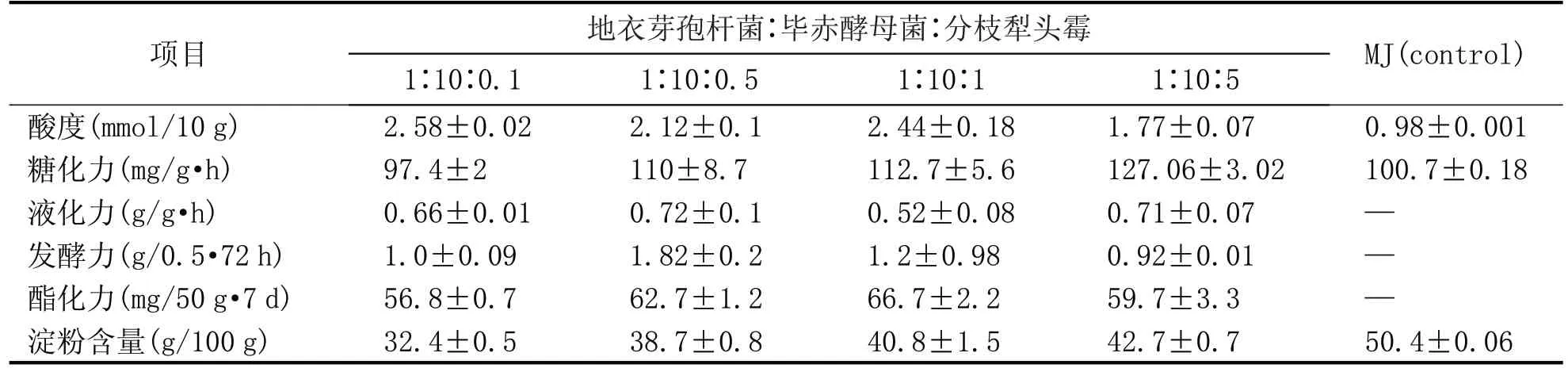
表1 强化麦曲的理化指标
2.4 强化麦曲理化指标检测结果
发酵14 d 以后的强化曲的理化指标检测结果见表1 和图6—图11。强化麦曲其酸度高于传统大曲,传统大曲的酸度为1.39 mmol/10 g,强化曲酸度在1.77~2.58 mmol/10 g,随着分枝犁头霉添加量的增加,酸度会有所降低,可能是因为大曲酸度的贡献主要来源于细菌与酵母的分解代谢,霉菌的添加使细菌与酵母生长缓慢,故酸度会有所降低。在只添加霉菌的对照组,酸度最低,低于传统大曲的酸度。
淀粉含量的测定结果见图7,强化曲的淀粉含量均低于传统大曲的淀粉含量。随着霉菌添加量的减少,淀粉的消耗量便逐渐增加。混合培养体系中的细菌会大量分解淀粉,随着霉菌添加量的增加,细菌的生长受到抑制,导致淀粉消耗量的减少。只添加霉菌的对照组的淀粉含量大于添加多种菌株的实验组,故淀粉的消耗与细菌的生长情况相关。
糖化力的检测结果图8,强化曲的糖化力远大于未添加霉菌制作的麦曲的糖化力。而且,随着霉菌添加量的增大,糖化力也在逐渐增加。霉菌添加量最多的实验组,糖化力为127.06 mg/g·h,与只添加霉菌的对照组相比,混菌发酵的强化曲糖化力要高于霉菌发酵的强化曲。可能因为地衣芽孢杆菌也可产生少量糖化酶。由此可知,霉菌的添加提高了强化曲的糖化力,而且地衣芽胞杆菌的存在,也对提高糖化力有积极作用,所以,添加霉菌培养强化曲的确对强化曲的糖化力有较大的提升作用。
液化力的检测结果见图9,混菌发酵的强化曲的液化力远远高于传统大曲的液化力,而霉菌的添加量对液化力并无太大影响。可能因为液化力主要来源于地衣芽孢杆菌产生的α-淀粉酶,具有水解淀粉的能力,产生大量的糊精。霉菌的生长代谢产生的糖化酶可以促进糊精分解产生葡萄糖,使糊精不会大量积累,抑制α-淀粉酶的产生。所以霉菌的添加并未对液化力有明显的抑制影响。
酯化力的检测结果见图10,混菌发酵所得强化曲酯化力高于只添加地衣芽孢杆菌制成的强化曲的酯化力。只添加地衣芽孢杆菌制得的强化曲酯化力为33.2 mg/50 g·7 d,而混菌发酵所得的酯化力为66.7 mg/50 g·7 d。强化曲中对酯化力起主要贡献意义的为酵母菌,霉菌的添加没有给酯化力有促进作用。
发酵力的检测结果见图11,混菌发酵所得强化曲的发酵力均高于传统大曲的发酵力,强化曲中的发酵力很可能是来源于酵母菌发酵代谢乙醇,此处结果说明,霉菌的添加并不会对强化曲的发酵力有太大的提升。
2.5 GC-MS风味物质分析结果
将各种比例混合发酵的麦曲样品进行HSSPME 结合GC-MS 分析。麦曲GC-MS 总离子图与成分分析图如图12所示。
在接种比例为1∶10∶0.1 麦曲样品中,共检测到20 种成分,烷烃类物质5 种,吡嗪类物质2 种,酮类物质1 种,酚类物质3 种,醇类物质5 种,醚类物质1种,醛类物质2 种。其中吡嗪类物质对酱香型白酒风味有贡献成分,四甲基吡嗪的相对百分含量为0.163%。苯乙醇相对百分含量最高为20.774%,苯乙醇具有类似于花香的味道。相比没有添加霉菌发酵的麦曲样品中,检测出1 种新的香气物质为蘑菇醇,又名1-辛烯-3-醇。蘑菇醇常用于日用与食用香精,具有蘑菇、薰衣草、玫瑰和干草香气。愈创木酚含量为1.002%,未检测到酸类物质。
接种比例为1∶10∶0.5 麦曲样品风味成分含量见图13。
在接种比例为1∶10∶0.5 麦曲样品中,共检测到21 种成分,烷烃类物质3 种,吡嗪类物质3 种,酮类物质2 种,酚类物质3 种,醇类物质5 种,醚类物质1种,醛类物质3 种。其中,吡嗪类物质所占相对百分比含量为0.306%。麦曲样品成分以醇类物质居多,含量最高的为苯乙醇,相对百分比含量为5.803%。愈创木酚相对百分比含量为0.245%,未检测到酸类物质。
接种比例为1∶10∶1 麦曲样品的风味成分含量见图14。
在接种比例为1∶10∶1 麦曲样品中,共检测到19 种成分,烷烃类物质3 种,烯烃类物质1 种,吡嗪类物质3 种,酚类物质3 种,醇类物质4 种,醚类物质1 种,醛类物质3 种,酯类物质1 种。其中,成分物质以醇类物质占主要,醇类物质相对百分比含量为7.605%,苯乙醇含量为7.023%,蘑菇醇含量为0.215% 。吡嗪类物质相对百分比含量为0.167%。愈创木酚含量为0.33%,未检测到酸类物质。
接种比例为1∶10∶5 麦曲样品风味成分含量见图15。
在接种比例为1∶10∶5 麦曲样品中,共检测到18 种成分,烷烃类物质3 种,吡嗪类物质2 种,酚类物质2 种,醇类物质4 种,醚类物质1 种,醛类物质3种,酮类物质1 中,吡啶类物质1 种。其中,醇类物质占主要,相对百分比含量为8.906%。其中以苯乙醇含量最多为6.637%,蘑菇醇的相对百分含量为0.46%。酚类物质中愈创木酚的相对百分含量为2.286%。未检测到酸类物质。
只添加毕赤酵母与地衣芽孢杆菌发酵的麦曲样品风味成分含量见图16。
在只添加酵母与细菌进行发酵的麦曲样品中,共检测到15 种成分,烷烃类物质1 种,吡嗪类物质2 种,酚类物质3 种,醇类物质4 种,酸类物质2 种,醛类物质2种,酮类物质1种。其中,吡嗪类物质相对百分比含量最高为24.371%,其中四甲基吡嗪占23.7%。其次为醇类物质为20.965%,其中苯乙醇占19.776%,醇类物质中未检测到蘑菇醇。酸类物质所占相对百分比含量为4.905%。未检测到醚类物质。
3 结论
综上所述,霉菌、酵母与细菌混合培养发酵所得的强化麦曲,其风味物质成分中都以醇类物质居多,其中又以苯乙醇占主要。此外,也可检测出四甲基吡嗪、愈创木酚等对酱香风味有贡献意义的物质,但是相比于仅添加细菌与酵母菌发酵的强化麦曲样品来说,吡嗪类物质与醇类物质的含量大大降低。这表明,霉菌的添加,可能对吡嗪类、醇类物质的产生有一定的抑制作用。

