miR-155-5p靶向SEP15基因在H2O2诱导的人晶状体上皮细胞损伤中的作用
张虹 陈颖平 陈圣文
白内障是全球致盲和视力损害的重要原因[1],其主要是由晶状体上皮细胞(lens epithelial cells,LECs)损伤引起的晶状体混浊[2]。研究表明,miR-155-5p在结核性脑膜炎[3]、类风湿性关节炎(RA)[4]和病毒性心肌炎[5]患者血浆或血清中的表达量均显著升高,是RA潜在诊断指标,可加重心肌细胞损伤并促进心肌细胞凋亡,说明miR-155-5p对细胞炎症损伤有重要作用。本研究通过TargetScan预测发现,相对分子质量为15 000的硒蛋白(15 000 Selenoprotein,SEP15)可能是miR-155-5p的靶基因。SEP15基因敲除的小鼠在出生1.5个月后就出现显著的核性白内障,表明SEP15为小鼠眼晶状体正常发育和生长所必需[6]。SEP15基因沉默加剧了高糖在LECs分化过程中对整合素的影响,说明SEP15对LECs的分化具有相应的保护作用[7]。SEP15基因敲减可促进衣霉素诱导的HLECs的凋亡和氧化应激[8]。但miR-155-5p及SEP15在H2O2诱导的人LECs(HLECs)中的表达、两者关系及对HLECs细胞损伤的影响目前还不清楚。本研究通过建立HLECs细胞系HLE-B3的H2O2损伤模型,研究miR-155-5p对H2O2诱导的HLE-B3细胞损伤、凋亡的影响,并探讨SEP15在此机制中的作用。
1 材料与方法
1.1 材料HLE-B3购自中国科学院上海细胞库。胎牛血清(fetal bovine serum,FBS)和高糖DMEM培养基购自美国Gibco公司;胰蛋白酶Trypsin购自美国Sigma-Aldrich公司;丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)ELISA检测试剂盒购自北京索莱宝科技有限公司;双荧光素酶报告系统购自美国Promega公司;Total RNA提取试剂盒、Real-time PCR 试剂盒、反转录试剂盒和Lipofectamine 2000转染试剂盒购自宝生物工程(大连)有限公司;引物、miR-155-5p类似物、miR-155-5p抑制剂(anti-miR-155-5p)、SEP15干扰物(si-SEP15)、对照物(miR-NC、anti-miR-NC和si-NC)及pcDNA购自上海吉玛制药技术有限公司;抗SEP15、抗Bcl-2、抗Bax和抗Cleaved-caspase-3抗体购自英国Abcam公司;双染色流式法细胞凋亡检测试剂盒购自美国BD公司。流式细胞仪购自美国BD公司,发光仪、光学显微镜、全自动酶标仪及Real-time PCR仪购自美国Bio-Rad公司。
1.2 方法
1.2.1 细胞培养HLE-B3细胞培养于含有体积分数10%胎牛血清、100 U·mL-1青霉素和100 μg·mL-1链霉素的高糖DMEM培养基中,置于37 ℃含体积分数5% CO2恒温密闭培养箱中,饱和湿度。待细胞生长至对数生长期时,胰蛋白酶消化传代。
1.2.2 实验分组和细胞H2O2模型构建将细胞随机分为3组,对照组:以正常DMEM培养基培养;H2O2组:建立H2O2模型;H2O2+转染组:细胞转染48 h后建立H2O2模型。H2O2模型建立方法:将对数生长期的HLE-B3细胞稀释为1×106个·mL-1,接种于6孔板,加入100 μmol·L-1H2O2培养12 h。
1.2.3 细胞转染根据Lipofectamine 2000转染试剂盒说明书进行操作,转染后进一步分组为:H2O2+anti-miR-NC组、H2O2+anti-miR-155-5p组、H2O2+pcDNA组、H2O2+pcDNA-SEP15组、miR-NC组、miR-155-5p组、H2O2+anti-miR-155-5p+si-NC组、H2O2+anti-miR-155-5p+si-SEP15组,先用无血清OptiMEM培养液稀释Lipofectamine 2000和各组载体或片段,将等体积的脂质体和各组载体混合,室温孵育20 min,将混合液加入培养好的HLE-B3细胞中,混合均匀,培养6 h后换成DMEM完全培养液,48 h后收集细胞,鉴定无误后进行后续实验。
1.2.4 Real-time PCR检测RNA的表达收集对照组、H2O2组、H2O2+转染组的各组HLE-B3细胞,用Total RNA试剂盒提取细胞总RNA。然后按照反转录试剂盒合成cDNA,测定浓度和纯度,-80 ℃保存。以cDNA为模板按照Real-time PCR试剂盒的说明书进行反应,miR-155-5p引物为5’-TTAATGC TAATCGTGATAGGGGT-3’;SEP15 上 游 引 物 为5’-GGGGTACCATGGCGGCTGGGCGAGT-3’,下 游 引 物 为5’-GCTCTAGAATGATCCTTTTAAATGGACTTTTCTG-3’;反应程序为:95 ℃ 2 min;95 ℃ 45 s、58 ℃ 40 s、72 ℃ 30 s,40个循环;72 ℃ 10 min。用2-ΔΔCt进行数据分析。
1.2.5 流式细胞术检测细胞凋亡率将各组HLE-B3细胞接种于6孔板中(每孔100×103个细胞),培养24 h,离心收集细胞,洗涤2次,调整细胞浓度为1×106个·mL-1,根据凋亡检测试剂盒说明书进行操作,取100 μL标记缓冲液重悬细胞,然后加入 5 μL 膜联蛋白V-FITC和 10 μL碘化丙啶,室温避光20 min,流式细胞仪检测各组细胞凋亡率。
1.2.6 ELISA检测细胞中MDA、SOD和GSH-Px的含量收集各组HLE-B3细胞,PBS缓冲液洗涤2次,加入细胞裂解液裂解20 min,离心取上清,按照MDA、SOD和GSH-Px的ELISA试剂盒说明书操作,酶标仪检测细胞内MDA、SOD和GSH-Px的含量。
1.2.7 双荧光素酶检测实验根据双荧光素酶检测试剂盒说明书进行操作,收集转染后的HLE-B3细胞,消化稀释,以每孔20×103个细胞接种于24孔板中,培养至细胞融合为一层时,进行转染,将构建的含有miR-155-5p与SEP15预测结合位点的野生型(WT-SEP15)和突变型(MUT-SEP15)双荧光素酶报告载体,分别共转染miR-NC或miR-155-5p。转染48 h后收集细胞,加入细胞裂解液,室温裂解20 min,离心收集上清,加入荧光素酶底物,以海肾荧光素酶活性为内参照,测定相对萤火虫荧光素酶活性。
1.2.8 Western blot检测SEP15和凋亡相关蛋白表达收集各组HLE-B3细胞,加入裂解液孵育20 min,冰浴超声破碎细胞,收集蛋白,进行SDS-PAGE,PVDF转膜,50 g·L-1脱脂奶粉室温封闭2 h,加入一抗(抗SEP15抗体 11000,抗Bcl-2抗体 1400,抗Bax抗体 1800,抗Cleaved-caspase-3抗体1500)4 ℃孵育过夜,PBST洗膜2次,加入稀释的二抗室温孵育2 h,以GAPDH为内参照,分析蛋白水平。
1.3 统计学处理采用 SPSS 17.0软件行统计学分析,数据以均数±标准差表示,组间比较采用独立样本t检验和单因素方差分析。检验水准:α=0.05。
2 结果
2.1 miR-155-5p和SEP15在H2O2诱导的HLE-B3中的表达Western blot和Real-time PCR检测结果表明,与对照组相比,H2O2组HLE-B3中miR-155-5p表达量显著升高(P=0.000),SEP15的mRNA含量和蛋白表达量均显著降低(均为P=0.000)。见表1。
表1 miR-155-5p和SEP15在H2O2诱导的HLE-B3中的表达
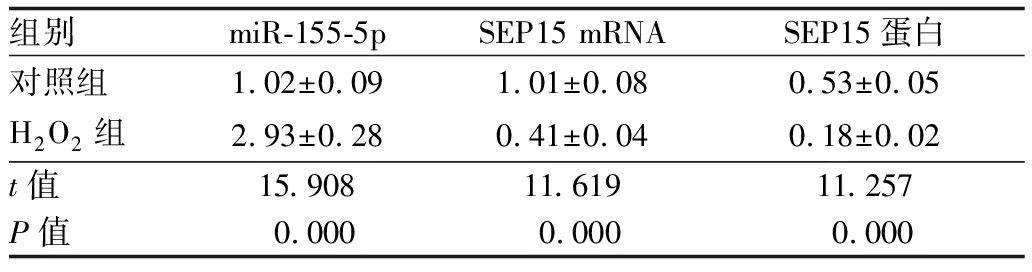
组别miR-155-5pSEP15 mRNA SEP15蛋白对照组1.02±0.091.01±0.080.53±0.05H2O2组2.93±0.280.41±0.040.18±0.02t值15.90811.61911.257P值0.0000.0000.000
2.2 抑制miR-155-5p表达对H2O2诱导的HLE-B3氧化损伤的影响Real-time PCR、ELISA检测结果显示,与对照组相比,H2O2组HLE-B3细胞中miR-155-5p表达量、MDA含量均显著升高(均为P<0.05),SOD活性和GSH-Px含量均显著降低(均为P<0.05);与H2O2+anti-miR-NC组相比,H2O2+anti-miR-155-5p组的miR-155-5p表达量、MDA含量均显著降低(均为P<0.05),SOD活性和GSH-Px含量均显著升高(均为P<0.05)。说明H2O2处理后,HLE-B3显著损伤;抑制miR-155-5p表达可减轻H2O2诱导的HLE-B3的损伤,提高细胞的抗氧化能力。见表2。
2.3 抑制miR-155-5p表达对H2O2诱导的HLE-B3凋亡的影响Western blot和流式细胞术结果显示,与对照组相比,H2O2组的抗凋亡蛋白Bcl-2表达量显著下降(P<0.05),凋亡蛋白Bax和Cleaved-caspase-3表达量及细胞凋亡率均显著升高(均为P<0.05);与H2O2+anti-miR-NC组相比,H2O2+anti-miR-155-5p组的抗凋亡蛋白Bcl-2表达量显著升高(P<0.05),凋亡蛋白Bax和Cleaved-caspase-3表达量及细胞凋亡率均显著下降(均为P<0.05)。说明H2O2可促进HLE-B3凋亡,抑制miR-155-5p可抑制HLE-B3的凋亡。见表3。
表2 抑制miR-155-5p表达对H2O2诱导的HLE-B3氧化损伤的影响

组别miR-155-5p相对表达量MDA/nmol·mL-1SOD/U·mL-1GSH-Px/U·mL-1对照组1.02±0.0945.21±4.2581.42±8.34169.37±8.67H2O2组2.93±0.28∗91.56±9.27∗39.68±3.57∗72.65±7.28∗H2O2+anti-miR-NC组2.91±0.2996.73±8.7736.92±3.6568.28±7.37H2O2+anti-miR-155-5p组1.68±0.17#59.64±5.36#68.84±6.37#143.69±8.72#F值53.861215.445169.091479.430P值0.0000.0000.0000.000
注:与对照组比较,*P<0.05;与H2O2+anti-miR-NC组比较,#P<0.05
表3 抑制miR-155-5p表达对H2O2诱导的HLE-B3凋亡的影响
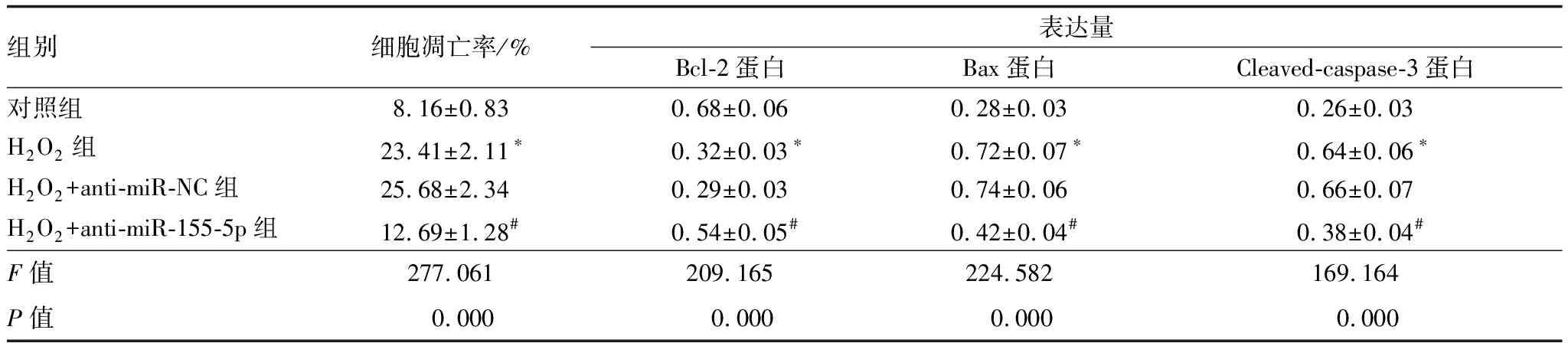
组别细胞凋亡率/%表达量Bcl-2蛋白Bax蛋白Cleaved-caspase-3蛋白对照组8.16±0.830.68±0.060.28±0.030.26±0.03H2O2组23.41±2.11∗0.32±0.03∗0.72±0.07∗0.64±0.06∗H2O2+anti-miR-NC组25.68±2.340.29±0.030.74±0.060.66±0.07H2O2+anti-miR-155-5p组12.69±1.28#0.54±0.05#0.42±0.04#0.38±0.04#F值277.061209.165224.582169.164P值0.0000.0000.0000.000
注:与对照组比较,*P<0.05;与H2O2+anti-miR-NC组比较,#P<0.05
2.4 SEP15过表达对H2O2诱导的HLE-B3损伤的影响与对照组相比,H2O2组的SEP15蛋白表达量、Bcl-2蛋白表达量均显著下降(均为P<0.05),Bax蛋白表达量和细胞凋亡率均显著升高(均为P<0.05),MDA含量显著升高(P<0.05),SOD活性和GSH-Px含量均显著降低(均为P<0.05);与H2O2+pcDNA组相比,H2O2+pcDNA-SEP15组的SEP15蛋白表达量、Bcl-2蛋白表达量均显著升高(均为P<0.05),Bax蛋白表达量和细胞凋亡率均显著下降(均为P<0.05),MDA含量显著降低(P<0.05),SOD活性和GSH-Px含量均显著升高(均为P<0.05)。见表4。
表4 SEP15过表达对H2O2诱导的HLE-B3损伤的影响

组别表达量SEP15蛋白Bcl-2蛋白Bax蛋白MDA/nmol·mL-1SOD/U·mL-1GSH-Px/U·mL-1细胞凋亡率/%对照组0.53±0.050.69±0.060.27±0.0342.65±4.1387.31±8.25174.65±9.347.65±0.74H2O2组0.18±0.02∗0.31±0.03∗0.71±0.07∗93.51±9.39∗34.69±3.43∗69.34±6.71∗21.49±2.07∗H2O2+pcDNA组0.19±0.030.29±0.030.73±0.0798.52±8.9331.37±3.5263.49±6.8723.65±2.17H2O2+pcDNA-SEP15组0.51±0.05#0.48±0.04#0.41±0.04#67.93±3.21#58.63±5.34#126.98±9.34#14.67±1.52#F值226.593215.494183.772163.100266.635496.554212.168P值0.0000.0000.0000.0000.0000.0000.000
注:与对照组比较,*P<0.05;与H2O2+pcDNA组比较,#P<0.05
2.5 miR-155-5p靶向调控SEP15的表达通过Targetscan预测发现,SEP15的3’UTR序列中含有与miR-155-5p互补的核苷酸序列。双荧光素酶检测结果显示,与miR-NC组野生型WT-SEP15的萤火虫荧光素酶相对活性1.02±0.09相比,miR-155-5p组野生型WT-SEP15的萤火虫荧光素酶相对活性显著下降,为0.39±0.03(P=0.000);而miR-155-5p组突变型MUT-SEP15的萤火虫荧光素酶相对活性为1.03±0.09,与miR-NC组的1.05±0.08相比,差异无统计学意义(P=0.407)。Western blot检测结果显示,与miR-NC组的SEP15蛋白相对表达量0.54±0.05相比,miR-155-5p组的SEP15蛋白相对表达量显著下降,为0.21±0.03(P<0.05);与anti-miR-NC组的SEP15蛋白相对表达量0.52±0.05相比,anti-miR-155-5p组的SEP15蛋白相对表达量显著上升,为 0.91±0.08(P<0.05)。说明miR-155-5p靶向负调控SEP15的表达。
2.6 抑制SEP15表达逆转了抑制miR-155-5p表达对H2O2诱导的HLE-B3损伤的影响与H2O2+anti-miR-NC组相比,H2O2+anti-miR-155-5p组的SEP15、Bcl-2蛋白表达量均显著升高(均为P<0.05),Bax蛋白表达量和细胞凋亡率均显著下降(均为P<0.05),细胞中MDA含量显著下降(P<0.05),SOD活性和GSH-Px含量均显著升高(均为P<0.05)。与H2O2+anti-miR-155-5p+si-NC组相比,H2O2+anti-miR-155-5p+si-SEP15组的SEP15、Bcl-2蛋白表达量均显著下降(均为P<0.05),Bax蛋白表达量和细胞凋亡率均显著上升(均为P<0.05),细胞中MDA含量显著升高(P<0.05),SOD活性和GSH-Px含量均显著降低(均为P<0.05)。说明抑制SEP15表达可逆转抑制miR-155-5p对H2O2诱导的HLE-B3的损伤作用。见表5。
表5 抑制SEP15表达逆转了抑制miR-155-5p表达对H2O2诱导的人晶状体上皮细胞损伤的影响

组别表达量SEP15蛋白Bcl-2蛋白Bax蛋白MDA/nmol·mL-1SOD/U·mL-1GSH-Px/U·mL-1细胞凋亡率/%H2O2+anti-miR-NC组0.19±0.020.25±0.030.73±0.0797.15±9.2434.39±3.5265.39±6.4224.37±2.32H2O2+anti-miR-155-5p组0.58±0.05∗0.59±0.06∗0.38±0.04∗55.34±5.41∗69.34±6.25∗151.65±9.47∗11.65±1.18∗H2O2+anti-miR-155-5p+si-NC组0.61±0.060.63±0.060.36±0.0352.67±5.3672.81±7.11159.37±10.2410.84±1.13H2O2+anti-miR-155-5p+si-SEP15组0.39±0.04#0.62±0.06#0.32±0.03#76.68±6.27#49.65±4.28#78.37±7.33#18.35±1.69#F值269.189156.206144.400113.517128.540392.866177.138P值0.0000.0000.0000.0000.0000.0000.000
注:与H2O2+anti-miR-NC组比较,*P<0.05;与H2O2+anti-miR-155-5p+si-NC组比较,#P<0.05
3 讨论
白内障是最常见的眼部疾病,老年性白内障大约占白内障的80%[9-10]。目前的研究结果表明,白内障的发病机制是氧化损伤、细胞凋亡和晶状体蛋白变性等[11],HLECs的氧化损伤和细胞凋亡机制是这一领域的研究热点,对预防和治疗白内障具有指导意义。有研究表明,miRNA,如miR-34a、miR-15a、miR-16-1-5p、miR-16-1-3p、miR-125b、Let-7等,通过调控HLECs凋亡和衰老参与白内障的发生和发展[12]。miR-155参与眼部组织的生长发育和功能调节等过程,与角膜病、干眼症、葡萄膜炎、视网膜疾病、甲状腺相关眼病及眼肿瘤等均有关[13]。Derrick等[14]发现,在滤泡沙眼中miR-155表达上调,与沙眼炎症严重程度相关。Wolf 等[15]发现,FGF2诱导的大鼠LECs分化过程晚期,高表达的miR-155靶向下调分化因子c-Maf的表达,在晶状体纤维细胞终末分化后期发挥作用。以上结果均表明,miR-155在眼病中具有重要作用,但miR-155-5p在H2O2诱导的HLECs损伤中的表达情况及作用尚不清楚。本研究通过H2O2诱导HLECs细胞系HLE-B3的结果表明,miR-155-5p在H2O2诱导后的HLE-B3细胞中表达显著升高,与Derrick 等[14]研究结果一致,抑制miR-155-5p表达可降低MDA含量,升高SOD活性和GSH-Px含量,减轻H2O2诱导的HLE-B3细胞损伤,抑制细胞凋亡,说明miR-155-5p在HLECs氧化损伤中发挥重要作用。
本研究通过Targetscan预测发现,SEP15的3’UTR 中含有与miR-155-5p互补的核苷酸序列,提示miR-155-5p与SEP15可能存在结合位点或调控关系。SEP15是一种含硒半胱氨酸氧化还原酶,存在于内质网中,与糖基化蛋白糖苷转移酶形成11复合物,参与糖基化蛋白的氧化折叠和结构成熟[16]。Yin等[17]研究发现,在鼠白内障模型中,SEP15通过抑制氧化应激反应,抑制衣霉素诱导的HLECs细胞凋亡。Dai等[18]研究表明,SEP15在半乳糖诱导的白内障大鼠晶状体中表达显著降低,补充亚硒酸盐和依布硒啉(消炎镇痛药)30 d后SEP15表达上调,晶状体氧化损伤减轻。说明SEP15在眼病中也发挥保护作用。本研究发现,SEP15在H2O2诱导后的HLE-B3细胞中表达显著下调,与Dai等[18]研究结果一致;过表达SEP15可降低MDA含量,升高SOD活性和GSH-Px含量,降低细胞凋亡率,减轻H2O2对HLE-B3细胞的损伤,抑制细胞凋亡,验证了SEP15在白内障的发展中具有重要作用。双荧光素酶检测结果也显示,miR-155-5p靶向负调控SEP15的表达。进一步研究发现,抑制SEP15表达可逆转抑制miR-155-5p对H2O2诱导的HLE-B3细胞损伤的影响,验证了两者在HLECs中存在调控关系。
综上,本研究发现,在H2O2诱导的HLECs细胞系HLE-B3中,miR-155-5p可通过靶向抑制SEP15表达进而减轻HLE-B3细胞氧化损伤,抑制细胞凋亡。本研究结果也间接表明,miR-155-5p和SEP15有望成为HLECs氧化损伤的分子靶点,对预防和治疗白内障提供了新的思路。

