不同OCT分型的糖尿病性黄斑水肿与血小板参数的关系
赵子君 梁丽芳 曾丽娜 柯晓云
当前,糖尿病性黄斑水肿(diabetic macular edema,DME)已成为糖尿病患者视力损失的主要原因[1],DME的病因主要为多因素导致的血-视网膜屏障的破坏,使视网膜内及视网膜下的液体积聚,但详细的发病过程及病理机制仍处于研究中。

1 资料与方法
1.1 一般资料回顾性研究。将2014年9月至2018年9月于南方医科大学珠江医院眼科住院就诊的DR患者118例118眼纳入研究。其中,男65例65眼、女53例53眼,年龄38~80(57.0±8.9)岁。纳入标准:诊断为2型糖尿病且行FFA及OCT检查明确为DR的患者。排除标准:(1)双眼任一眼屈光间质混浊不能清晰观察眼底者;(2)伴有黄斑变性、黄斑前膜、玻璃体黄斑牵拉综合征等眼底疾病者;(3)既往曾行视网膜激光光凝术、玻璃体内注药等治疗及行玻璃体切割等眼内手术者;(4)近期服用波立维、阿司匹林等抗凝、抗血小板药物者;(5)伴有心功能或肾功能不全、脑血管异常、肝功能异常、自身免疫性疾病、感染性疾病、肿瘤等全身情况异常者;(6)孕产妇及患有神经精神疾病不能配合检查者。本研究通过本院伦理委员会批准。
1.2 方法采集患者的性别、年龄、外周血的血小板参数[包括血小板计数(platelet count,PLT)、MPV、PDW及PCT]。所有患者充分散瞳后行眼底FFA及OCT检查。其中OCT检查使用德国海德堡OCT仪器进行,采用快速扫描,31条水平线对患者双眼进行扫描,叠加成像检查由两位经验丰富的眼科医师独立进行并判断DME分型,排除二者诊断不一致者。根据诊疗指南标准将DR分为轻度非增生型DR(non-proliferative diabetic retinopathy,NPDR)、中度NPDR、重度NPDR、增生型DR(proliferative diabetic retinopathy,PDR)[10]。结合OCT检查并参照文献[9,11-14],对DME的不同OCT形态进行分型:弥漫性视网膜增厚型(diffuse retinal thickening,DRT)、黄斑囊样水肿(cystoid macular edema,CME)、神经上皮层脱离型(neurosensory retinal detachment,NSD)(图1)。3种类型的眼底表现逐渐显著,其中DRT型表现为黄斑区视网膜海绵样肿胀,视网膜内的反射均匀降低;CME表现为黄斑区视网膜可见低反射囊腔,各囊腔间由高反射隔膜分隔;NSD表现为黄斑区视网膜隆起,伴随视网膜色素上皮层的分离,二者间为透明低反射暗腔。若患者双眼DME分型不一致,则选取形态较为显著的一眼纳入研究。若患眼眼底形态存在两种或两种以上类型,则归入表现较为显著的类型,即DRT组:仅DRT;CME组:DRT+CME或仅CME;NSD组为:DRT+CME+NSD或NSD+DRT或DME+NSD或仅NSD。

图1 不同分型DME的形态特征 A:DRT;B:CME;C:NSD
1.3 统计学处理应用SPSS 20.0统计学软件进行数据分析,DME各型的比例与DR分期的关系采用卡方检验及Fisher精确概率检验,对DME与未合并DME(Non-DME)间血小板各参数的比较使用独立样本t检验。DME各分型间的血小板参数比较中,计数资料使用卡方检验,计量资料采用单因素方差分析(one-way ANOVA),两者间的比较采用LSD-t检验。检验水准:α=0.05。
2 结果
2.1 DME与性别的关系118例患者中,DME组88例,男46例,女42例;Non-DME组30例,男19例,女11例,DME组与Non-DME组之间性别的差异无统计学意义(χ2=1.106,P=0.201)。
2.2 DR分期与DME的关系118例118眼中,轻度NPDR、中度NPDR、重度NPDR及PDR分别为15眼、19眼、40眼、44眼。其中,在轻度和中度NPDR患者中,DME患者17眼,占50.0%;在重度NPDR及PDR患者中,DME患者71眼,占84.5%。不同DR分期均有DME发生,且随着DR分期的加重,DME的占比增加(χ2=15.215,P<0.001)。
在DME患眼中,DRT、CME、NSD分别为27眼、29眼、32眼。其中,轻度和中度NPDR 17眼DME中,DRT、CME、NSD分别为9眼、6眼、2眼,分别占52.9%、35.3%、11.8%;重度NPDR及PDR 71眼DME中,DRT、CME、NSD分别为18眼、23眼、30眼,分别占25.4%、32.4%、42.3%。在DR不同分期中,各DME分型的占比不同(χ2=6.944,P<0.05),在轻度和中度NPDR患眼中,DRT、CME、NSD的占比逐渐降低;在重度NPDR及PDR患眼中,DRT、CME、NSD的占比逐渐增高。
2.3 DME组与Non-DME组间血小板参数比较DME组患者的MPV、PDW均显著高于Non-DME组,差异均有统计学意义(均为P=0.000),两组间PLT与PCT相比差异均无统计学意义(均为P>0.05)。见表1。
表1 Non-DME组与DME组的血小板参数

组别PLT/×109个·L-1MPV/fLPCTPDW/fLNon-DME组 256.13±78.019.78±0.460.25±0.0711.13±0.91DME组 236.47±64.1110.24±0.800.24±0.0612.06±1.66t值-1.3663.885-0.6383.838P值0.1750.0000.5250.000
2.4 不同分型的DME与血小板参数的关系分析不同DME分型患者间的血小板参数,结果显示,DRT组、CME组、NSD组三组间患者的MPV、PDW差异均有统计学意义(均为P<0.05),两两比较结果显示,NSD组患者的MPV、PDW均高于DRT组和CME组(MPV:P=0.029、0.013;PDW:P=0.008、0.023),DRT组与CME组间MPV、PDW相比差异均无统计学意义(P=0.772、0.667)。DRT组、CME组、NSD组间患者的PLT、PCT差异均无统计学意义(均为P>0.05)。见表2。
表2 不同DME分型患者的血小板参数
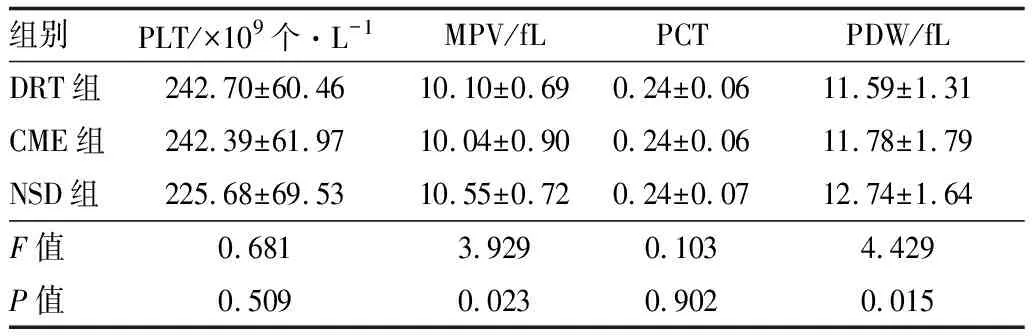
组别PLT/×109个·L-1MPV/fLPCTPDW/fLDRT组 242.70±60.4610.10±0.690.24±0.06 11.59±1.31CME组242.39±61.9710.04±0.900.24±0.06 11.78±1.79NSD组225.68±69.5310.55±0.720.24±0.07 12.74±1.64F值0.6813.9290.1034.429P值0.5090.0230.9020.015
3 讨论
本研究根据不同的OCT形态特征将DME患眼分为DRT、CME、NSD,结果发现,在不同DR的分期中均有可能出现DME。DME虽然可以发生于DR的任一阶段,但DME在DR不同分期中的占比不同,即DME在重度NPDR及PDR中的占比明显高于轻度和中度NPDR组。在轻度和中度NPDR中,DRT占比最高,重度NPDR及PDR中,NSD占比最高,与Ghosh等[14]、Alkuraya等[15]的研究结果一致,提示DR的分期与DME及DME的不同OCT分型相关。

本研究根据OCT的形态特征将DME患眼分为DRT、CME、NSD 3种类型,是由于大量研究表明不同OCT形态下的DME发病机制、治疗方案、治疗效果和预后均存在差异[22-24]。因此,本研究通过验证血小板与DME可能有关,从而进一步研究不同OCT分型的DME与血小板相关参数的关系。其中DRT为缺血导致细胞毒性水肿,出现Müller细胞质肿胀,从而表现为视网膜弥漫的增厚,而且黄斑部海绵样视网膜肿胀主要位于外丛状层。随着前列腺素、VEGF等增加渗透性物质的释放进展为血管源性水肿,持续的水肿或局部缺血使Müller细胞和邻近的神经细胞液化坏死导致囊腔出现,即为CME,囊腔主要出现于内核层及外丛状层。在NSD中,炎症及局部组织缺血使视网膜色素上皮细胞的功能损坏,从脉络膜血管层进入视网膜的液体增加,导致视网膜下液体积聚[9,22]。本研究发现,DRT发生于所有DME患眼中,NSD组患者的MPV及PDW均显著高于DRT组及CME组,CME组与DRT组MPV、PDW差异均无统计学意义。Shimura等[25]研究发现,贝伐单抗在DRT及CME患眼中的疗效较NSD患眼更佳,预后也存在一定差异。结合本研究结果及相关研究我们推测,由于MPV及PDW可反映血小板活化增强,在不同OCT分型的DME患眼中,血小板的活化可能与NSD的发生及发展相关。
本研究为单中心研究,样本量有限,就诊患者有一定区域性且病情多较为严重,因此不能完全代表所有人群的情况;患者的血小板参数可能与全身其他因素相关,例如吸烟等,因此本研究结果可能存在部分偏差;本研究未将男性及女性分开进行分析,不同性别间存在激素等的差异,对结果可能有一定影响;本研究属于横断面研究,不能完全确定其因果关系。综上,仍需要进一步的研究,以更加明确血小板对DME产生的影响,从而为DME的发病机制及治疗的研究提供新的思路。

