粗毛纤孔菌总三萜的纯化及对胆酸盐结合能力分析
刘爽爽 刘东超 孙凡越 李德海* 王占斌
(1.东北林业大学 林学院,哈尔滨 150040; 2.黑龙江省森林食品资源利用重点实验室,哈尔滨 150040)
胆酸盐是胆汁中由胆固醇衍生而来的具有甾核结构的大分子,对胆固醇和脂肪的消化吸收起重要作用。因此将胆酸盐排出体外可降低胆酸盐在肝肠循环过程中的积累,促进胆固醇的代谢,达到降血脂的目的[1]。辛伐他汀可以通过吸收胆酸盐来降低高血脂症,但长时间服用会有损害肝肾、血糖升高等副作用[2]。因此,开发有效降低血脂的天然功能性成分药物成为热点。已有研究表明三萜类化合物是一类有较好降血脂作用的天然产物,具有开发和应用前景[3]。
粗毛纤孔菌(Inonotushispidus)属于担子菌亚门,主要分布在东北和新疆地区,是一种具有降血脂、抗氧化等生物活性的药用真菌[4],常被用于降三高以及治疗消化不良、癌症等疾病[5]。三萜类化合物是粗毛纤孔菌产生的主要生物活性成分之一,药理试验证明,其具有抗癌、抗病毒、降血脂等多种功能[6]。三萜类化合物提取过程中含有糖,脂类等杂质,影响了其纯度和生物活性[7]。为了提高三萜类化合物的纯度,不少学者致力于三萜类化合物的纯化。王亚红等[8]采用大孔树脂来提高瓦松总三萜的纯度,总三萜含量可以达到40.56%。苏永昌等[9]采用分段沉淀法来提高海参三萜皂苷的纯度。大孔树脂虽然具有吸附性强,解吸条件温和等优点,但其分离纯度差,不利于总三萜纯度的提高[10]。分段沉淀法虽然操作简便,但难将皂苷分离完全[11]。萃取可以利用有机溶剂与三萜的相似相溶原理,将极性相似的总三萜溶解在有机溶剂中,从而提高总三萜的纯度。硅胶可以利用其表面硅醇基较强的吸附作用来提高总三萜的纯度[12]。为了获得高纯度的粗毛纤孔菌总三萜,本试验拟以粗毛纤孔菌子实体及菌丝体为原材料,采用有机溶剂萃取与硅胶纯化联用的方法,分析有机溶剂种类、高径比(硅胶高∶硅胶柱直径)、上样量和硅胶量质量比、洗脱体系、洗脱剂比例对粗毛纤孔菌总三萜纯度的影响。同时利用红外光谱分析经萃取和硅胶纯化后的粗毛纤孔菌菌丝体和子实体总三萜结构,进一步通过体外模拟体内环境试验研究了粗提物和纯化物总三萜的体外胆酸盐结合能力,为选择粗毛纤孔菌三萜类化合物高效纯化方法和降血脂药物研发提供试验基础。
1 材料与方法
1.1 材料
2018年9月在东北林业大学林场的水曲柳上采集粗毛纤孔菌子实体,将其置于42 ℃烘箱中烘干,用小型粉碎机粉碎,过60目筛,收集筛下物,备用。
粗毛纤孔菌东北林业大学森林保护实验室培养,获得菌丝体,将其置于42 ℃烘箱中烘干,用小型粉碎机粉碎,过60目筛,收集筛下物,备用。
1.2 试剂及设备
氯仿、甲醇、石油醚、丙酮、乙酸乙酯、正丁醇(天津市富宇精细化工有限公司);香草醛(Sigma 公司);柱层析硅胶(精制型)200~300 目(青岛海洋化工);大孔树脂D101(东鸿化工有限公司);胆酸钠(北京市海淀区微生物培养基制品厂);牛磺胆酸钠、甘氨胆酸钠(上海源叶生物技术有限公司)。
722 紫外分光光度计(上海第三分析仪器厂);RE-52 旋转蒸发器(上海亚荣生化仪器公司);KQ-500DE 数控超声波清洗器(昆山市超声仪器有限公司);硅胶层析柱50×Φ2.2 cm(上海精科实业有限公司);IS10 傅立叶变换型红外光谱仪(Thermo Fisher)。
1.3 方法
1.3.1粗毛纤孔菌总三萜的萃取
称取600 g粗毛纤孔菌子实体和200 g菌丝体粉末,加入72%的乙醇,在超声功率210 W辅助下萃取31 min后室温浸提24 h,反复萃取5 次。合并5 次萃取液在45 ℃下旋蒸,然后在42 ℃烘箱中烘干备用。将样品烘干后悬浮在H2O中,然后分别用相同体积的乙酸乙酯和正丁醇在室温下萃取24 h。反复2 次,合并2 次萃取物,旋蒸后烘干,得到乙酸乙酯萃取物和正丁醇萃取物,备用。
1.3.2粗毛纤孔菌总三萜硅胶纯化工艺比较
1)高径比(硅胶高∶硅胶柱直径)、上样量和硅胶量质量比的筛选:准确取4 mL子实体粗提物,按一定高径比(25∶22、40∶22、55∶22、70∶22、85∶22)、上样量和硅胶量质量比(1∶80、2∶80、3∶80、4∶80、5∶80)条件下,以V氯仿∶V甲醇=1∶1为洗脱剂,在流速1 mL/min下进行洗脱。每10 mL一管收集样品,每管样品中总三萜含量的计算公式为:
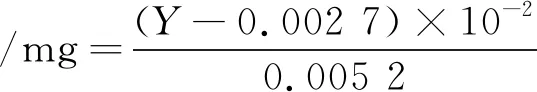
(1)
式中:Y为OD值。
2)洗脱体系和洗脱剂体积比的筛选:准确取 4 mL 菌丝体和子实体乙酸乙酯萃取物,在筛选得到的最佳高径比(硅胶高∶硅胶柱直径)、上样量和硅胶量质量比前提下按一定的洗脱体系(氯仿∶甲醇、丙酮∶石油醚、乙酸乙酯∶丙酮)和洗脱剂体积比(1∶1、2∶1、3∶1、5∶1、1∶2)在流速为 1 mL/min 的条件下进行洗脱。根据上述方法进行样品的收集,通过数据分析筛选出最佳的洗脱体系和洗脱剂比例。
3)洗脱样品的处理和测定:参照文献[13]利用香草醛-冰乙酸-高氯酸分光光度比色法测定总三萜的方法并稍作修改,具体方法如下:每管样品吸取0.05 mL分别置于5 mL 容量瓶中,在100 ℃水浴蒸干后加入0.20 mL新制的5%香草醛-冰乙酸溶液和0.80 mL高氯酸,摇匀后放入温度为70 ℃的水浴锅中反应15 min后,常温下放置3~5 min,再加入乙酸乙酯定量到5 mL摇匀,用不加样品的溶液做空白对照,采用分光光度计测定样品在551 nm处测定吸光度(OD值)。根据公式(1)计算各管中样品的总三萜含量,绘制洗脱曲线。
将所有收集的样品混合旋蒸后于42 ℃烘箱中烘干,然后称取0.03 g溶解于10 mL无水乙醇中,从中吸取0.05 mL置于5 mL 容量瓶中,根据上述方法测定三萜含量。总三萜得率和纯度的计算公式为:
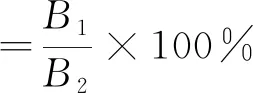
(2)
式中:B1为柱层析后总三萜含量,mg;B2总三萜含量,mg。
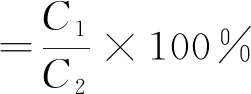
(3)
式中:C1为柱层析后总三萜质量,mg;C2为柱层析后总样品质量,mg。
4)不同纯化方法的比较:分别用的硅胶纯化法[14]和大孔树脂吸附法[15]对粗毛纤孔菌菌丝体和子实体原料进行纯化,将纯化得到的样品按照上述方法进行总三萜纯度的测定。
1.3.3粗毛纤孔菌总三萜的红外光谱分析
参照参考文献[16]的方法,利用傅立叶变换型红外光谱仪,以溴化钾为背景,采用溴化钾压片法在500~4 000/cm-1扫描经乙酸乙酯萃取和硅胶纯化后的菌丝体和子实体总三萜成分。通过数据分析粗毛纤孔菌菌丝体和子实体的官能团结构。
1.3.4粗毛纤孔菌总三萜体外胆酸盐结合能力检测
参照文献刘荣等[17]利用分光光度计绘制标准曲线的方法并稍作修改, 具体方法如下:分别取2 mL不同浓度的标准溶液(甘氨胆酸钠0.03、0.06、0.12、0.18、0.24、0.30 mmol/L,牛磺胆酸钠0.10、0.20、0.30、0.40、0.50 mmol/L,胆酸钠0.10、0.20、0.30、0.40、0.50 mmol/L)于具塞试管中,加入6 mL 60%的H2SO4于70 ℃水浴20 min,取出冰浴5 min,采用分光光度计测定样品在387 nm处测定吸光度,最后,以胆酸盐浓度为横坐标,吸光度为纵坐标,绘制胆酸盐的标准曲线。
参照参考文献[17]体外模拟体内环境测定胆酸盐结合能力的方法并稍作修改,具体方法如下:分别移取1 mL样品(菌丝体粗提总三萜、子实体粗提总三萜、菌丝体纯化后总三萜、子实体纯化后总三萜),加入1 mL(10 mg/mL)胃蛋白酶,3 mL 0.01 mol/L的HCl溶液,在37 ℃恒温振荡消化1 h,以 0.10 mol/L 的NaOH溶液调节pH至6.30,随后加入4 mL(10 mg/mL)胰蛋白酶,在37 ℃恒温振荡消化1 h,最后加入4 mL(1 mmol/L)胆酸盐消化1 h,400 0 r/min离心20 min,对上清液中的胆酸盐进行分析。
1.4 统计学分析
试验中的测试均平行检测3次。基础数据统计采用Excel 软件,图表均采用Origin 9.0处理完成,显著性分析采用SPSS 21.0 软件。
2 结果与分析
2.1 粗毛纤孔菌总三萜的萃取
比较不同萃取剂对总三萜含量的影响,结果发现乙酸乙酯和正丁醇萃取后菌丝体和子实体粗提总三萜的纯度得到明显提高(表1):600 g粗毛纤孔菌子实体在72%乙醇提取下可得到总三萜纯度为9.20%的粗提物86.19 g(留4 g备用)。乙酸乙酯和正丁醇萃取后总三萜纯度得到显著提高,其中乙酸乙酯萃取后纯度可以达到32.70%,是子实体粗提物的3.55 倍,正丁醇萃取后纯度达到了13.07%,是子实体粗提物的1.42 倍。200 g粗毛纤孔菌菌丝体在72%乙醇提取下可得到纯度为15.33%的粗提物35 g(留1 g备用)。乙酸乙酯萃取后纯度可达到46.70%,是菌丝体粗提物的3.04 倍,正丁醇萃取后纯度可达到18.16%,是菌丝体粗提物的1.18倍。

表1 不同萃取剂对粗毛纤孔菌总三萜含量的影响Table 1 Effect of different solvents on the content of total triterpenoids from Inonotus hispidus
注:同行不同小写字母表示存在显著性差异(P<0.05)。不同萃取剂萃取纯度之间的差异用a、b表示。同列不同大写字母表示存在显著性差异(P<0.05)。菌丝体和子实体纯度之间的差异用C、D表示。
Note: Different small letters within same raw indicate significant differences (P<0.05). Purity differences among different solvents are represented by a and b. Different capital letters within same column indicate significant differences (P<0.05). Purity differences between fruiting body and mycelium are represented by C and D.
2.2 硅胶柱层析分离条件对粗毛纤孔菌总三萜纯度的影响
2.2.1不同高径比(硅胶高∶硅胶柱直径)对总三萜纯度的影响
采用不同的硅胶高度对样品进行洗脱,通过对收集样品总三萜纯度、得率和洗脱效果的分析,筛选出最佳的高径比(硅胶高∶硅胶柱直径),结果见图1(a)和(b)。当高径比<55∶22时,总三萜的纯度、得率和洗脱效果随着高径比的增加而提高。当高径比55∶22时,三萜类化合物的洗脱效果最好,总三萜纯度和得率的最大值分别为28.18%、95.16%。当高径比>55∶22时,总三萜的纯度、得率和洗脱效果随着高径比的增加而降低。故高径比(硅胶高∶硅胶柱直径)选择55∶22。
2.2.2不同上样量和硅胶量质量比对总三萜纯度的影响
在不同的上样量情况下对样品进行洗脱,通过收集样品进行总三萜纯度、得率和洗脱效果的分析,筛选出最佳的上样量和硅胶量质量比,具体结果见图2(a)和(b)。在上样量和硅胶量质量比为 4∶80 时,总三萜的洗脱效果最好,纯度和得率最大,分别为28.18%、95.16%;当上样量和硅胶量质量比< 4∶80时,总三萜的纯度、得率和洗脱效果随着上样量和硅胶量质量比的增加而提高;当上样量和硅胶量质量比>4∶80时,随着比例的增大,总三萜的纯度、得率和洗脱效果不仅降低,且在洗脱过程中产生了严重的拖尾现象。故上样量和硅胶量质量比选择4∶80。
2.2.3不同洗脱体系对乙酸乙酯萃取物总三萜纯度的影响
采用不同的洗脱体系对粗毛纤孔菌菌丝体和子实体进行洗脱,通过对收集样品总三萜纯度、得率和洗脱效果的分析,筛选出最佳的洗脱体系,结果见图3(a)、(b)和(c)。分析结果发现:丙酮∶石油醚体系对乙酸乙酯萃取后总三萜的洗脱效果最好,子实体和菌丝体总三萜纯度最大,分别为36.01%、54.00%。由图3(a)、3(b)可知,在洗脱体系为氯仿∶甲醇时,总三萜还没来得及分离就已被完全洗脱;乙酸乙酯∶丙酮体系总三萜洗脱效果较差,产生拖尾。故洗脱体系选择丙酮∶石油醚。
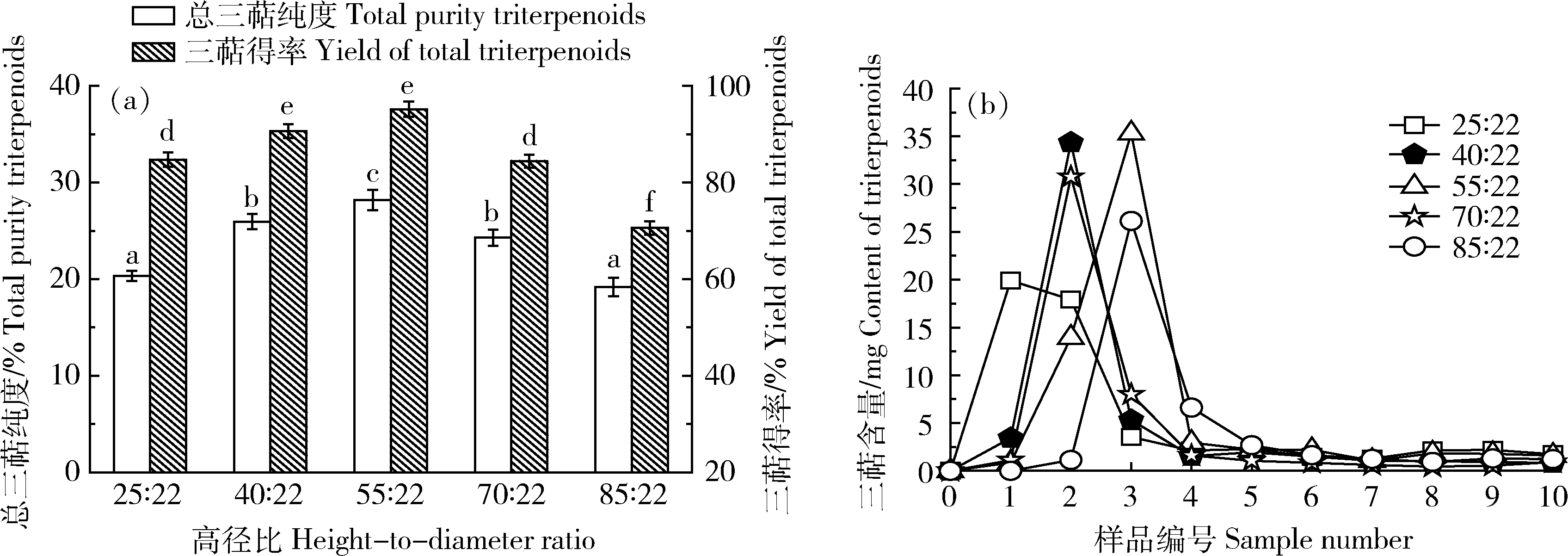
(a)高径比(硅胶高∶硅胶柱直径)三萜纯度和得率图;(b)洗脱曲线(收集样品30 管,后20 管的三萜含量趋近于0,故图显示10 管样品) 不同小写字母表示存在显著性差异(P<0.05)。纯度之间的差异用a、b、c表示。得率之间的差异用d、e、f表示。图2同。
(a)The purity and yield of total triterpenoids under different height-to-diameter ratios (height of silica gel∶diameter of silica gel); (b) The elution curve (A total of 30 tubes of samples are collected. The content of total triterpenoids of the last 20 tubes tended to be zero. Therefore only first 10 tubes are shown in the figure) Different small letters indicate significant differences (P<0.05). Differences among purity are represented by a, b and c. Differences among yield are represented by d, e and f. The same in
Fig.2.
图1 不同高径比对总三萜纯度的影响
Fig.1 Effect of different height-to-diameter ratios on purity of total triterpenoids
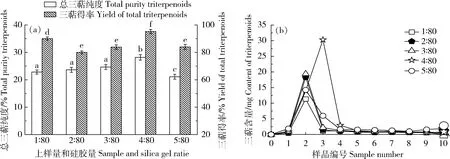
(a)上样量和硅胶量质量比三萜纯度和得率图;(b)洗脱曲线
(a) The purity and yield of total triterpenoids with different sample mass-to-silica gel mass. (b) The elution curve
图2 不同上样量和硅胶量质量比对总三萜纯度的影响
Fig.2 Effect of different sample and silica gel ratios on the purity of total triterpenoids
2.2.4不同洗脱剂比例对乙酸乙酯萃取总三萜纯度的影响
采用不同的洗脱剂比例对粗毛纤孔菌菌丝体和子实体进行洗脱,通过对收集样品的总三萜纯度、得率和洗脱效果分析,筛选出最佳的洗脱剂比例,具体结果见图4(a)、(b)和(c)。当V丙酮∶V石油醚=3∶1 时,乙酸乙酯萃取总三萜的洗脱效果最好,子实体和菌丝体总三萜纯度最大,分别为42.32%、65.35%。由图4(a)和(b)洗脱曲线可知,随着丙酮比例的增加,各管中总三萜的含量明显的增加。当V丙酮∶V石油醚>3∶1时,各管中总三萜的含量明显的减少。故V丙酮∶V石油醚选择3∶1。

(a)子实体洗脱曲线;(b)菌丝体洗脱曲线;(c)洗脱体系对总三萜纯度影响图 不同小写字母表示存在显著性差异(P<0.05)。子实体总三萜纯度之间的差异用a、b表示。菌丝体总三萜纯度之间的差异用c、d表示。图4同。
(a) The elution curve of fruiting body; (b) The elution curve of mycelium; (c) The effect of elution system on purity of total triterpenoids Different small letters indicate significant differences (P<0.05). Differences of among total triterpenoids purity of fruiting body are represented by a and b. Differences among total triterpenoids purity of mycelium are represented by c and d. The same in
Fig.4.
图3 不同洗脱体系对乙酸乙酯萃取物总三萜纯度的影响
Fig.3 Effect of different elution systems on purity of total triterpenoids extracted by ethyl acetate
2.3 不同分离纯化方法对总三萜纯化效果的影响
比较不同纯化方法对粗毛纤孔菌总三萜纯度的影响,结果见表2。子实体经萃取和硅胶纯化后的总三萜纯度为42.32%,是大孔树脂纯化和单纯硅胶纯化所得总三萜纯度的2.02、1.56 倍。菌丝体经萃取和硅胶纯化后的总三萜纯度为65.35%,是大孔树脂纯化和单纯硅胶纯化所得总三萜纯度的2.12和1.39倍。
2.4 粗毛纤孔菌纯化物总三萜红外光谱分析
通过红外光谱对粗毛纤孔菌子实体和菌丝体纯化后的总三萜进行结构分析发现,菌丝体和子实体可能因培养环境的不同造成结构之间的差异。总三萜在3 551/cm-1和3 415/cm-1处存在O-H键伸缩振动峰。菌丝体纯化后,总三萜在 2 926/cm-1处存在较强的吸收峰,其可归因于对称或者非对称的—CH2、—CH3的伸缩振动;子实体纯化后,总三萜在此处的振动峰减弱。菌丝体纯化后总三萜在 1 613/cm-1处存在较强 C=C 伸缩振动峰,子实体纯化后总三萜的C=C缩振动峰减弱。子实体纯化后总三萜在1 548/cm-1存在较强的非对称变型的—CH3伸缩振动峰;菌丝体纯化物总三萜的非对称变型的—CH3伸缩振动峰减弱。菌丝体纯化后总三萜在1 372/cm-1处存在弱的吸收峰,归因于对称变形的—CH3存在;子实体纯化后总三萜在此处不存在对称变形的—CH3。
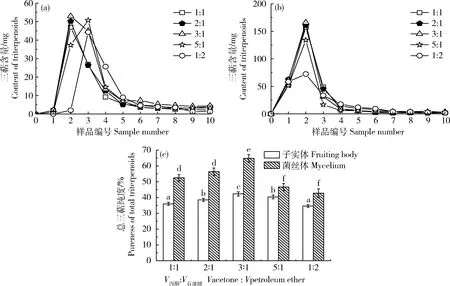
(a)子实体洗脱曲线;(b)菌丝体洗脱曲线;(c)洗脱比例对纯度影响图
(a) The elution curve of fruiting body; (b) The elution curve of mycelium; (c) The effect of eluent ratio on purity of total triterpenoids
图4 不同洗脱剂比例对乙酸乙酯萃取总三萜纯度的影响
Fig.4 Effect of different eluent ratios on purity of total triterpenoids extracted by ethyl acetate
表2 不同纯化方法对总三萜纯度的影响
Table 2 Effects of different purification methods on the purification of total triterpenoids %

粗毛纤孔菌Inonotus hispidus萃取后硅胶纯化Purified with silicagel after extraction硅胶纯化Purified withsilica gel大孔树脂纯化Purified withmacroporous resin子实体总三萜纯度Purity of total triterpenoids in fruiting body42.32±1.54 aC27.06±1.63 bC20.94±1.63 bC菌丝体总三萜纯度Purity of total triterpenoids in mycelium65.35±1.67 aD46.92±1.21 bD30.80±1.21 cD
注:同行不同小写字母表示存在显著性差异(P<0.05)。不同纯化方法纯度之间的差异用a、b、c表示。同列不同大写字母表示存在显著性差异(P<0.05)。菌丝体和子实体纯度之间的差异用C、D表示。
Note: Different small letters within same raw indicate significant differences (P<0.05). Purity differences among different purification methods are represented by a, b and c. Different capital letters within same column indicate significant differences (P<0.05). Purity differences between fruiting body and mycelium are represented by C and D.
子实体纯化后总三萜在1 294/cm-1处存在—S-O反对称伸缩振动峰;菌丝体纯化后总三萜在此处不存在—S-O反对称伸缩振动峰。子实体纯化后总三萜在812/cm-1处存在=C-H振动峰;菌丝体纯化后总三萜在此处不存在=C-H振动峰。子实体纯化后总三萜在962/cm-1处存在C-O和C-C振动峰;菌丝体纯化后总三萜在此处不存在 C-O和C-C振动峰。说明菌丝体和子实体总三萜官能团存在差异,但都符合三萜类物质的特征结构。
2.5 粗毛纤孔菌总三萜对体外胆酸盐结合能力的影响
比较粗提和纯化后粗毛纤孔菌总三萜对体外胆酸盐结合能力的影响,结果见图5。粗毛纤孔菌菌丝体和子实体粗提物的总三萜经纯化后,胆酸钠、甘氨胆酸钠和牛磺胆酸钠的结合能力增强。其中菌丝体总三萜经纯化后,对三种胆酸盐的结合能力最强分别为1.14、1.78和2.06 μmol/100 mg,是菌丝体粗提物总三萜胆酸盐结合能力的1.56、1.73和1.72 倍。

不同小写字母表示存在显著性差异(P<0.05)。胆酸钠之间的差异用a、b、c表示。甘氨胆酸钠之间的差异用d、e、f 表示。牛磺胆酸钠之间的差异用j、h、k表示。 Different small letters indicate significant differences (P<0.05). Differences among sodium cholate treatments are represented by a, b and c. Differences among sodium glycocholate treatments are represented by d, e and f. Differences among sodium taurocholate treatments are represented by j, h and k.
图5 总三萜体外胆酸盐结合量
Fig.5Invitrobile salt binding amount of total triterpenoids
3 讨论与结论
三萜类化合物具有抗癌、抗病毒、降血脂等多种功能[6]。为了提高三萜类化合物的纯度和生物活性,已有研究采用成本低廉的大孔树脂用于三萜类化合物纯化,例如:徐红云[18]采用大孔树脂纯化粗毛纤孔菌三萜,纯度可以达到27.82%;金文芳等[15]纯化马兰总三萜,纯度可以达到17.81%。大孔树脂虽然具有吸附性强、解吸条件温和等优点,但其分离纯度差,不利于总三萜纯度的提高[10]。本试验基于有机溶剂萃取法,具有操作简便、可以避免活性成分损失的优点,而且硅胶干扰因素少、选择性高、可循环利用和表面硅醇基较强吸附作用[12,19-20]。研究了有机溶剂萃取与硅胶联用对粗毛纤孔菌总三萜纯度的影响。本研究发现高径比(硅胶高∶硅胶柱直径)55∶22、上样量和硅胶量质量比4∶80、洗脱体系为丙酮∶石油醚、洗脱剂体积比为3∶1时,菌丝体和子实体经乙酸乙酯萃取后的总三萜纯度显著提高,分别为65.35%、42.32%。其中,子实体乙酸乙酯萃取及硅胶纯化后的总三萜纯度是之前文献通过大孔树脂纯化粗毛纤孔菌三萜的1.52 倍[18]。本试验方法用于粗毛纤孔菌三萜的纯化,不仅操作简单方便,还可以大幅度提高三萜的纯度和生物活性,可以为粗毛纤孔菌三萜类化合物高效纯化方法的选择提供试验基础。有研究表明三萜类化合物可以促使胆固醇在肝脏中更快地转化胆汁酸,能较好地与胆酸钠、甘氨胆酸钠和牛磺胆酸钠结合。其中牛磺胆酸钠的结合量最大,可能是在羟基含量相同时,牛磺胆酸钠的疏水性比胆酸钠和甘氨胆酸钠更强,可以通过疏水作用能更好地吸附于其他羟基中,从而达到较好的降血脂效果[16, 21]。
本研究发现:菌丝体总三萜纯化后的胆酸钠、甘氨胆酸钠、牛磺胆酸钠结合能力都得到了增强,分别为1.14、1.78和2.06 μmol/100 mg;子实体纯化后总三萜的胆酸钠、甘氨胆酸钠和牛磺胆酸钠结合能力分别为0.89、1.49和1.77 μmol/ 100 mg;子实体总三萜经萃取和硅胶纯化后的胆酸钠、甘氨胆酸钠和牛磺胆酸钠分别是前期课题组[22]大孔树脂纯化后总三萜的1.39、1.18和1.12 倍。上述结果表明说明本试验通过有机溶剂的初步萃取和硅胶条件的优化,显著提高了粗毛纤孔菌总三萜纯度和体外胆酸盐的结合能力,然而粗毛纤孔菌菌丝体和子实体总三萜单体的分离和结构仍需深入鉴定。粗毛纤孔菌作为一种药用真菌,对人体有保健作用,对疾病有治疗、预防或抑制作用。因此,进一步研发粗毛纤孔菌的功能成分尤其是三萜类化合物的功,对药用真菌的研究和利用具有重要意义。

