血管内皮生长因子-B对高糖环境下人视网膜色素上皮细胞凋亡的保护作用△
赖诚 李明新
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病患者常见的微血管并发症之一[1]。视网膜色素上皮(retina pigment epithelium,RPE)作为血-视网膜外屏障(blood-retinal barrier,BRB)的重要部分,在DR发展过程中出现了不可逆的细胞和分子功能障碍[2]。血管内皮生长因子-B(vascular endothelial growth factor-B,VEGF-B)与VEGF-A一样与VEGFR1和NP1两种受体结合,已被证明是一种有效的神经保护因子和不同类型神经元细胞凋亡的抑制剂[3-6]。Huang 等[7]研究发现,高糖环境能上调RPE细胞内 VEGFR1和NP1表达,VEGF-B具有抑制高糖诱导的视网膜细胞凋亡作用,但机制尚不清楚。Li 等[4]发现,在小鼠脑微血管内皮细胞和皮层神经元中,VEGF-B处理后能够导致细胞外信号调节激酶1/2(extracelluar regulated protein 1/2,ERK1/2)活化。因此,本实验在此基础上探讨VEGF-B对人视网膜色素上皮细胞(human retinal pigmentepithelial cells,HRPE-19)细胞株ARPE-19在高糖环境下细胞凋亡的保护作用及机制,为临床上各种视网膜退行性病变的治疗提供新的思路及理论依据。
1 材料与方法
1.1 主要材料及仪器ARPE细胞株(American Type Culture Collection,ATCC,美国);VEGF-B(Peprotech,美国);PD98059(Cell Signaling,美国);DMEM/F-12培养基及胎牛血清(Gibco,美国);CCK8试剂盒(日本同仁化学研究所); SDS-PAGE试剂盒(碧云天,中国);Western blot二抗(Santa Cruz,美国);逆转录试剂盒(日本Takala公司);倒置显微镜(日本Olympus公司);冷冻超速离心机、流式细胞仪(德国Eppendorf公司)。
1.2 方法
1.2.1 细胞培养及实验分组ARPE-19用含体积分数10%胎牛血清的DEME/F12培养基于 37 ℃、体积分数5% CO2,湿度90%的培养箱中培养。取生长状态良好的细胞用于实验,培养基更换为无血清5.6 mmol·L-1DMEM培养基同步化24 h。将其分为正常组(体积分数10%胎牛血清+5.6 mmol·L-1葡萄糖)、高糖组(体积分数10%胎牛血清+30 mmol·L-1葡萄糖)、药物组(100 μg·L-1VEGF-B+体积分数10%胎牛血清+30 mmol·L-1葡萄糖)、抑制组[20 μmol·L-1PD98059(ERK1/2阻滞剂)+100 μg·L-1VEGF-B+体积分数10%胎牛血清+30 mmol·L-1葡萄糖]。
1.2.2 CCK8检测各组细胞存活率各组ARPE-19以每孔5000个的细胞密度接种于96孔培养板内,每孔加入100 μL含体积分数10%胎牛血清的培养基,37 ℃孵育24 h使细胞贴壁,换体积分数1.5%胎牛血清的培养基同步化,予相应处理后弃培养基,每孔中加入100 μL培养基和10 μL CCK-8试剂,孵育箱内培养2 h,用酶标仪检测波长450 nm处的光密度(A)值,计算各组细胞存活率。
1.2.3 流式细胞仪检测各组细胞凋亡率胰蛋白酶消化并收集各组细胞,1000 r·min-1离心5 min,弃上清液。PBS洗涤两次,1000 r·min-1离心5 min,弃上清液。加入500 μL的1×Binding Buffer重悬细胞后各加入5 μL Annexin V-FITC混匀,室温避光20~30 min,1000 r·min-1离心5 min,弃上清液。加入500 μL Binding Buffer重悬细胞,再加入5 μL PI混匀,室温避光保存,1 h内上机检测。分析各组细胞凋亡率。
1.2.4 Western blot检测各组细胞凋亡相关蛋白Bcl-2、Bax、ERK1/2、p-ERK1/2的表达BCA法测定蛋白浓度,上样、电泳、转膜后封闭3 h,加入一抗(抗Bcl-2、Bax抗体为1500,抗p-ERK抗体为11000,抗ERK抗体为12000),4 ℃过夜,洗膜3次;加入二抗室温2 h后,洗膜5次。ECL显影,Image J软件分析灰度值。
1.2.5 实时荧光定量PCR检测各组细胞Bcl-2 mRNA、Bax mRNA的表达用Trizol试剂提取RNA,测量RNA浓度。Bax上游引物为5’-TCCACCAAGAAGCTGAGCGAG-3’,下游引物为5’-GTCCAGCC CATGATGGTTCT-3’;Bcl-2上游引物为5’- TTCTTTGA GTTCGGTGGGGTC-3’,下游引物为5’-TGCATATTTGTTTGGGGCAGG-3’。采用RT-PCR试剂盒逆转录合成cDNA。反应条件:94 ℃ 1 min预变性,95 ℃ 20 s、60 ℃ 15 s、72 ℃ 15 s,40个循环。PCR反应结束后,收集并分析数据。

2 结果
2.1 倒置显微镜下观察各组细胞的形态变化倒置显微镜下观察发现,正常组和药物组细胞体积大,有突起从胞体伸出;高糖组细胞皱缩变圆,体积明显变小;与高糖组相比,抑制组细胞体积大,突起多。见图1。
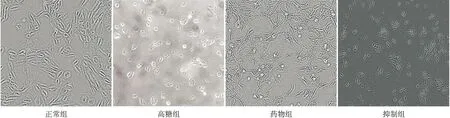
图1 倒置显微镜下各组细胞的形态学特点(×200)
2.2 CCK-8检测各组细胞活性与高糖组相比,正常组、药物组、抑制组在450 nm处的A值增加,差异有统计学意义(t=57.126、31.649、20.859,均为P<0.05)。与正常组相比,高糖组细胞存活率下降,差异有统计学意义(t=31.411,P<0.05);与高糖组相比,药物组细胞存活率升高,差异有统计学意义(t=31.129,P<0.05);抑制组细胞存活率介于高糖组与药物组之间,差异有统计学意义(F=482.606,P<0.05)。见表1。


组别A值细胞存活率/%正常组0.685±0.011100.000±3.000高糖组0.308±0.00244.979±0.452药物组0.506±0.06473.260±1.507抑制组0.414±0.00860.538±1.413
2.3 流式细胞仪检测各组细胞凋亡率各组细胞凋亡率为:正常组(3.29±0.67)%、高糖组(15.50±0.45)%、药物组(8.41±1.05)%、抑制组(10.33±1.14)%。与正常组相比,高糖组细胞凋亡率增加,差异有统计学意义(t=25.895,P<0.05);与高糖组相比,药物组细胞凋亡率减少,差异有统计学意义(t=10.655,P<0.05)。抑制组细胞凋亡率介于高糖组和药物组之间,差异有统计学意义(F=98.358,P<0.05)。见图2。
2.4 Western blot检测各组凋亡相关蛋白Bcl-2、Bax、p-ERK1/2、ERK1/2的表达与正常组比较,高糖组Bcl-2表达减少、Bax表达增多、Bcl-2/Bax比值降低,差异均有统计学意义(t=14.264、25.626、56.885,均为P<0.05);与高糖组比较,药物组及抑制组Bcl-2表达均增多(t=7.383、5.327 ,均为P<0.05),Bax表达均降低(t=15.087、6.890,均为P<0.05),Bcl-2/Bax比值均升高(t=9.240、7.464, 均为P<0.05);与药物组比较,抑制组Bcl-2表达减少、Bax表达增多、Bcl-2/Bax比值降低,差异均有统计学意义(t=2.717、7.580、5.240,均为P<0.05)。见图3。
与正常组比较,高糖组p-ERK1/2表达量增多(t=9.067,P<0.05);与高糖组比较,药物组及抑制组p-ERK1/2表达量均增多(t=20.505、8.244 , 均为P<0.05);与药物组比较,抑制组p-ERK1/2表达量降低,差异有统计学意义(t=13.028,P<0.05)。四组总的ERK1/2表达水平不变,差异无统计学意义(F=3.050,P>0.05)。见图4。
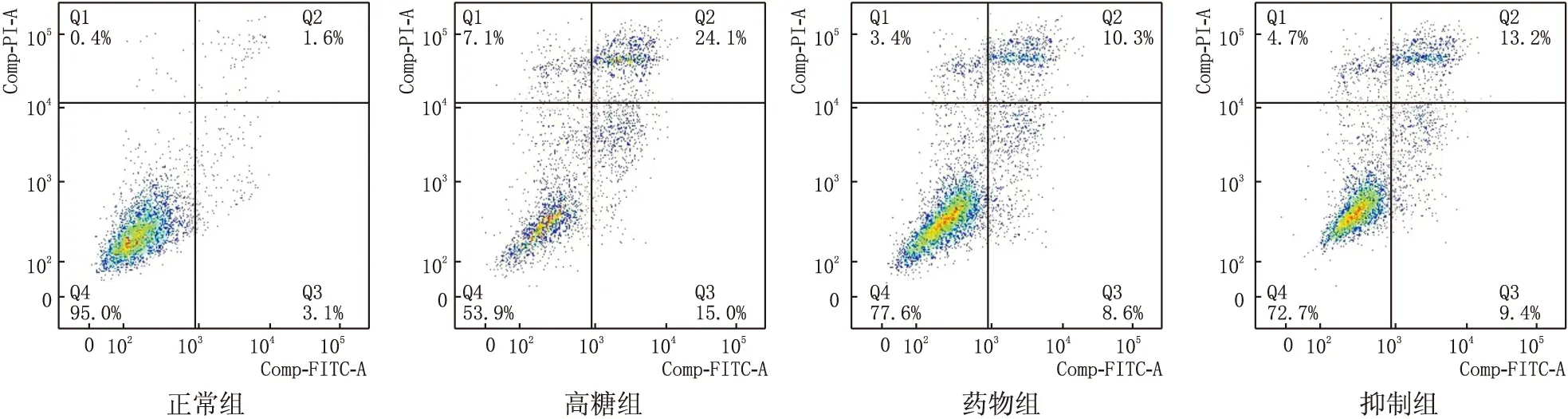
图2 流式细胞仪检测各组细胞凋亡率
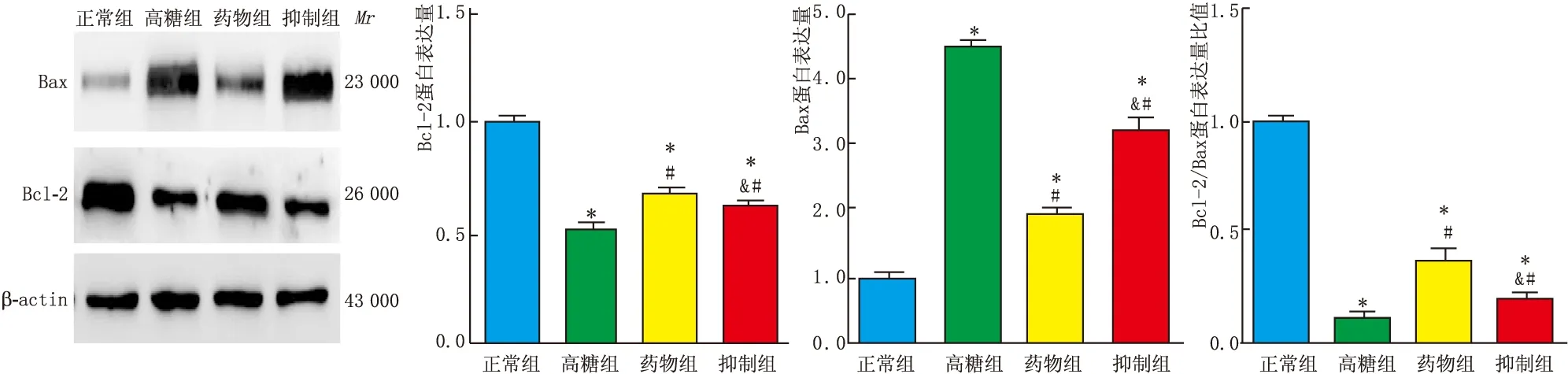
图3 Western blot检测各组细胞凋亡相关蛋白Bax、Bcl-2的表达 与正常组比较,*P<0.05;与高糖组比较,#P<0.05;与药物组比较,&P<0.05
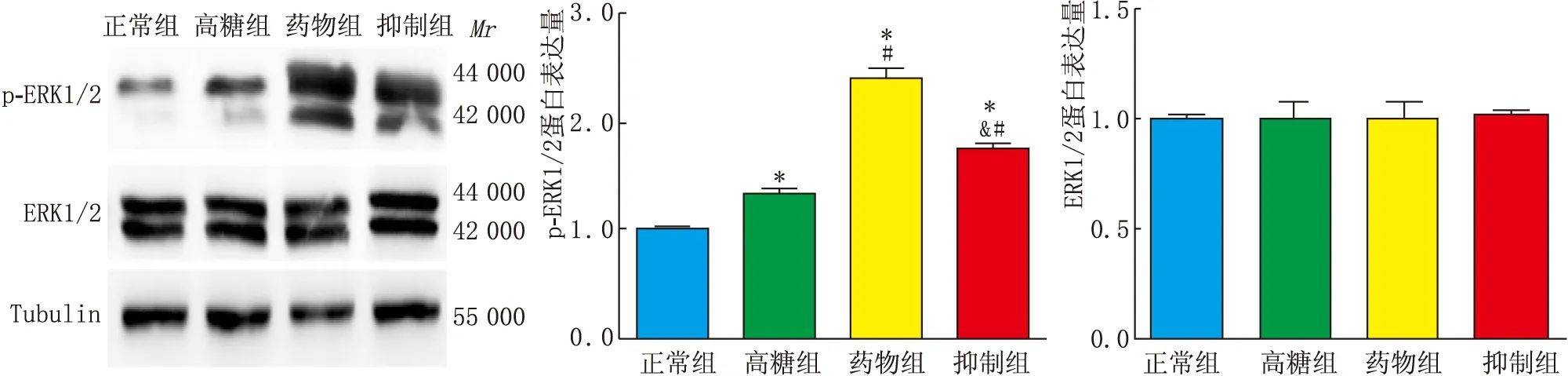
图4 Western blot检测各组细胞凋亡相关蛋白p-ERK1/2、ERK1/2的表达 与正常组比较,*P<0.05;与高糖组比较,#P<0.05;与药物组比较,&P<0.05
2.5 实时荧光定量PCR检测各组细胞Bcl-2 mRNA、Bax mRNA的表达与正常组比较,高糖组的Bcl-2 mRNA表达量降低、Bax mRNA表达量增加、Bcl-2 mRNA/Bax mRNA比值降低,差异均有统计学意义(t=14.264、25.626、56.885,均为P<0.05);与高糖组比较,药物组Bcl-2 mRNA表达量增加、Bax mRNA表达量降低、Bcl-2 mRNA/Bax mRNA比值升高,差异均有统计学意义(t=7.383、15.087、9.240,均为P<0.05)。抑制组Bcl-2 mRNA与Bax mRNA表达量介于高糖组和药物组之间,差异均有统计学意义(F=90.178、171.518,均为P<0.05)。见表2。


组别Bcl-2 mRNABax mRNABcl-2 mRNA/Bax mRNA正常组1.00±0.031.00±0.021.00±0.01高糖组0.40±0.044.49±0.090.17±0.02药物组0.71±0.021.92±0.060.55±0.06抑制组0.63±0.023.27±0.090.33±0.02
3 讨论
VEGF-B是血管内皮细胞、周细胞和平滑肌细胞等多种细胞的有效存活因子[3],主要通过结合VEGFR1和NP1两种受体发挥生理功能,但其下游的信号转导途径目前尚不清楚[8]。RPE细胞是视网膜中VEGF的主要来源之一[9],有研究表明,RPE细胞可能是高糖条件下VEGF-B主要靶细胞[7]。Huang等[7]利用大鼠糖尿病模型研究发现,VEGF-B及其受体在正常大鼠视网膜和脉络膜中表达,且被高糖上调,同时导致Akt、Erk的活化,证实了VEGF-B抑制高糖诱导的视网膜细胞凋亡。本研究通过CCK-8检测细胞存活率及AnnexinV-FITC/PI双染色法检测细胞凋亡率发现,高糖环境下ARPE-19细胞体积变小皱缩变圆,细胞存活率明显下降,凋亡率明显升高。而VEGF-B处理后细胞存活率明显上升,凋亡率明显下降,证实VEGF-B通过抑制凋亡率来实现对高糖环境下ARPE-19的保护作用。本研究与刘玉洁等[10]研究VEGF-B对大鼠视网膜神经节细胞株(retinal ganglion cell-5,RGC-5)细胞缺氧损伤的保护和抑制细胞凋亡结果是一致的。
ERK1/2在细胞凋亡的过程中发挥重要作用[11]。研究表明,长期高糖应激激活p38丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)和JNK,上调线粒体Bim,下调Bcl-2[12];Bcl-2蛋白具有抗凋亡作用,而Bax蛋白是促凋亡蛋白的家族成员,Bcl-2与Bax的比值反映细胞凋亡的水平[13]。 本实验采用ARPE-19为研究对象,发现VEGF-B影响凋亡相关蛋白Bcl-2和Bax表达,实验中VEGF-B通过增加ARPE-19的抗凋亡蛋白Bcl-2表达、降低促凋亡蛋白Bax表达发挥抗凋亡作用,而VEGF-B的抗凋亡作用可以被ERK1/2阻滞剂PD98059部分阻断,其中四组总的ERK1/2表达不变。p-ERK1/2是ERK1/2的活性形式,p-ERK1/2表达量在药物组较高糖组增加,而抑制组的p-ERK1/2表达量比药物组下降。这与Li等[6]研究发现VEGF-B主要通过抑制BH3-only蛋白基因从而抑制多种细胞凋亡,其中在小鼠脑微血管内皮细胞中,VEGF-B处理导致ERK1/2活化的结果相似。生理状态下p-ERK1/2表达水平较低,当受到应激损伤刺激后,p-ERK1/2表达水平升高发挥保护作用,而VEGF-B处理后p-ERK1/2表达水平更高,且经ERK1/2抑制剂处理后p-ERK1/2表达水平明显下降,提示VEGF-B对高糖环境诱导的ARPE-19凋亡的保护作用部分是通过ERK1/2信号通路完成的。
本研究采用体外细胞培养,相较于动物实验,影响因素相对单一,利于人为控制,适合药物作用机制的研究。其次,体外培养ARPE-19可以创造无血管内皮细胞参与的实验条件,有利于研究VEGF-B直接作用视网膜细胞来保护视神经的可能性。不足之处在于缺少体内实验支持,难于解释复杂的分子机制;同时样本数较少,对结果可能有一定的影响。总之,本研究发现VEGF-B对高糖环境下的ARPE-19凋亡具有保护作用,其作用机制部分是通过ERK1/2信号通路,调节Bcl-2、Bax等相关基因的表达来完成。VEGF-B是否还与其他的凋亡相关蛋白有关则有待于进一步的研究。

