CDKN2A和CDKN2B区域间的基因多态性与汉族人群颅内动脉瘤性别差异性的关联分析
欧阳嶷,阎雪晶,刘 颖,张 婧
(中国医科大学附属第一医院神经内科,辽宁 沈阳 110001)
蛛网膜下腔出血(subarachnoid hemorrhage,SAH)是一种危及生命的脑血管病急重症,约有80%的SAH是由颅内动脉瘤(intracranial aneurysm,IA)破裂造成的,女性罹患SAH和IA的比率约为男性的1.6倍[1-2]。近来,全基因组关联研究(GWAS)证实染色体9p21.3的CDKN2A-CDKN2B区域与欧洲、日本人群的多种血管疾病相关[3-5],但迄今为止CDKN2A-CDKN2B区域基因多态性与汉族人群IA是否存在关联仅有少数报道[6],尚无定论。
本研究以中国汉族IA病例作为研究对象,通过病例对照的关联分析方法,研究CDKN2ACDKN2B区域的基因多态性与汉族人群IA的相关性。在此基础上,采用分层分析的方法,从遗传学角度探讨存在于IA患者的性别差异与上述基因多态性是否存在关联。
1 资料和方法
1.1 研究对象
1.1.1 入选标准:IA组:选取近十年由中国医科大学附属第一医院神经内科和神经外科门诊、急诊及病房确诊的IA患者500 例,入选病例均为汉族。所有患者均经数字血管减影造影(DSA)和/或头部三维CT血管造影(3D-CTA)和/或头部核磁血管造影(MRA)或手术证实存在IA(指囊性动脉瘤)。
对照组:同时期500 名健康志愿者,均为汉族,无血缘关系,年龄和性别与IA组相匹配,无心脑血管疾病、血液系统疾病、肝肾疾病、肿瘤、感染以及自身免疫性疾病等。所有对照组成员经神经影像学(MRA或3D-CTA)证实无IA。
研究经过中国医科大学伦理委员会通过,所有受试者均签署知情同意书。年龄未满18 岁或存在重度功能残疾者(如意识障碍、严重肢体功能障碍等)均需征得法定监护人同意并签字。
1.1.2 排除标准:有下列情况之一者,予以排除:各种血液系统疾病或有出血倾向者(血小板计数<100 ×109/L);有严重的肝肾疾病、肿瘤、感染、自身免疫性疾病等;存在多囊肾、Ehlers Danlos综合症、Marfan综合症、Moyamoya病、肌纤维发育不良及镰状细胞病者;经神经影像学证实的梭形动脉瘤或颅内动脉夹层者或动静脉畸形者;未取得患者或法定监护人知情同意者。
1.2 受试者临床资料采集 记录研究对象的年龄、性别、吸烟史、饮酒史、家族史、既往史、用药史等。记录研究对象的高血压病史。根据神经影像学资料(DSA、3D-CTA或MRA)记录IA组IA的数量(单发IA和多发IA),并记录IA组中单发IA者的IA部位(前循环、后循环及其它)。在记录上述临床资料的基础上,再按性别分别记录和统计。
1.3 研究位点选择 参阅文献,查找美国国家生物技术信息中心网站 (http://www.ncbi.nlm.nih.gov/SNP/),根据Iternational HapMaP Project数据库中CHB的基因组遗传变异资料确定基因各SNP分布频率。利用HaploView软件中的Tag algorithm筛选标签SNP(Tag SNPs)。优先选取位于蛋白编码区可导致氨基酸序列改变、5'或3'非转录区、启动子区等具有潜在功能学意义的位于9p21.3的CDKN2A-CDKN2B区域4 个与血管疾病相关的SNP(rs1333040、rs2891168、rs2383207和rs10757278)作为研究位点。
1.4 基因多态性检测 IA组和对照组每个受试者采集2~3 mL静脉血,EDTA抗凝,应用全血基因组DNA提取试剂盒提取基因组DNA。将提取的人基因组DNA用紫外分光光度仪进行纯度鉴定和定量分析。对所有研究对象的DNA应用TaqMan SNP基因分型检测技术(ABI 7900)检测上述位点的基因型。设计并合成本实验所需的TaqMan探针,探针引物序列见表1。

表1 各SNP探针引物序列Tab.1 Primer sequences of SNP probes
PCR反应体系为:人基因组DNA 20 ng(1 μL),上下游引物各0.5 μL,probe-FAM和probe-VIC各0.2 μL,Taqman Genotyping Master Mix 10 μL,用ddH2O补足至20 μL。采用PCR自动扩增仪扩增。扩增条件为:95 ℃预变性10 min,95 ℃变性15 s,以60 ℃退火60 s,72 ℃延伸60 s,循环40次,最后72 ℃延伸5 min。
1.5 统计学分析 获得样本个体基因型后,将所有结果数字化录入数据库,利用统计分析软件包SPSS 13.0进行相关的统计分析。计数资料的比较采用χ2检验。计量资料的比较采用t检验。基因型和等位基因频率的比较采用χ2检验。P<0.05为差异有统计学意义。
应用χ2拟合优度检验分析IA组和对照组基因型频率分布是否符合H-W平衡。假定p代表双态遗传标记的一个等位基因频率,q代表另一个等位基因频率,在一个随机婚配群体中,基因型频率分布应符合二项式分布:即(p+q)2=p2+2pq+q2=1。采用公式(1-Ho/He)2×n,Ho为观察到的杂合子基因型频率,He为期望值(He=2pq),n为受检个体数目,df=1,如P>0.05,则说明样本符合H-W平衡。应用SPSS 13.0软件包Logistic回归模型中的二分类反应变量的Logistic回归校正IA的危险因素(高血压、吸烟及饮酒过量)及年龄的影响,探讨基因型与汉族IA人群的相关性。利用多变量Logistic回归分析研究上述临床资料各分层(IA的数量分层及位分层)中CDKN2A-CDKN2B区域变异的频率与对照组的差别。为评估性别差异性效应,将男性和女性的数据分别统计分析,并且在校正传统危险因素的基础上,在回归模型中引入基因型*性别交互变量(interaction variable)进一步证实性别差异与基因型的关系。
2 结果
2.1 研究对象的临床资料汇总 研究表明,与对照组相比,高血压、大量饮酒与IA的发生相关(P<0.05),是IA发生的危险因素(表2)。

表2 研究对象临床资料一览表Tab.2 List of clinical data of the subjects
2.2 所检各SNP分型图及基因型检测结果 对IA组和对照组每个SNP基因型应用χ2拟合优度检验进行Hardy-Weinberg平衡检验,结果显示上述两组各SNP位点基因型频率分布没有偏离Hardy-Weinberg平衡(P>0.05)。说明本研究选取的样本具有人群代表性,适合做遗传学分析。
各SNP分型图及基因型检测结果如图1(见封二)所示。

在rs1333040位点上,基因型频率分布差异有统计学意义:IA组T/T基因型的频率明显高于对照组,C/C基因型的频率明显低于对照组,基因型频率比较χ2=7.934,P=0.005,OR=2.148, 95%CI1.255~3.675。在等位基因频率比较中,IA组与对照组差异也有统计学意义:IA组T等位基因频率(64.0%)明显高于对照组(56.4%),C等位基因的频率(36.0%)明显低于对照组(43.6%),等位基因频率与对照组比较χ2=6.278,P=0.012,OR=1.378,95%CI1.072~1.771。说明rs1333040与汉族人群IA发病密切相关,其风险性主要来源于T等位基因。未发现CDKN2A-CDKN2B区域所检其它SNP位点与汉族人群的IA发病相关(表3)。

表3 IA组与对照组SNPs基因型与等位基因频率比较一览表Tab.3 Comparison of SNPs genotype and allele frequency between IA group and control group
2.3 IA发生风险的多因素分析 如前所述,在IA组rs1333040位点的T/T基因型频率明显高于对照组,因此对rs1333040位点TT+CT基因型行进一步统计学处理,与基因型C/C比较,应用Logistic回归校正性别、年龄及其他环境危险因素(饮酒、吸烟等)后TT+CT基因型频率IA组和对照组比较差异仍然有统计学意义,提示rs1333040位点的TT基因型及T等位基因是IA的独立危险因素,其患病风险率增加至1.796倍。多发IA和单发IA亚组比较发现,与上述各SNP位点的基因频率分布均无明确相关。在亚组分析中,rs2891168位点上,不同基因型中患者的IA发生部位存在差别,其A/A基因型与前循环分布区的IA密切相关(P=0.025)。未发现其它所检SNP位点不同基因型的患者在IA发生部位上的差别。
2.4 按性别进行统计的亚组分析 在校正了年龄、血压、吸烟、饮酒等影响因素后,rs1333040 T/T基因型与汉族男、女IA发病均密切相关,但与女性IA的关联程度更高(表4)。
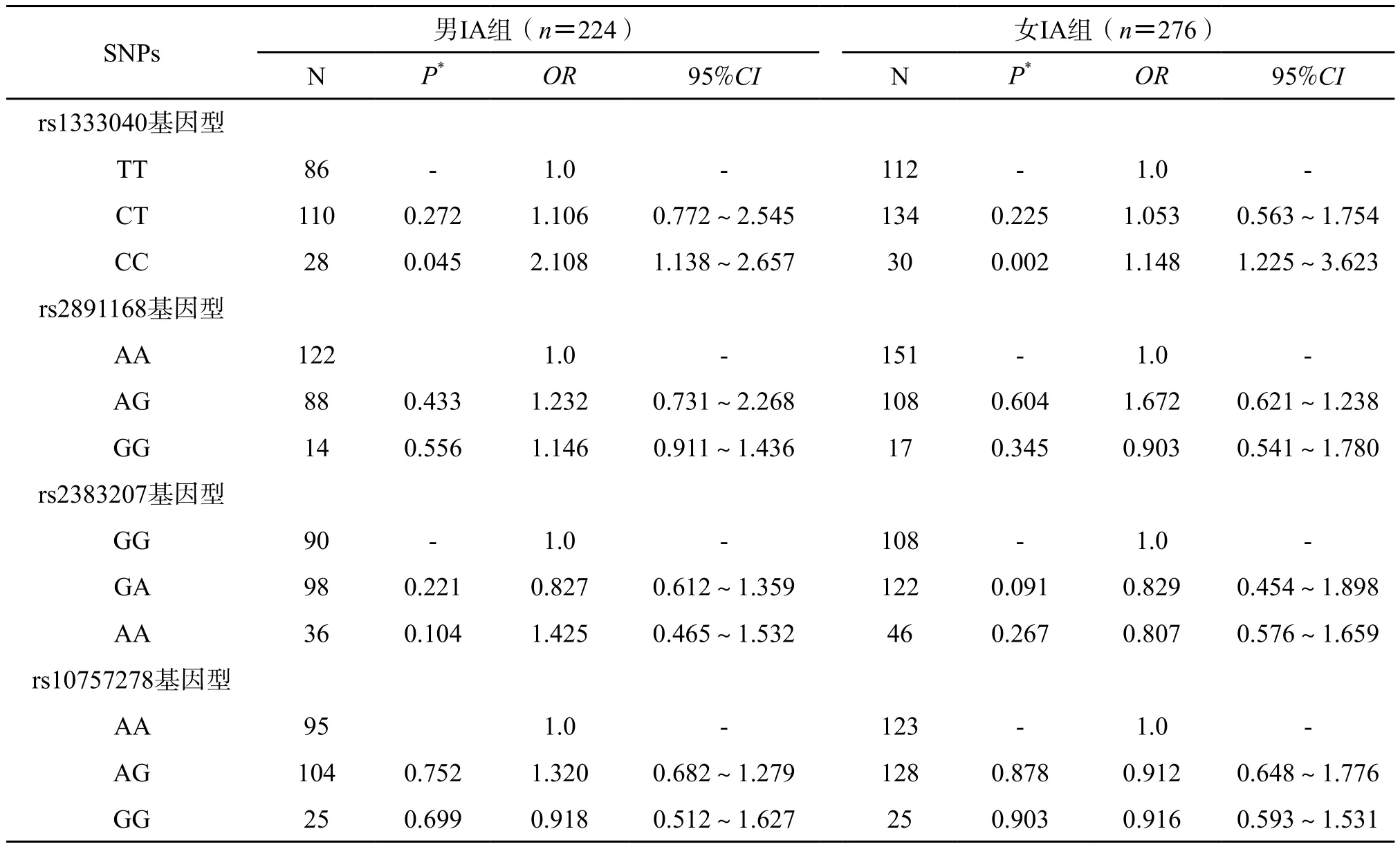
表4 IA患者SNPs基因型性别差异效应分析Tab.4 Analysis of sex differential effect of SNPs genotypes in IA patients
3 讨论
近年来,国内外多数学者认为,IA的形成、发展和破裂是遗传和环境因素共同作用的结果[2,7]。同其它血管疾病类似,其常见的危险因素为高血压、吸烟及饮酒过量[8]。然而,迄今为止,人们对IA的分子生物学发病机制还知之甚少。
目前国际上针对欧洲和日本人群开展了关于IA的大样本GWAS,并报道了数个与IA相关联的区域,分别位于染色体18q11.2、13q13.1、10q24.32、8q11.23-q12.1以及9p21.3[7,9]。其中,有数项独立研究发现位于9p21.3的CDKN2A-CDKN2B区域不仅与北欧、日本人群的IA相关,而且与缺血性脑卒中、心肌梗死、腹主动脉瘤、2型糖尿病等多种血管疾病存在关联[3-5]。虽然该区域的功能尚不明确,但有人推测位于该区域的假定危险基因可能与细胞周期分裂过程相关,在人体血管的形成和修复方面发挥着重要的作用[9]。因此,CDKN2A-CDKN2B被认为是最有希望发现IA等血管疾病关键性致病基因的区域之一[4,10]。
本研究证实了位于9p21.3的CDKN2A-CDKN2B区域4 个与血管疾病相关的SNP位点(rs1333040、rs2891168、rs2383207和rs10757278)中,rs1333040与汉族人群IA发病密切相关,是IA的独立危险因素。此外,本研究表明,rs1333040 T/T基因型与汉族男、女IA发病均密切相关,但与女性IA的关联程度更高,提示基因和性别在IA发生中具有一定的影响作用。绝大多数年龄段(<85 岁)的缺血性或出血性卒中,均为男性高发,这与男性具有更高的卒中危险因素(如吸烟、饮酒等),且内源性雌激素可能对卒中有保护作用有关[11-12]。然而,如前所述,SAH在流行病学方面却具有与其它脑血管疾病截然不同的特点。其中最为突出的是,女性较男性更易发生SAH。迄今为止,女性易发生IA破裂导致SAH的机制尚不明确,国内外也罕有这方面的研究报道。Lin等[13]通过研究,证实染色体9p21对于亚临床性动脉粥样硬化存在性别差异性的遗传效应,说明发病率的性别差异可能有其相应的遗传学机制。本研究通过对CDKN2A-CDKN2B区域的关联分析,从遗传学角度进一步诠释女性易患IA及SAH这一流行病学现象的原因,为IA流行病学研究提供了遗传学依据,也为今后开展上述区域IA相关位点的功能研究奠定基础,具有一定的临床实用价值和应用前景。
但是,实现以基因为导向的IA及SAH个体化预防、诊疗仍然任重道远。今后,在本研究的基础上,可以在以下方面进一步深入探讨:首先,本研究结果提示rs1333040与汉族人群IA发病密切相关,是IA的独立危险因素。但脑血管病属于多基因遗传病,该SNP与其它易感基因之间是否存在交互作用尚不得而知,有待于将来进一步的研究加以证实。其次,脑血管病病因复杂,是由遗传与环境共同作用而致病的。今后应建立环境-基因、基因-基因、基因-基因-环境交互作用的模型,进行多因素交互效应的探索分析,为IA的发生、发展和预后提供更为详实和客观的分子流行病学资料。此外,今后应开展上述区域IA相关位点的功能研究,明确上述SNP对相关蛋白表达以及功能的影响,从而为最终阐明IA的发病机制及遗传易感性机理打下理论基础。

